一文汇总!详解最新的3款肝内胆管癌靶向药
2023-03-30 徐朋朋 邱立新 邱立新医生 发表于上海
目前已有2款泛FGFR抑制剂获批用于治疗胆道恶性肿瘤,分别是佩米替尼和infigratinib。
肝内胆管癌(ICC)是原发性肝癌的一种类型,起源于肝内胆管上皮细胞,其发病隐匿,进展快。ICC发病率在全世界范围内呈明显上升趋势。亚洲人群胆管癌发病率明显高于欧美人群。
多数ICC患者就诊时已处于中晚期,失去根治性手术机会,导致患者预后不佳。除肿瘤因素外,肝炎和肝硬化程度、肝功能代偿情况和门静脉高压等因素也限制肝癌临床治疗方法的选择。
近10年来,晚期肝内胆管癌(ICC)治疗一线标准方案吉西他滨联合顺铂(GC)的地位无法撼动,但生存获益有限,mOS少于1年,且二线治疗方案选择有限。2022年ASCO-GI公布了Ⅲ期TOPAZ-1 研究结果,度伐利尤单抗联合GC方案与单纯GC方案相比,两组的mOS分别为 12.8个月和11.5个月、mPFS分别为7.2个月和5.7个月,并且死亡风险降低20%。这一研究结果使得晚期肝内胆管癌的治疗迎来了新突破。
同时针对晚期肝内胆管癌(ICC)的靶向治疗中也发展较快,近3年来已有IDH、FGFR抑制剂相关药物陆续获批,尤其是FGFR抑制剂的开发尤为引人注目,其将是未来晚期ICC治疗的新策略。
下面就FGFR抑制剂做一梳理
FGFR家族主要包括4种亚型:FGFR1、FGFR2、FGFR3和 FGFR4,参与细胞增殖、新血管生成、侵袭、转移、抗凋亡等。其常见突变类型为扩增、胞外结构域突变、激酶结构域突变、FGFR 融合、重排。当FGFR 过表达时,以经典 Ras/丝裂原活化蛋白激酶及磷脂酰肌醇-3-激酶-蛋白激酶B为主的信号通路被激活,诱导正常细胞癌变。
FGFR突变在ICC中多见,突变频率高于其他癌种,其中FGFR2融合占15%,点突变上3%-5%。FGFR小分子抑制剂大致分为两类:泛/高选择性FGFR抑制剂和多靶点酪氨酸激酶抑制剂类药物。
目前已有2款泛FGFR抑制剂获批用于治疗胆道恶性肿瘤,分别是佩米替尼和infigratinib。
佩米替尼
佩米替尼是FGFR2选择性抑制剂,基于FIGHT-202 后期三臂Ⅱ期临床试验,2020年被美国FDA批准用于FGFR2融合或重排的局部晚期或转移性肝内外胆管癌的治疗。佩米替尼是首款获批用于二线治疗晚期BTC的靶向药物,这也是胆道恶性肿瘤治疗史上一个里程碑事件。
FIGHT-202是一项多中心、开放、单臂二线治疗晚期胆道肿瘤患者的Ⅱ期研究,研究共纳入146例经过≥1线治疗的晚期胆道肿瘤患者,这些患者既往不能接受过选择性FGFR抑制剂治疗。该研究共分为3个队列,A组:FGFR2融合/重排(n=107,98%为肝内胆管癌患者),B组:其他FGFR突变(n=20),C组:非FGFR突变(n=18),1名患者未定。所有患者均接受Pemigatinib治疗(13.5 mg qd 用2周停1周)。主要研究终点:评估FGFR2融合或重排患者的客观反应率ORR。次要终点:所有患者中ORR和反应持续时间DOR,疾病控制率DCR、PFS、OS、安全性。
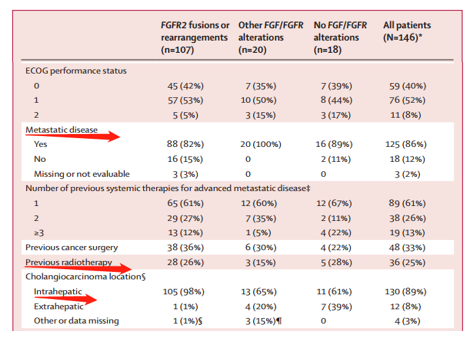
结果显示
主要研究终点:A组ORR为35.5%,其中3例患者完全缓解(CR),CR率为2.8% ,PR率为32.7%,DCR为82%,mDOR为7.5个月,B、C组ORR为0。
次要研究终点:mPFS分别为6.9 个月,2.1个月和1.7个月 。
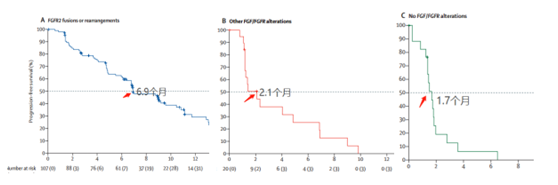
次要研究终点:mOS分别为:21.1个月、6.7个月和4个月。
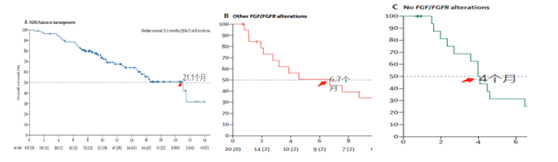
不良反应方面:1-2级最常见不良反应是高磷血症(55%),脱发(46%),腹泻(38%),疲劳(31%)和味觉障碍(29%)等。
我国开展的CIBI375A201桥接研究共纳入34例胆管癌患者,最新数据显示:佩米替尼在我国人群中的客观缓解率、疾病无进展生存时间经研究者评估分别为56.7%、9.6个月,上述指标经独立影像学评审委员会(IRRC)评估分别为 60%、9.1 个月,患者总生存率尚未达到随访终点。
2022年3月29日,基于FIGHT-202和CIBI375A201研究良好的疗效结果,国家药品监督管理局(NMPA)批准了中国首个FGFR抑制剂佩米替尼用于既往至少接受过一种系统性治疗且存在FGFR2融合/重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗,实现中国晚期胆管癌二线治疗新突破,带来精准靶向治疗新选择。
《肝内胆管癌诊疗中国专家共识(2022版)》建议肝内胆管细胞癌患者进行基因检测,FGFR2融合或重排者推荐使用佩米替尼(证据等级:3,推荐等级:强推荐)。
目前,对比佩米替尼和标准一线化疗的Ⅲ期临床试验正在进行中。
为了帮助更多的患者及家属了解最新关于胆道恶性肿瘤治疗方案,故建立胆道恶性肿瘤治疗会诊群,关于胆道恶性肿瘤方案详情可免费咨询我们。
佩米替尼合理用药要点:
1.用药前应采用验证过的检测方法确定患者存在FGFR2融合或重排。
2.推荐剂量为13.5mg/次,1/日,口服,连续服用14天,随后停药7天,每21天为一个治疗周期,持续治疗直至疾病进展或出现不可耐受的毒性。漏服少于4小时,需尽快服用漏服的剂量,然后在预定时间服用下一次剂量。但是,如果错过了4小时或更长时间,继续常规用药计划,不要为了弥补漏服的剂量而服用双倍的剂量。
3.常见的不良反应包括:高磷酸血症、脱发、腹泻、指(趾)甲毒性、疲乏、恶心、味觉倒错、口腔黏膜炎、便秘、口干、干眼症、关节痛、低磷酸血症、皮肤干燥和掌跖红肿综合征。
4.不良反应的推荐剂量调整:第1次减量,每21天周期的前14天,9mg/次,1/日;第2次减量,每21天周期的前14天,4.5mg/次,1/日。如果减量至4.5mg/次,1/日仍无法耐受,应永久停用。
5.佩米替尼可导致高磷酸血症,当血清磷酸盐浓度>5.5mg/dl时,开始低磷饮食。对于血清磷酸盐浓度>7mg/dl,根据高磷酸血症的持续时间和严重程度,开始降磷治疗并暂停、降低剂量或永久停药。
6.佩米替尼可导致视网膜色素上皮脱离,临床表现为视物模糊、飞蚊症或闪光幻觉。在用药前应进行眼科检查(包括干涉光视网膜断层扫描),并在服药前6个月,每2个月检查一次,6个月后,每3个月检查一次。如果发现视觉症状,立即就诊,并每3周复查一次直至症状缓解。
7.避免与CYP3A强效或中效抑制剂联合使用,如果无法避免联合使用,剂量调整方案:剂量从13.5mg降至9mg,剂量从9mg降至4.5mg。停用CYP3A强效或中效抑制剂3个半衰期后,恢复佩米替尼原剂量。
8.对于重度肝功能损伤(总胆红素>3倍ULN伴任何AST)的患者,建议起始剂量为9mg。对于轻度(总胆红素>1~1.5倍ULN或AST>ULN)或中度肝功能损伤(总胆红素>1.5~3倍ULN伴任何AST)的患者,无需调整剂量。对于重度肾功能损伤患者,建议起始剂量为9mg。对于轻中度肾功能损伤的患者,建议不必调整剂量。对于接受间歇性血液透析的终末期肾病患者,建议不必调整剂量。
9.≥65岁的老年患者,建议在医生的指导下慎用。如需使用,无需调整起始剂量。不建议在儿童患者中使用。
Infigratinib
2021 年 ASCO-GI 会议上报告了infigratinibⅡ期临床研究结果,108例局部晚期或转移性肝内外胆管癌患者中(FGFR2 融合患者83例),ORR达23.1%,中位缓解持续时间达 5.0个月。
Futibatinib
Futibatinib是作为FGFR抑制剂,可抑制4种FGFR亚型。FOENIX-CCA2Ⅱ期研究中证实了其有效性、安全性和持久性后,Futibatinib于2022年获得了FDA的优先审查资格。在FOENIX-CCA2初步分析中,Futibatinib的ORR为 41.7%,mDOR为9.7个月;72%的应答者在6个月或6个月后继续表现出缓解。
2022年ASCO年会上,更新了FOENIX‑CCA2研究结果,包括额外的8个月随访数据(图1,图2,图3)。与之前的结果一致,ORR为41.7%,中位治疗时间为9.1个月。Futibatinib再次显示了耐受性,患者从基线到治疗开始后9个月的生活质量一致。
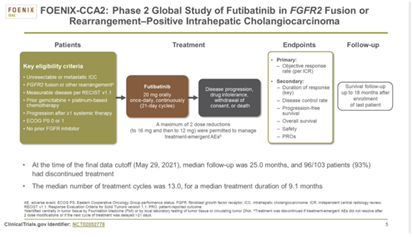
图1
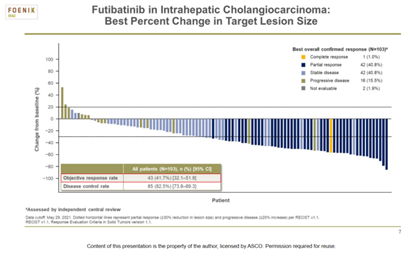
图2
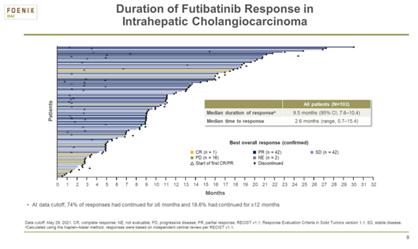
图3
2023年1月19日出版的《新英格兰医学杂志》中,发表了FOENIX-CCA2研究结果,证实futibatinib(TAS-120)对不可切除或转移性ICC具有治疗作用。

该研究纳入103例FGFR2基因突变(78%为基因重排,22%为基因融合)的ICC患者,患者在入组前接受吉西他滨加铂类化疗(未接受过任何FGFR抑制剂治疗)后发生了疾病进展。患者口服futibatinib(20 mg/日)治疗,直到疾病进展或出现不可耐受的不良反应。
通过中位17.1个月的随访,中位治疗时间为9.1个月。结果显示:103例患者中有43例(42%;95% CI,32-52)获得客观缓解,达到主要终点。其中31例获得超过6个月的持续缓解,中位持续缓解时间为9.7个月(95% CI,7.6-17.0)。103例患者中,85例患者(83%;95% CI,74~89)获得疾病控制, mPFS为9.0个月, mOS为21.7个月。此外,在≥65岁的亚组(ORR,65.2%)和入组前接受过多次治疗的难治性亚组(ORR,38.7%)中,ORR均达到了预期的研究终点。
安全性方面:不良事件主要包括高磷血症(85%)、脱发(33%)和口干(30%)等;10%的患者发生了严重治疗相关不良事件,但仅有2%的患者因此终止治疗。
此外,本研究采用ctDNA检测肿瘤突变特征,与穿刺活检相比较创伤更小。FGFR2突变ctDNA检出率达到87%,有利于在ICC患者中筛选对FGFR抑制剂敏感的人群。
与已上市的两款FGFR抑制剂相比较,futibatinib的中位持续缓解时间最长(9.7个月;pemigatinib为7.5个月,infigratinib为6.8个月;当然,不同试验结果的比较需要谨慎解读)
目前有3个FGFR抑制剂Futibatinib,Infigratinib和pemigatinib,对比标准一线化疗的Ⅲ期临床试验正在进行中。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







