NEJM:仑卡奈单抗(Lecanemab)治疗早期阿尔茨海默病(Clarity AD研究)
2023-01-05 MedSci原创 MedSci原创 发表于上海
仑卡奈单抗(Lecanemab)是一种用于治疗阿尔茨海默病的人源化单克隆抗体,可以选择性中和并清除导致阿尔茨海默病神经病变的可溶且有毒性的β-淀粉样蛋白(Aβ)聚集体。因此,lec
仑卡奈单抗(Lecanemab)是一种用于治疗阿尔茨海默病的人源化单克隆抗体,可以选择性中和并清除导致阿尔茨海默病神经病变的可溶且有毒性的β-淀粉样蛋白(Aβ)聚集体。因此,lecanemab可能对AD病理过程产生积极影响并减缓疾病发展进程。目前,lecanemab是唯一一款可用于治疗早期AD且无需剂量滴定的抗Aβ抗体。
Lecanemab 与合作伙伴之前的药物 Aduhelm 一样,是一种静脉注射抗体,旨在去除淀粉样蛋白沉积物。 与 Aduhelm 不同,lecanemab 靶向尚未聚集在一起的淀粉样蛋白形式。Lecanemab靶向的是Aβ的聚集形式,包括寡聚体、protofibril、fibril和淀粉样聚集体等。
Clarity AD 是一项为期 18 个月、多中心、双盲、安慰剂对照的平行组试验,涉及早期阿尔茨海默病患者。 符合条件的参与者以 1:1 的比例随机分配接受静脉注射 lecanemab(每 2 周 10 mg/kg)或安慰剂。 随机分组根据临床亚组(阿尔茨海默氏病引起的轻度认知障碍或根据下述标准的轻度阿尔茨海默氏病相关痴呆)、基线时是否存在经批准用于治疗阿尔茨海默氏病症状的伴随药物(例如, 乙酰胆碱酯酶抑制剂、美金刚胺或两者)、载脂蛋白 E (ApoE) ε4 携带者或非携带者,以及地理区域。 在试验期间,参与者接受了血浆生物标志物的连续血液检测,并可以参加三个可选的子研究,这些子研究评估了通过正电子发射断层扫描 (PET) 测量的脑淀粉样蛋白负荷的纵向变化、通过 PET 测量的脑 tau 病理特征和脑脊液 (CSF) 阿尔茨海默病的生物标志物。
该试验包括年龄在 50 至 90 岁之间的参与者,根据国家老龄化研究所 - 阿尔茨海默氏症协会的标准,患者有阿尔茨海默病引起的轻度认知障碍,或有轻度阿尔茨海默病相关痴呆症。淀粉样蛋白阳性通过 PET 或 Aβ1–42 的脑脊液测量。 根据韦氏记忆量表 IV-逻辑记忆 II 中年龄调整平均值至少低于 1 个标准差,所有参与者的情景记忆都存在客观损伤。
主要疗效终点是18个月时,临床痴呆评定量表(CDR)各项评分之和(CDR-SB)相对于基线的变化。CDR-SB评分是阿尔茨海默病临床试验中应用的一项经过验证的结局指标,通过访问患者及其看护人的方式获得,可反映认知和功能。它评估患者和看护人认为重要的六个维度(记忆、定向、判断和解决问题、社区事物、家庭和爱好以及生活自理)。各维度的评分范围是0~3,评分较高表示障碍较严重。总分范围是0~18,0.5~6分表示早期阿尔茨海默病。
关键次要终点是18个月时以下各项相对于基线的变化:一项子研究中以centiloids为单位(使用florbetaben、florbetapir或flutemetamol示踪剂)的PET淀粉样蛋白负荷,阿尔茨海默病评估量表14项认知子量表(ADAS-cog14;范围,0~90;评分较高表示障碍较严重)评分、阿尔茨海默病综合评分(ADCOMS;范围,0~1.97;评分较高表示障碍较严重),以及阿尔茨海默病合作研究-轻度认知障碍日常生活活动量表(ADCS-MCI-ADL;范围,0~53;评分较低表示障碍较严重)评分。生物标志物评估包括CSF生物标志物(Aβ1-40、Aβ1-42、总tau蛋白、磷酸化tau 181[p-tau181]、神经颗粒蛋白和神经丝轻链[NfL])和血浆生物标志物(Aβ42/40比值、p-tau181、胶质细胞原纤维酸性蛋白[GFAP]和NfL)。tau蛋白PET和容积磁共振成像(MRI)结果尚未完成分析。

一项未进行多重性校正的预设探索性分析评估了至CDR总分(global CDR score,范围,0~3,评分较高表示障碍较严重)恶化的时间。此项终点的定义是在连续两次访视中至CDR总分首次增加至少0.5分的时间。
结果共有 5967 人接受了筛查,1795 人接受了随机分组; 从 2019 年 3 月到 2021 年 3 月,在北美、欧洲和亚洲的 235 个地点,898 人被分配接受 lecanemab 治疗,897 人被分配接受安慰剂治疗。在这些参与者中,lecanemab 组 729 人 (81.2%) 和 lecanemab 组 757 人 (84.4%) 安慰剂组完成了试验并获得了有关主要终点的数据(图 1)。
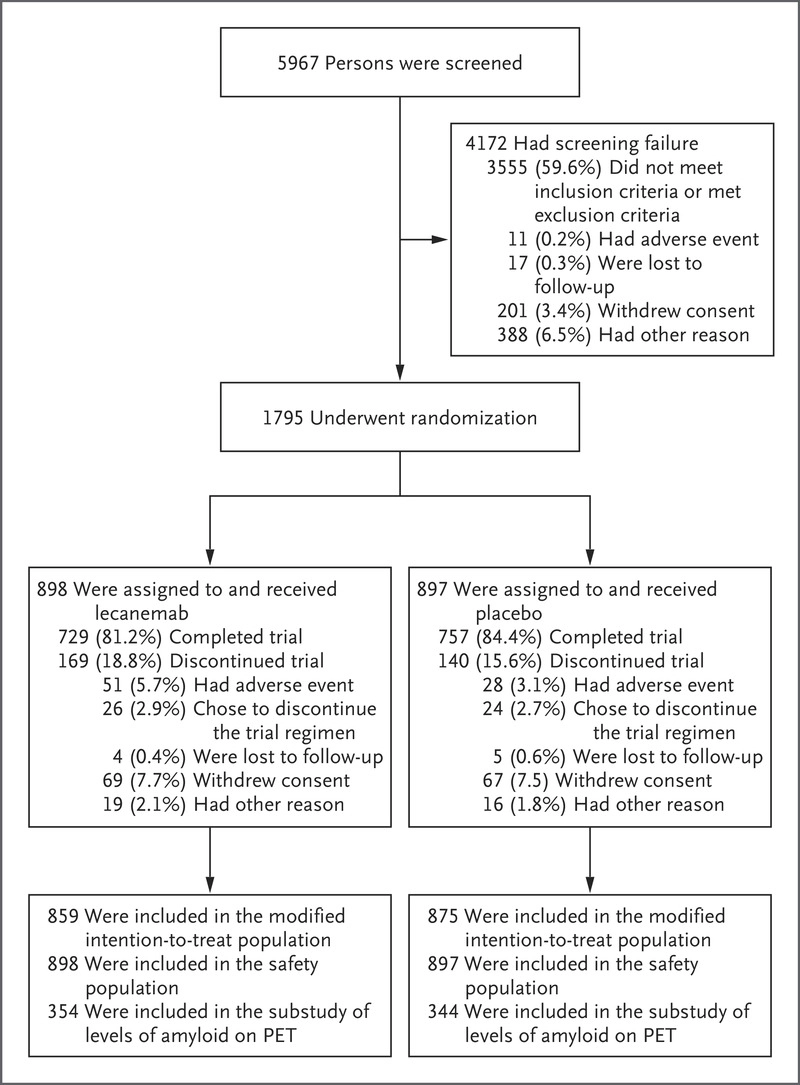
改良意向治疗人群包括 1734 名参与者(lecanemab 组 859 名和安慰剂组 875 名),安全人群包括所有 1795 名随机分配的参与者。 三项纵向子研究的入组对象包括 698 名参与者参与 PET 淀粉样蛋白负荷子研究,257 名参与者参与 PET 上 tau 病理特征研究,281 名参与者参与阿尔茨海默病 CSF 生物标志物子研究。 子研究组的基线特征与主要分析中的基线特征大体相似。 该试验努力提高全球范围内不同参与者群体(20% 为非白人)的入组率,其中包括在美国,在 3638 名经过筛选的参与者中,分别有 6.1% 和 28.1% 以及随机分配的参与者中有 4.5% 和 22.5% 是 分别是黑人和西班牙裔。 两个试验组的参与者基线特征基本相似。
lecanemab 组和安慰剂组的基线平均 CDR-SB 评分均约为 3.2,这一发现与早期阿尔茨海默病(评分为 0.5 至 6)一致。 18 个月时 CDR-SB 评分相对于基线的调整平均变化在 lecanemab 组为 1.21,在安慰剂组为 1.66(差异,-0.45;95% 置信区间 [CI],-0.67 至 -0.23;P<0.001 )(图 2A 和表 2)。
在涉及 698 名参与者的 PET 淀粉样蛋白负荷子研究(一个关键的次要终点)中,lecanemab 组的基线平均淀粉样蛋白水平为 77.92 厘点,安慰剂组为 75.03 厘点。 18 个月时相对于基线的调整后平均变化在 lecanemab 组为 -55.48 厘点,在安慰剂组为 3.64 厘点(差异,-59.12 厘点;95% CI,-62.64 至 -55.60;P<0.001)(图 2B 和表 2). 在改良的意向治疗人群中,lecanemab 组和安慰剂组的基线平均 ADAS-cog14 评分分别为 24.45 和 24.37。 18 个月时 ADAS-cog14 评分相对于基线的调整平均变化在 lecanemab 组为 4.14,在安慰剂组为 5.58(差异,-1.44;95% CI,-2.27 至 -0.61;P<0.001)(图 2C) 和表 2)。 基线时改良意向治疗人群的平均 ADCOMS 在 lecanemab 组中为 0.398,在安慰剂组中为 0.400。 ADCOMS 在 18 个月时相对于基线的调整平均变化在 lecanemab 组中为 0.164,在安慰剂组中为 0.214(差异,-0.050;95% CI,-0.074 至 -0.027;P<0.001)(图 2D 和表 2) ). 在改良的意向性治疗人群中,lecanemab 的基线平均 ADCS-MCI-ADL 评分为 41.2,安慰剂为 40.9。 18 个月时 ADCS-MCI-ADL 评分相对于基线的调整平均变化在 lecanemab 组为 -3.5,在安慰剂组为 -5.5(差异,2.0;95% CI,1.2 至 2.8;P<0.001)(图 2E 和表 2)。

图2. 主要和关键次要终点
除图B之外,各图均显示改良意向性治疗人群的结果。图A显示主要终点结果,即临床痴呆评定量表各项评分之和(CDR-SB)。6个维度的评分范围均为0~3,评分较高表示障碍较严重。总分范围是0~18,0.5~6分表示早期阿尔茨海默病。相对于基线的校正后平均变化、标准误(用I条表示)和P值是通过重复测量的混合模型得出,其中试验组、访视、试验组-访视交互项、临床亚组、基线时阿尔茨海默病症状治疗药物用药情况、ApoE ε4携带状态、地理区域和基线值-访视交互项为固定效应,基线值为协变量。图B至E显示关键次要终点的结果;数值计算方法与主要终点相同。图B显示子研究中以centiloids为单位(使用florbetaben、florbetapir或flutemetamol示踪剂)的PET淀粉样蛋白负荷相对于基线的变化结果。图C显示阿尔茨海默病评估量表14项认知子量表(ADAS-cog14;范围,0~90;评分较高表示障碍较严重)评分相对于基线的变化结果。图D显示阿尔茨海默病综合评分(ADCOMS;范围,0~1.97,评分较高表示障碍较严重)相对于基线的变化结果。图E显示阿尔茨海默病合作研究-轻度认知障碍日常生活活动量表(ADCS-MCI-ADL;范围,0~53;评分较低表示障碍较严重)评分相对于基线的变化结果。
lecanemab 组和安慰剂组分别有 0.7% 和 0.8% 的参与者死亡(表 3)。 研究人员认为没有死亡与 lecanemab 相关或与 ARIA 相关。 lecanemab 组 14.0% 的参与者和安慰剂组 11.3% 的参与者发生了严重不良事件。 最常报告的严重不良事件是输液相关反应(1.2% 的 lecanemab 组参与者和 0 名安慰剂组参与者)、ARIA-E(分别为 0.8% 和 0)、心房颤动(0.7 % 和 0.3%)、晕厥(0.7% 和 0.1%)和心绞痛(0.7% 和 0)。 两组的不良事件总体发生率相似(表 3)。
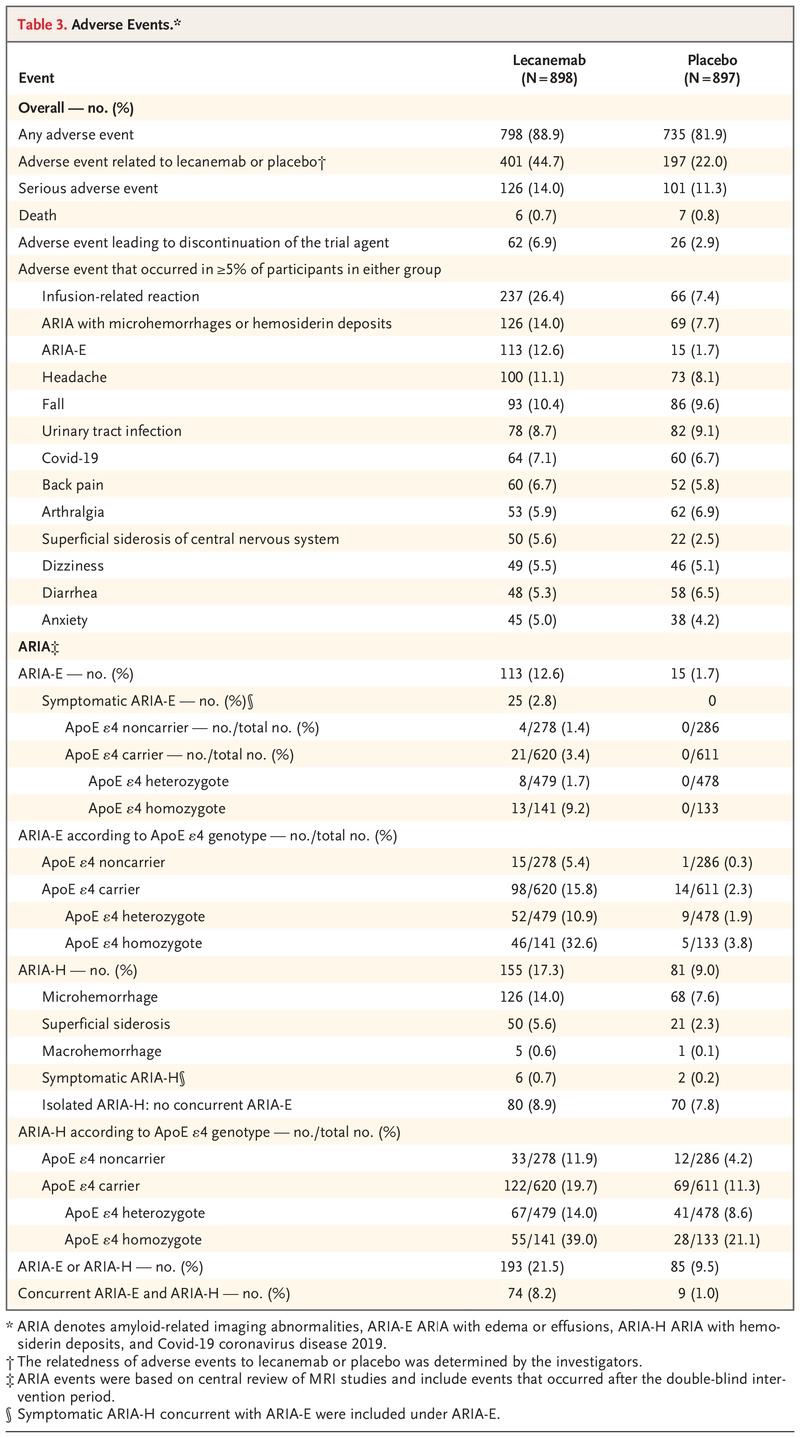
这项研究表明,在早期阿尔茨海默病患者中,18 个月时,lecanemab 降低了脑淀粉样蛋白水平,与认知和功能临床测量指标的下降程度比安慰剂适度下降有关,但与不良事件有关。 需要更长时间的试验来确定 lecanemab 在早期阿尔茨海默病中的疗效和安全性。
原始出处:
Lecanemab in Early Alzheimer’s Disease. N Engl J Med 2023; 388:9-21
DOI: 10.1056/NEJMoa2212948
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#仑卡奈单抗#(#Lecanemab#)治疗早期#阿尔茨海默病#(Clarity AD研究),这个能入选2023年度#十大#进展,也是2023年度开年最大突破。目前最大挑战是,有3例患者因为Lecanemab治疗出现死亡,FDA这几天在审批这个药物,这是最大的挑战。
90