数据核查是保证临床研究数据质量的关键一环。由上海市药学会药物临床研究专业委员会主办,上海信华医药与上海市精神心理疾病临床医学研究中心承办的eCOA论坛上,来自上海市精神卫生中心的沈一峰主任,以VAS为例与大家共同分享数据核查发现和分析,并提出可能的解决方案。
沈一峰教授说到:“数据的可靠性(完整性)是GCP的基石。如果原始数据存在缺陷,基于此的研究结果和结论都不可信。”作为一名检查员,沈主任参与核查时,发现过很多问题。考虑到VAS使用普遍且相对简单,故以此为例展开讨论。
何为数据可靠性?数据核查的关注点有哪些?
数据是需要有上下文的,通常指数据要有结构、字段、内在关系及其他特征。单纯一个数字,没有这些信息,不是数据。数据需要符合ALCOA及ALCOA+原则。

以核查角度来审视临床试验中的数据,主要遵循的就是上述原则。如果符合这些原则,数据的可靠性就能获得认可。如果存在缺陷,就需要判断是真实性问题还是规范性问题。如果是真实性问题,可能引起对研究结果的质疑;如果是规范性问题,需要评估缺陷的种类、频次、占比,以及对主要研究结论的影响,最严重的后果,就是审评不予通过。
以VAS为例,说明数据核查遇到的问题?
VAS(Visual Analog Scale)即视觉模拟量表,在临床试验中(特别是疼痛相关领域)很常见。常见的核查发现如下:
1、执行归属到人:划线、测量和记录评分,3个行为,不清楚谁干的
2、事件清晰可溯:只看到评分。访谈发现,研究人员没有明白评分规则
3、记录同步实时:划线有的在评分前,有的在评分后,研究人员培训不足
4、数据原始一致:划线和评分不一致,评分跟录入CRF的不一致
5、信息准确可靠:无测量工具,靠“估算”;甚至线段的长度错误
6、完整:有缺漏,后补等
7、一致:测量错误,转录错误
8、持久:修改随意,不同的执行标准
9、可用:双交叉划线,无法取舍和选用
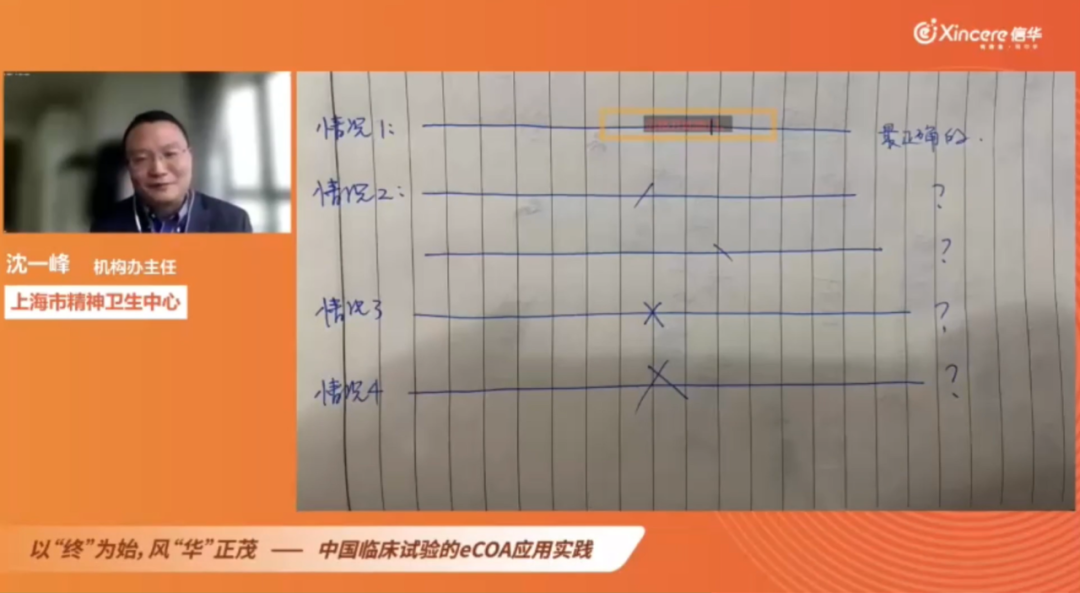
VAS评分中容易犯的错误示意图
以上提到的这些问题,我们有什么办法可以防止他的发生?或者按照质量规范要求,如何能让他第一次就做对。
质量改进的策略
策略一:规范培训
-
针对研究者的培训,让其知晓规范操作并能在必要时给予受试者答疑及指导,如果在受试者第一次给予正确指导,能够规避后续很多问题出现
-
需要让CRC知晓规范测量,证据准确录入
策略二:指导语清晰明了
-
让受试者第一次就做对
-
进行示范,依葫芦画瓢(以VAS为例,受试者只需要完成划线的动作即可。)
策略三:量表电子化
-
在电子化评价工具上保证100mm线是相对容易实现的
-
有语音指导及示范自动显示
-
受试者完成划线/拖拽移动条
-
自动测量、数据进入数据“库”、时间记录
-
数据结果显示给研究者
小结
最后,沈主任小结:“数据可靠性本质上是一种实践。GCP要求我们,根据具体项目的要求,寻找最适合的工具。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#数据核查#
46