氢气治疗自闭症的疗效分析
2022-11-01 梅斯医学 梅斯医学
氢气具有许多生物学特性,其抗炎症、抗氧化和抗凋亡机制的特性,使其成为多种疾病的有力的候选治疗方案。未来,研究重点应放在氢气的剂量、给药方式、药代动力学、生物学等方面,以促进临床应用。
摘要
根据中国残疾人联合会保守估计,我国0至20岁以上的自闭症患者约有500万。自闭症的病因目前还不清楚,其病理生理学机制亦十分复杂。目前,学者们的广泛认为,氧化应激在孤独症的病理生理机制上有重要作用。
研究发现,自闭症的一些症状是由氧化应激导致的【1】。例如:自闭症患者的尿液中,氧化应激标志物水平高于对照组,其水平与自闭症的严重程度正相关【2】;自闭症患者的脂质过氧化水平增加[1-7],自闭症儿童对氧化应激的易感性高于对照组【3】,一些自闭症儿童的还原型谷胱甘肽总水平降低,而活性氧和氧化型谷胱甘肽水平升高,谷胱甘肽S移换酶(glutathione S-transferase,GST)和过氧化氢酶的活性水平降低【4】。(谷胱甘肽S移换酶是一组与肝脏解毒功能有关的酶,过氧化氢酶存在于红细胞及某些组织内的过氧化体中,它的主要作用就是催化H₂O₂分解为H₂O与O₂,使得H₂O₂不与O₂在铁螯合物作用下反应生成有害的-OH)
氢气在预防氧化应激【5】方面两个优点。首先,它能减少羟基自由基;其次,氢不与其他活性氧物质发生反应。据报道,氢对某些疾病具有治疗效果,例如肝损伤【6】,预防动脉粥样硬化【7】等,同时,有人提出氢可以减轻自闭症的一些症状【8】。
第一章:自闭症和氧化应激的关系
美国学者Colin A. Heberling等人【9】提出了一个氧化应激和自闭症的关系模型。首先,氧化应激引起硫代谢异常;其次,引起肠道细菌异常或细菌过度生长;最后,由此引起肠道通透性增加,使有毒物质透过肠道进入血液系统,再突破血脑屏障影响大脑发育。整个过程如下图所示。
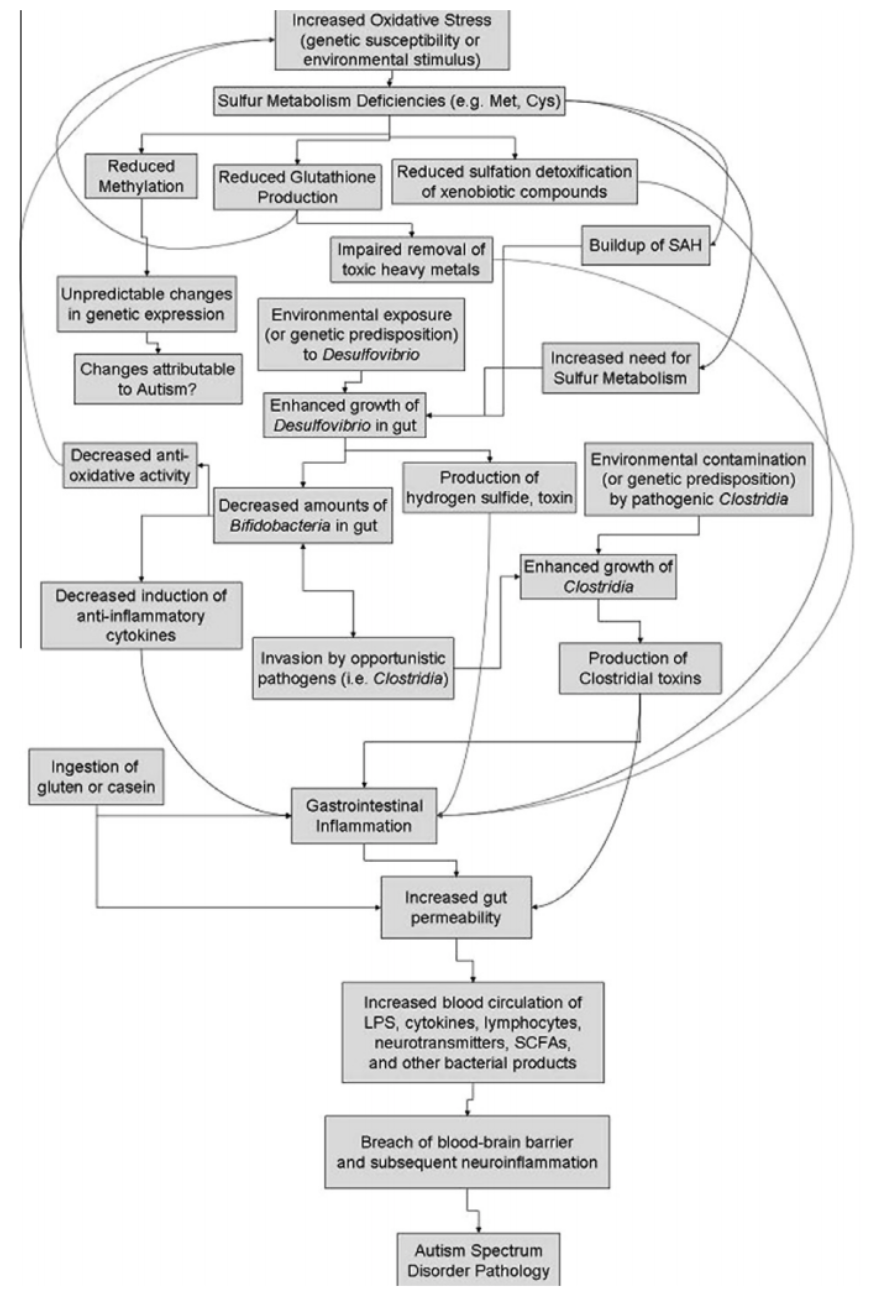
为了揭示自闭症可能的发病机制,在通过血清、尿液检验,寻找可靠的ASD生物标志物的研究中,有证据表明ASD患者在转甲基化和转硫代谢途径方面存在缺陷,这与含硫氨基酸(蛋氨酸、半胱氨酸)的代谢有关【10、11】。
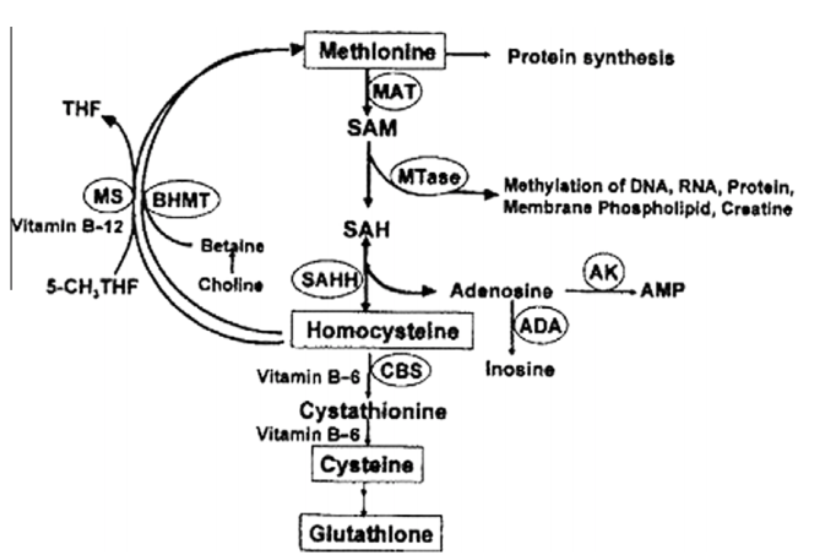
甲基化和转硫途径
与对照组相比,ASD患者代谢物腺苷和 SAH(S-腺苷高半胱氨酸)含量升高,蛋氨酸、SAM(Sadenosyl 蛋氨酸)、高半胱氨酸、胱硫醚和半胱氨酸含量减少。分析结果表明ASD患者的SAH和腺苷存在代谢瓶颈,氧化应激被认为是主要原因。
这种代谢缺陷会造成一系列危害。半胱氨酸是产生谷胱甘肽生产的物质之一,谷胱甘肽是人体的天然抗氧化剂,也是体内有毒重金属代谢的主要参与者。ASD患者中谷胱甘肽的含量减少,表明存在氧化应激。所以,ASD患者更容易受到有毒重金属的影响。试验也发现,ASD患者尿液样本中的汞含量明显低于对照组,证明了毒重金属代谢功能受损【12】。
ASD患者对外来有毒物质,尤其是酚类化合物的解毒能力也存在缺陷。例如退烧、止痛药扑尔敏(主要成分是对乙酰氨基酚),其代谢需要将硫酸盐转移到外源性化合物上。硫酸盐的合成需要半胱氨酸,而ASD患者体内半胱氨酸水平低于正常人。因此,氧化应激也是导致这种损害的原因。
综上,ASD患者更容易受氧化应激影响、造成有毒重金属、酚类化合物的代谢功能受损。
在另一项研究中,双歧杆菌和乳酸杆菌菌株被证明具有抗氧化作用,双歧杆菌的作用比乳酸杆菌的作用更大【13】。双歧杆菌数量减少,会导致对氧化应激的敏感性增加,从而使硫代谢不足,并增强脱硫弧菌的生长(因此甚至更多地抑制双歧杆菌的生长),这种变化也会引起有害菌种入侵。
第二章:氢气对神经系统性疾病治疗作用
各种研究都强调了氢气通过降低氧化应激(OS)水平发挥其积极作用【14】。有许多方便有效的氢气给药途径,例如吸入氢气、口服富氢水 (HRW)、注射富氢生理盐水(HS) 、直接作用于患处(如淋浴、滴眼液等)【15】。

氢气对不同急性神经元疾病的有益作用
在安全性方面。吸入氢气不会影响血压、身体酸碱度、体温等生理指标,几乎没有副作用,因为它只与会•OH等自由基发生作用。
1、氢气对人类神经退行性疾病模型的影响
氢气可清除ROS自由基,在减轻许多组织和器官(包括心脏、大脑和肺)的炎症方面极为有效【16】。富氢水因其抑制炎症反应、减轻神经元凋亡的功能,被广泛研究【17】。
帕金森病(PD)是由大脑中多巴胺能神经元(dopaminergic neuron)细胞大量死亡导致的,也是继阿尔茨海默病(AD)之后,排名第二的神经退行性疾病。它由两种机制导致,一是过度的氧化应激(OS),二是泛素-蛋白酶体系统的异常。泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解【18】。多巴胺本身是一种促氧化剂,当多巴胺能细胞暴露于高水平的ROS中,在神经元细胞中,异常的泛素-蛋白酶体系统经会诱导不溶性α-突触核蛋白的积累,最终导致神经元细胞死亡,而氢气可以逆转这种影响。

氢气对各种疾病作用的试验
阿尔茨海默病(AD)是最常见的神经退行性疾病,其特征是不规则的β-淀粉样蛋白 (Aβ)和tau聚集【19】。各种研究已经证明了,氢气在不同的阿尔茨海默病(AD)模型中的积极作用。例如,富氢水可以预防认知障碍、降低氧化应激(OS)水平【20】,同时观察到氢水能缓解束缚应激后海马齿状回神经增殖抑制;在脑室内注射Aβ(1-42) 老年性痴呆动物模型中,通过含氢生理盐水治疗,发现学习和记忆障碍减轻、Aβ减少、神经炎症减轻,同时观察到氢水能抑制脂质过氧化和炎症介质,如IL-6和TNF-α【21】。氢气这种保护作用,是由于激活了c-Jun n末端激酶(JNK)和核因子κB (NF-κB)通路【22】。一项对痴呆症小鼠模型的研究发现,氢水降低了氧化应激(OS)水平,防止了记忆、认知能力的下降,同时增加了小鼠的寿命。
2、氢气对自闭症、脑瘫、智力迟缓的治疗作用
脑部病变是自闭症、脑瘫、智力迟缓和其他各种障碍发展的关键因素【23】。围产期窒息是造成新生儿脑损伤的主要原因之一,吸入氢气可减少新生儿缺氧引起的神经元凋亡【24】。
氢气还可以刺激能量代谢以减少神经元损伤。例如,它可以上调FGF21的表达【25】。一项研究表明,利用七氟醚,导致小鼠出现类似于自闭症的异常社会行为【26】,而氢气体处理,消除了小鼠中由七氟醚引起的氧化应激的增加,从而改善了自闭症相关症状。
3、氢气对其他神经系统疾病的治疗作用
大量研究表明,中枢神经系统疾病的发生率很高,例如视网膜缺血【27】。使用含氢滴眼液,可抑制OH的增加,减少氧化应激(OS)导致的细胞凋亡对视网膜造成的损害,保护缪勒氏细胞(在维持视网膜的结构和功能中起着重要作用)、星形胶质细胞、小胶质细胞等免受氧化应激(OS)带来的影响。
在发展中国家,脑外伤、脊髓损伤,每年会导致大量数患者死亡和残疾。氢气可以保护脑外伤引起的神经元细胞死亡,这是因为吸入氢气可防止氧化应激(OS)产物的生成,并提高内源性抗氧化剂(SOD 和 CAT)在脑组织中的酶活性,起到保护作用【28】。另外,氢气治疗也能预防脑部脓毒症和LPS炎症【29】。
第三章 氢气用于自闭症治疗的动物实验
自闭症谱系障碍 (ASD) 是一种神经发育障碍,伴有持续的社交(SIs)障碍、沟通障碍、重复刻板行为、更高的焦虑水平等【30、31】。越来越多的研究表明:自闭症的发生和脑部炎症致有关,自闭症患者表现出神经炎症、炎症反应失调和免疫异常的特征,这些特征不仅能在围产期观察到,而且各年龄段自闭症患者中,都能观察到【32】。解剖学证据也表明:自闭症谱系障碍患者,大脑的某些区域存在神经炎症,进一步的分析表明存在强烈的免疫反应.
动物实验表明,母体免疫激活可以显著改变后代的行为,出现社交障碍和其他类似自闭症的行为【33】。同时,实验还发现免疫失调,这证实了将围产期感染与自闭症联系起来的临床证据。由此,通过抗炎治疗和抗氧治疗,可以显示改善自闭症患者的症状【34】。
氢分子抗氧化、抗凋亡和抗炎作用【35】。氢气可以通过吸入、注射富氢盐水 (HRS) 或口服富氢水 (HRW)进入人体,氢分子很容易透过血脑屏障、到达大脑等药物难以到达的器官。基于自闭症免疫系统的失调和氢的抗炎特性,来自中国河北医科大学的研究团队,研究旨在使用母体丙戊酸(VPA)暴露的小鼠模型,研究氢气对自闭症样行为的潜在影响。
实验选用30只雌性和15只雄性小鼠(体重20-25 g),置于温度(22℃)、湿度(60%)一致,12小时光/暗循环,小鼠可以随意获取食物和水。12.5天后,将30只怀孕的雌性小鼠分成5组,第1组小鼠仅注射生理盐水(标为NAV组),第2至第5组,先通过丙戊酸(VPA)诱导出现自闭症症状。之后,第二组提供不含氢的普通水(标为VEH组),另外三组在不同阶段提供富氢水。其中,产后第1天~21天为一组(标为PHV 组),产后13~21天为一组(标为PVS 组),产后13~42天分为一组(标为PVL)。然后,在产35~42天进行测试。
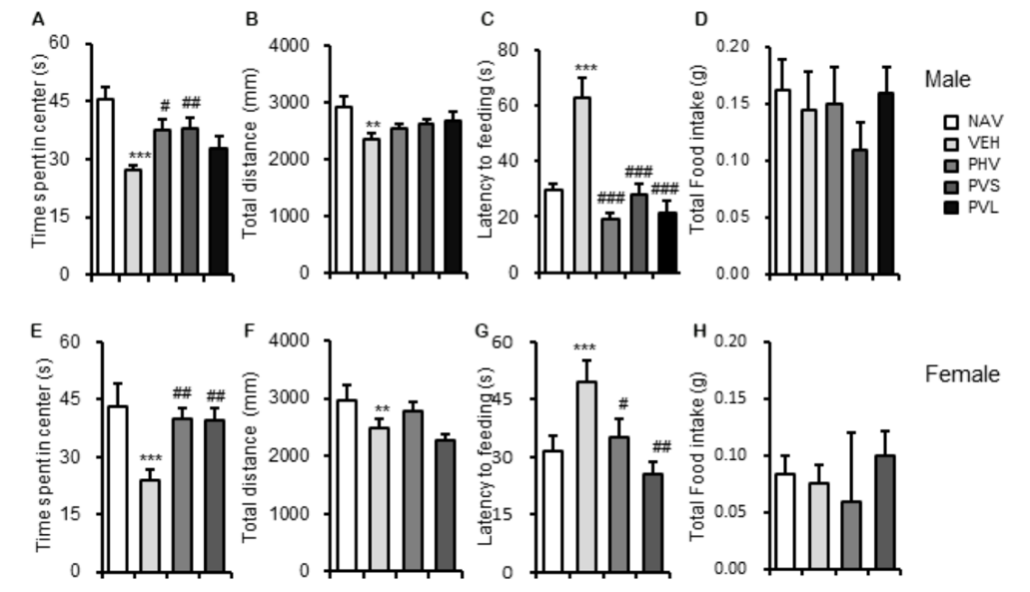
测试结果如上图所示:雌性小鼠(母体)经过通过丙戊酸(VPA)诱导
1、OFT测试中,出现了明显的焦虑症状(图A、图E);
2、NSF测试中,出现了食欲减退的症状(图C、图G);
后代小鼠经过通过富氢水酸(HRW)干预后,
1、OFT测试中,没有出现明显的焦虑症状(图B、图F);
2、NSF测试中,食欲未见明显改变(图D,图H)。
综上,研究团队认为:母体经过富氢水干预后,减少了后代小鼠因自闭症引发的焦虑症状。
进一步的分析表明:
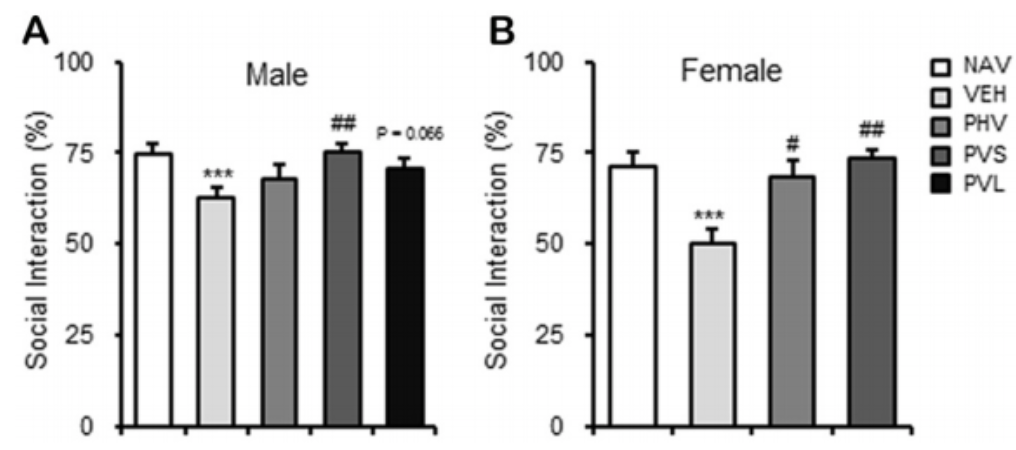
1、富氢水干预,逆转了后代小鼠的过度敏感症状
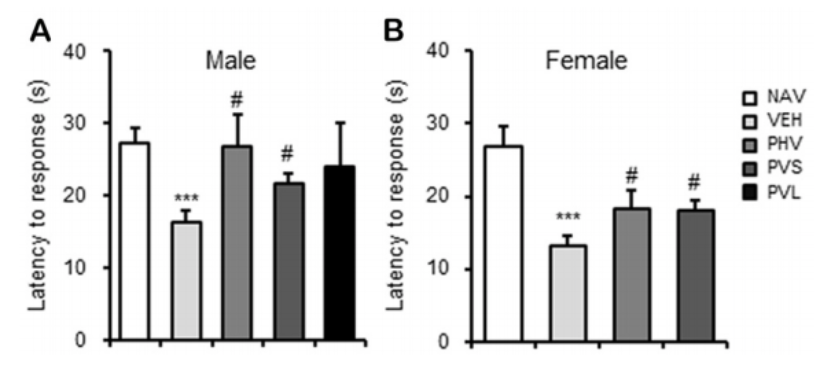
如上图所示,这种逆转在雌性和雄性小鼠身上,都得到了体现。
2、富氢水干预,改善了后代小鼠的社交障碍,且在雌性和雄性小鼠身上,都得到了体现。
3、富氢水干预,阻断了后代小鼠的炎症反应

如上图所示,富氢水干预后,逆转了白细胞介素-6(IL-6)(图A、图D)和肿瘤坏死因子-α(TNF-α)(图B、图E)的血清水平升高;同时,对脑源性神经营养因子 (BDNF)(图C、图F)没有产生任何的不利影响。
综上,研究团队认为考虑到氢气临床试验中,没有毒性作用报告,安全性高、使用简单,氢气干预应作为未来预防和治疗ASD的潜在新方法进一步研究。
第四章 氢气治疗自闭症的临床试验
正常情况下,人体内的氧化-抗氧化系统之间存在平衡。当这种平衡被破坏,氧化损伤就会出现,导致炎症反应、蛋白质羰基化、DNA 损伤和脂质过氧化【36、37】。
关于氧化应激在精神类疾病中存在的证据越来越多,例如自闭症、双向情感障碍等等【38、39】。活性氧 (ROS) 的产生和代谢,在病理生理学中起重要作用【40】。研究发现,患者体内抗氧化系统核心,谷胱甘肽和还原型谷胱甘肽水平、抗氧化酶活性均低于健康人。
氢气是一种无色无味的气体,具有快速扩散、并通过脂质膜进入细胞的能力,因此很容易渗透到细胞中的线粒体和细胞核等细胞器。它还很容易穿过血脑屏障,这有助于进入目标器官,并直接作用于患处。另外,也未见不良反应的相关报道【41】。氢气通过与羟基自由基反应,保护大脑免受继发性氧化损伤【42】。
另外,在自闭症患者中,发现线粒体功能受损【43】。氢气能够保护线粒体和细胞核DNA免受羟基自由基的伤害,防止抗霉素治疗后线粒体膜电位下降【44】。一项随机对照试验表明,富氢水可减少线粒体肌病患者的线粒体功能障碍和炎症反应【45】。这些都为氢气用于自闭症的康复治疗,提供了理论支持。
根据中国残疾人联合会保守估计,我国0至20岁以上的自闭症患者约有500万。自闭症的病因目前还不清楚,其病理生理学机制亦十分复杂。
相对于其他神经变性疾病,自闭症患者的大脑要发育得较差,由此导致了氧化应激损害的风险。因为他们大脑的不成熟的抗氧化系统,不足以保护由增多的活性氧引起的损害。
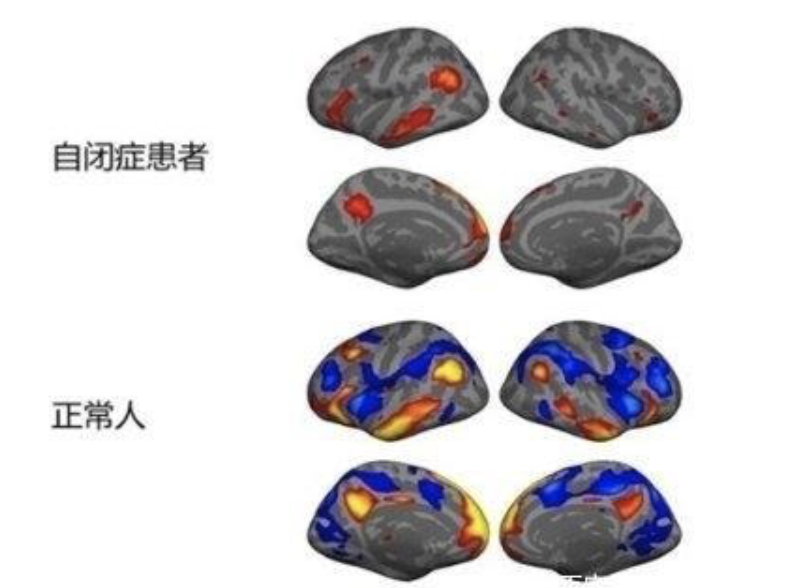
自闭症患者存在脑组织发育障碍,神经细胞产生过量活性氧(ROS)自由基,超出了其过氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(GSH-Px)的清除能力,最终造成组织炎症。
由于大脑的脂肪酸浓度高,氧需求高,抗氧化物浓度低和氧化还原活性铁的有效性高,因此脑和血脑屏障对氧化损害更敏感。临床和实验室检查,也发现自闭症患者存在血脑屏障的缺损。研究发现,氧化应激导致血脑屏障的脑网状结构受损,在孤独症中,常报道睡眠障碍、易惊醒等,这是网状结构功能失调的表现。
由于血脑屏障存在,药物不易从血液中进入脑实质中,这也是药物对自闭症效果有限的原因。2021年,深圳大学的何前军教授和南方医科大学喻志强教授,合作研究发现:氢气可以很容易地穿过血脑屏障,迅速地进入脑组织。
目前,国内多家医疗机构,已经开始了将氢气用于自闭症儿童康复的临床试验。如魏佑震教授团队(上海市东方医院),济南市第二妇幼保健院儿保科孤独症训练中心等【46】。

2022年10月,由山东省启元慢病康复研究所立项的《自闭症儿童综合利用“氢+”调理真实世界数据研究》,得到了山东大学附属齐鲁医院,山东省第一医科大学第一附属医院(山东省千佛山医学),山东省立第三院等单位的支持,专业的临床医生来进行项目观察和分析【47】。

未来,氢气干预有望成为自闭症康复治疗的一种新手段。
结论
氢气具有许多生物学特性,其抗炎症、抗氧化和抗凋亡机制的特性,使其成为多种疾病的有力的候选治疗方案。未来,研究重点应放在氢气的剂量、给药方式、药代动力学、生物学等方面,以促进临床应用。
参考文献
【1】Ghanizadeh A: Oxidative stress may mediate association of stereotypy and immunity in autism, a novel explanation with clinical and research implications. J Neuroimmunol 2011, 232(1–2):194–195.
【2】Damodaran LP, Arumugam G: Urinary oxidative stress markers in children with autism. Redox Rep 2011, 16(5):216–222.
【3】Meguid NA, Dardir AA, Abdel-Raouf ER, Hashish A: Evaluation of oxidative stress in autism: defective antioxidant enzymes and increased lipid peroxidation. Biol Trace Elem Res 2011, 143(1):58–65.
【4】Ghanizadeh A, Akhondzadeh S, Hormozi, Makarem A, Abotorabi M, Firoozabadi A: Glutathione-related Factors and Oxidative Stress in Autism, a Review. Curr Med Chem 2012
【5】Sun Y, Shuang F: Chen DM. Zhou RB: Treatment of hydrogen molecule abates oxidative stress and alleviates bone loss induced by modeled microgravity in rats. Osteoporos Int; 2012.
【6】Fukuda K, Asoh S, Ishikawa M, Yamamoto Y, Ohsawa I, Ohta S: Inhalation of hydrogen gas suppresses hepatic injury caused by ischemia/reperfusion through reducing
【7】Ohsawa I, Nishimaki K, Yamagata K, Ishikawa M, Ohta S: Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice. Biochem Biophys Res Commun 2008, 377(4):1195–1198.
【8】Ghanizadeh A: Hydrogen as a novel hypothesized emerging treatment for oxidative stress in autism. Eur Rev for Med and Pharmacol Sci, Under Press
【9】Heberling C A, Dhurjati P S, Sasser M. Hypothesis for a systems connectivity model of autism spectrum disorder pathogenesis: Links to gut bacteria, oxidative stress, and intestinal permeability[J]. Medical hypotheses, 2013, 80(3): 264-270.
【10】James SJ, Cutler P, Melnyk S, et al. Metabolic biomarkers of increased oxidative stress and impaired methylation capacity in children with autism. Am J Clin Nutr 2004;80:1611–7.
【11】Geier DA, Kern JK, Garver CR, Adams JB, Audhya T, Geier MR. A prospective study of transsulfuration biomarkers in autistic disorders. Neurochem Res 2009;34:386–93.
【12】Wang L, Angley MT, Gerber JP, Sorich MJ. A review of candidate urinary biomarkers for autism spectrum disorders. Biomarkers 2011;16(7):537–52.
【13】Lin MY, Chang FJ. Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356. Dig Dis Sci 2000;45(8):1617–22.
【14】Ambani, L.M.; Van Woert, M.H.; Murphy, S. Brain peroxidase and catalase in Parkinson Disease. Arch. Neurol. 1975, 32, 114–118.
【15】Niedzielska, E.; Smaga, I.; Gawlik, M.; Moniczewski, A.; Stankowicz, P.; Pera, J.; Filip, M. Oxidative stress in neurodegenerative diseases. Mol. Neurobiol. 2016, 53, 4094–4125.
【16】Noda, M.; Fujita, K.; Hamner, M.A.; Yamafuji, M.; Akimoto, N.; Kido, M.A.; Tanaka, Y.; Nakabeppu, Y.; Ransom, B.R. Molecular hydrogen protects against central nervous system white matter ischemic injury. In Proceedings of the SfN 42nd Annual Meeting, New Orleans, LA, USA, 13–17 October 2012; Volume 660, p. 14.
【17】Fujita, K.; Nakabeppu, Y.; Noda, M. Therapeutic effects of hydrogen in animal models of Parkinson’s disease. Parkinson Dis. 2011, 2011, 307875.
【18】Ito, M.; Hirayama, M.; Yamai, K.; Goto, S.; Ichihara, M.; Ohno, K.; Ito, M. Drinking hydrogen water and intermittent hydrogen gas exposure, but not lactulose or continuous hydrogen gas exposure, prevent 6-hydorxydopamine-induced Parkinson’s disease in rats. Med. Gas. Res. 2012, 2, 1–7.
【19】Nagatani, K.; Nawashiro, H.; Takeuchi, S.; Tomura, S.; Otani, N.; Osada, H.; Wada, K.; Katoh, H.; Tsuzuki, N.; Mori, K. Safety of intravenous administration of hydrogen-enriched fluid in patients with acute cerebral ischemia: Initial clinical studies. Med. Gas. Res. 2013, 3, 13.
【20】Ono, H.; Nishijima, Y.; Ohta, S.; Sakamoto, M.; Kinone, K.; Horikosi, T.; Tamaki, M.; Takeshita, H.; Futatuki, T.; Ohishi, W.; et al. Hydrogen gas inhalation treatment in acute cerebral infarction: A randomized controlled clinical study on safety and neuroprotection. J. Stroke. Cerebrovasc. Dis. 2017, 26, 2587–2594.
【21】LeBaron, T.W.; Laher, I.; Kura, B.; Slezak, J. Hydrogen gas: From clinical medicine to an emerging ergogenic molecule for sports athletes. Can. J. Physiol. Pharmacol. 2019, 97, 797–807.
【22】Nicolson, G.L.; de Mattos, G.F.; Settineri, R.; Costa, C.; Ellithorpe, R.; Rosenblatt, S.; Ohta, S. Clinical effects of hydrogenadministration: From animal and human diseases to exercise medicine. Int. J. Clin. Med. 2016, 7, 32–76.
【23】Qin, L.; Liu, Y.; Wang, T.; Wei, S.J.; Block, M.L.; Wilson, B.; Liu, B.; Hong, J.S. NADPH oxidase mediates lipopolysaccharideinduced neurotoxicity and proinflammatory gene expression in activated microglia. J. Biol. Chem. 2004, 279, 1415–1421.
【24】Spulber, S.; Edoff, K.; Hong, L.; Morisawa, S.; Shirahata, S.; Ceccatelli, S. Molecular hydrogen reduces LPS-induced neuroinflammation and promotes recovery from sickness behaviour in mice. PLoS ONE 2012, 7, e42078.
【25】Mano, Y.; Kotani, T.; Ito, M.; Nagai, T.; Ichinohashi, Y.; Yamada, K.; Ohno, K.; Kikkawa, F.; Toyokuni, S. Maternal molecular hydrogen administration ameliorates rat fetal hippocampal damage caused by in utero ischemia–reperfusion. Free Radic. Biol. Med. 2014, 69, 324–330.
【26】Yang, L.; Li, D.; Chen, S. Hydrogen water reduces NSE, IL-6, and TNF-α levels in hypoxic-ischemic encephalopathy. Open Med. 2016, 11, 399–406.
【27】Yang, M.; Dong, Y.; He, Q.; Zhu, P.; Zhuang, Q.; Shen, J.; Zhang, X.; Zhao, M. Hydrogen: A Novel Option in Human Disease Treatment. Oxid. Med. Cell Longev. 2020, 2020, 8384742.
【28】Abraini, J.H.; Gardette-Chauffour, M.C.; Martinez, E.; Rostain, J.C.; Lemaire, C. Psychophysiological reactions in humans during an open sea dive to 500 m with a hydrogen-helium-oxygen mixture. J. Appl. Physiol. 1994, 76, 1113–1118.
【29】Fontanari, P.; Badier, M.; Guillot, C.; Tomei, C.; Burnet, H.; Gardette, B.; Jammes, Y. Changes in maximal performance of inspiratory and skeletal muscles during and after the 7.1-MPa Hydra 10 record human dive. Eur. J. Appl. Physiol. 2000, 81, 325–328.
【30】Hollocks, M. J., Jones, C. R., Pickles, A., Baird, G., Happé, F., Charman, T., et al. (2014). The association between social cognition and executive functioning and symptoms of anxiety and depression in adolescents with autism spectrum disorders. Autism Res. 7, 216–228.
【31】Chahrour, M., O’Roak, B. J., Santini, E., Samaco, R. C., Kleiman, R. J., and Manzini, M. C. (2016). Current perspectives in autism spectrum disorder: from genes to therapy. J. Neurosci. 36, 11402–11410.
【32】Prata, J., Santos, S. G., Almeida, M. I., Coelho, R., and Barbosa, M. A. (2017). Bridging autism spectrum disorders and schizophrenia through inflammation and biomarkers—pre-clinical and clinical investigations. J. Neuroinflammation 14:179.
【33】Careaga, M., Murai, T., and Bauman, M. D. (2017). Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biol. Psychiatry 81, 391–401.
【34】Bronson, S. L., and Bale, T. L. (2014). Prenatal stress-induced increases in placental inflammation and offspring hyperactivity are male-specific and ameliorated by maternal antiinflammatory treatment. Endocrinology 155, 2635–2646.
【35】Ohta, S. (2015). [Initiation, development and potential of hydrogen medicine: toward therapeutic and preventive applications of molecular hydrogen against a variety of diseases]. Seikagaku 87, 82–90.
【36】Andreazza AC, et al: Specific subcellular changes in oxidative stress in prefrontal cortex from patients with bipolar disorder. J Neurochem 2013
【37】Soeiro-de-Souza MG, et al: Number of manic episodes is associated with elevated DNA oxidation in bipolar I disorder. Int J Neuropsychopharmacol 2013:1–8
【38】Raffa M, et al: Reduced antioxidant defense systems in schizophrenia and bipolar I disorder. Prog Neuropsychopharmacol Biol Psychiatry 2012, 39(2):371–5.
【39】Ghanizadeh A: Gold nanoparticles and lipoic acid as a novel antiinflammatory treatment for autism, a hypothesis. Journal of Medical Hypotheses and Ideas 2012, 6(1):40–43.
【40】Steckert AV, et al: Role of oxidative stress in the pathophysiology of bipolar disorder. Neurochem Res 2010, 35(9):1295–301.
【41】Dixon BJ, Tang J, Zhang JH: The evolution of molecular hydrogen: a noteworthy potential therapy with clinical significance. Med Gas Res 2013, 3(1):10.
【42】Ohsawa I, et al: Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat Med 2007, 13(6):688–94.
【43】Rezin GT, et al: Mitochondrial dysfunction and psychiatric disorders. Neurochem Res 2009, 34(6):1021–9.
【44】Peters O, et al: Increased formation of reactive oxygen species after permanent and reversible middle cerebral artery occlusion in the rat. J Cereb Blood Flow Metab 1998, 18(2):196–205.
【45】Ito M, et al: Open-label trial and randomized, double-blind, placebocontrolled, crossover trial of hydrogen-enriched water for mitochondrial and inflammatory myopathies. Med Gas Res 2011, 1(1):24.
【46】济南医院:“氢气吸入”,自闭症儿童的新选择.济南医院微信公众号
【47】关于征集参与《自闭症儿童综合利用“氢+”调理真实世界数据研究》机构的通知.山东省启元慢病康复研究所
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









真的管用,还只是实验?自闭症孩子喝富氢水管用吗
41