JAMA Oncol:高TMB,高irAE风险
2019-09-05 biubiugirl 肿瘤资讯
免疫检查点抑制剂在提高抗肿瘤治疗疗效的同时也带来了严重的免疫相关不良事件,令人望而却步,尽管肿瘤突变负荷(TMB)已成为公认的抗PD-1免疫治疗的疗效预测生物标志物,但TMB与发生免疫相关不良事件是否有关联尚不清楚。近期一篇发表在JAMA Oncology杂志上的一篇research letter填补了这一知识的空缺。
抗PD-1的免疫检查点抑制剂(ICI)治疗开创了肿瘤治疗的新时代。然而,严重的免疫相关不良事件(irAE)如结肠炎、肺炎和心肌炎等限制了ICI的应用,而且通常难以预测。研究证实,肿瘤突变负荷(TMB)可用来预测疗效,但TMB与irAEs的相关性研究较少。因此,此研究通过比较多个瘤种中免疫治疗的irAE发生比与中位TMB来探究抗PD-1治疗期间报告的irAE与TMB之间的关联。
研究者检索了来自美国食品药品管理局不良事件报告系统(FAERS)中2014年7月1日—2019年3月31日期间免疫治疗药物上市后的不良事件数据,选择在抗PD-1治疗期间至少发生100例不良事件的瘤种,仅纳入由纳武利尤单抗或帕博利珠单抗单药治疗引起的可疑不良事件,排除由抗PD-1和抗CTLA-4联合治疗引起的不良事件。肿瘤的中位TMB来自先前发表的全基因组分析。研究者b采用FAERS和类似数据库中数据定量分析的标准做法评估患者发生任何irAE的风险,即通过比较纳武利尤单抗和帕博利珠单抗报告的irAE发生比与数据库中所有其他药物的irAE发生比来估计报告比值比(ROR)。
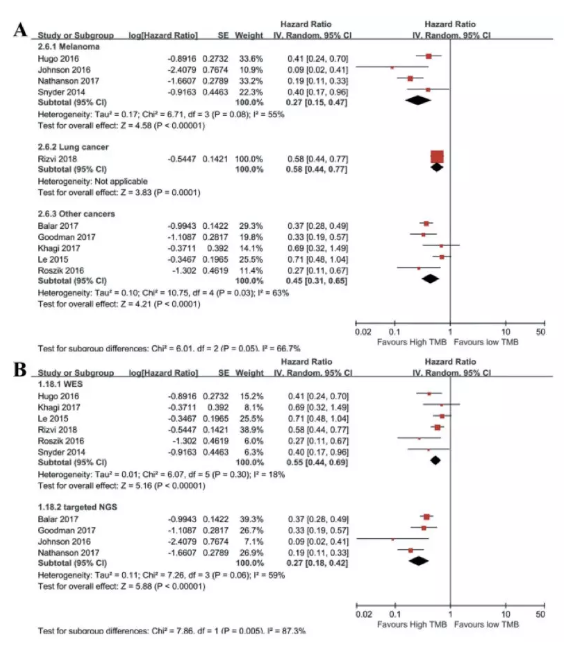
最终,研究者通过检索在19个瘤种中纳入16397名患者,发生不良事件(AE)共计47304例,所有患者均接受抗PD-1单药治疗,并有3661人(22.3%)至少出现1例irAE。比较组包括来自5160064名患者的16411749 例不良事件。通过分析发现,抗PD-1治疗期间irAE的ROR与肿瘤的中位TMB呈正相关,较高的irAE ROR与较高的每兆碱基DNA编码体细胞突变的中位数相关( Pearson相关系数R = 0.704;P <0.001),这一相关系数表明不同肿瘤中发生irAE风险的50%差异可能来自于TMB。
研究者发现在抗PD-1治疗期间,TMB高的肿瘤例如黑色素瘤和非小细胞肺癌有更高的irAE报告比值比(ROR),表明这些TMB高的肿瘤比TMB低的肿瘤具有更高的免疫相关不良事件发生风险。究其原因,可能是因为不同肿瘤的肿瘤抗原负荷不同。此外,研究表明,响应肿瘤抗原的T细胞可以与相应的野生型蛋白质发生交叉反应。另一种可能的机制是抗原扩散,即肿瘤细胞死亡释放抗原包括肿瘤抗原,引发淋巴细胞对抗健康组织中的野生型抗原。因此,基于研究的结果,研究者认为抗PD-1治疗的疗效和irAE都是通过高TMB引起肿瘤抗原相关联的。
所以,高TMB可能是评估患者抗PD-1治疗期间发生irAE风险的有效生物标志物,这一发现对易发生不良反应的患者群体尤为重要。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Oncol#
23
#TMB#
35
谢谢梅斯分享这么多精彩信息
40