Antiviral Research:蓝柯/吴叔文/周海兵团队在新型广谱肠道病毒抑制剂研究上取得进展
2023-03-28 病毒学国家重点实验室 病毒学国家重点实验室 发表于上海
该论文报道了一种具有新型结构骨架的强效广谱肠道病毒抑制剂(AcTU),并且系统地揭示了其作用机制。
2023年3月23日,病毒学国家重点实验室蓝柯教授、吴叔文副教授和周海兵教授等合作在国际学术期刊Antiviral Research在线发表了题为“Identification of a novel acylthiourea-based potent broad-spectrum inhibitor for enterovirus 3D polymerase in vitro and in vivo”的研究论文。该论文报道了一种具有新型结构骨架的强效广谱肠道病毒抑制剂(AcTU),并且系统地揭示了其作用机制。该化合物可作为较为理想的先导化合物用于后续抗肠道病毒药物的研究。

手足口病(HFMD)是一种由肠道病毒(Enterovirus)引起的传染性疾病,常见于婴幼儿群体。其中以肠道病毒EV-A71引起的手足口病最为严重,能够导致多种神经系统相关疾病症状,例如脑膜炎、脑炎以及急性瘫痪等,严重时甚至能够导致患者死亡。因此,肠道病毒对婴幼儿的生命健康构成了严重威胁。然而,目前尚无可在临床上广泛使用的治疗药物,多款已经进入临床研究的抗肠道病毒药物纷纷以失败告终,这使得开发具有新型结构骨架的强效抗肠道病毒药物迫在眉睫。
在该论文中,作者首先通过高通量筛选(HTS)的方法发现了在体外对EV-A71具有微摩尔抑制活性(EC50?=?1.35 μM,RD细胞)的酰基硫脲化合物Tenovin-1。随后,为了进一步提高其抗病毒活性,作者对其进行多次结构改造,并开展了系统的构效关系研究(SAR),发现了活性最优的化合物AcTU(10m),其EC50值为1 nM,并且无明显细胞毒性。此外,该化合物还能够以浓度依赖性的方式抑制人类肠道病毒EV-A、EV-B、EV-C、EV-D种代表性毒株,体外抑制活性达到了纳摩尔到皮摩尔水平。
作用机制研究表明,该化合物作用于肠道病毒复制的中晚期,并且能够与病毒的3D聚合酶(3Dpol)结合,抑制其RNA链延伸的活性。同时,分子对接模拟分析实验结果显示,它能够紧密地结合在不同肠道病毒聚合酶表面的结合口袋上,并与之形成很强的相互作用。这些结果表明,AcTU通过靶向肠道病毒聚合酶(3Dpol)并干扰病毒基因组复制而发挥抗病毒活性。
最后,作者进一步探究了AcTU的体内的药代动力学特征和抗病毒活性以及安全性。结果表明,该化合物具有较好的药代动力学参数,且在给药剂量仅为0.6mg/kg时,使得感染小鼠的存活率达到了80 %,并且使感染小鼠各组织病毒滴度显著下降,病毒导致的组织病理现象得到缓解。同时,高剂量给药(10 mg/kg)并不会对小鼠产生明显的毒副作用。
以上结果显示,AcTU有潜力作为一种较为理想的先导化合物,具有体内外高效、低毒性和作用靶点保守、明确的优点,有望用于开发新型广谱抗肠道病毒药物,以对抗由肠道病毒感染引起的疾病流行。
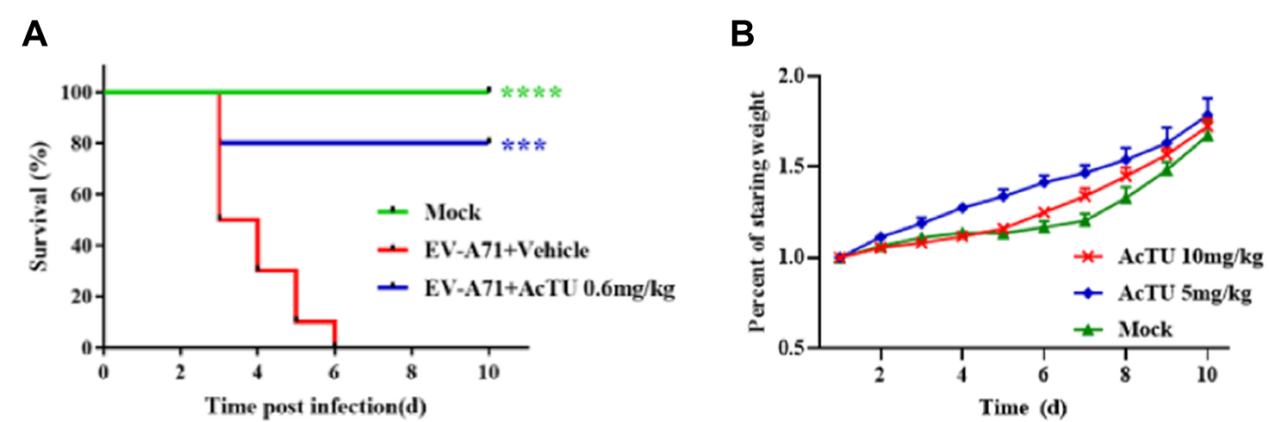
图. AcTU的体内抗病毒活性及安全性
蓝柯教授、吴叔文副教授和周海兵教授为该文共同通讯作者;博士研究生刘欣瑾、许智超和梁锦森为该论文共同第一作者。该研究得到国家自然科学基金的资助,项目相关技术已获得国家发明专利授权。
论文链接:
https://www.sciencedirect.com/science/article/pii/S016635422300061X.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







