马英新团队开发RPA-CRISPR/Cas12a系统,用于快速灵敏检测非洲猪瘟
2023-05-19 生物世界 生物世界 发表于上海
该方法能实现对单拷贝病毒基因组检测,可用于便携式可视化诊断,且在临床样本应用中展现了良好的检测性能,为病毒感染的快速、精准诊断提供了有力工具。
非洲猪瘟是由非洲猪瘟病毒引起的一种急性、出血性、高传染性的猪疾病。迄今为止,仍然没有广泛有效的疫苗和治疗方式用于应对非洲猪瘟,通常依靠快速诊断和扑杀感染猪等手段对疫情进行有效控制。
目前,对于非洲猪瘟的诊断主要依赖于PCR技术,该技术依赖于仪器设备和专业操作人员,只能在实验室中进行,无法满足现场诊断的需求。等温扩增技术,如重组酶聚合酶扩增(RPA)、滚环扩增(RCA)等,具有高效、简便易行等优势,但其灵敏度有限,难以单独用于分子诊断。通过与CRISPR-Cas系统联用,灵敏度显著提高,可增加分子诊断的准确性。然而,目前常用的单模式荧光检测法或比色检测法易受到环境干扰,造成检测结果的不准确。
2023年5月11日,中国科学院深圳先进技术研究院合成生物学研究所马英新课题组与湖北大学印文博士合作,在 Analytical Chemistry 期刊上发表了题为:Fluorescence and Colorimetric Analysis of African Swine Fever VirusBased on RPA-Assisted CRISPR/Cas12a Strategy 的补充封面论文。
该论文首次构建了基于RPA-CRISPR/Cas12a系统的非洲猪瘟病毒(ASFV)比色-荧光双模式检测策略,通过构建新型磁珠-酶报告系统,结合RPA-CRISPR/Cas12a技术,实现了对ASFV基因的比色-荧光双模式精准检测。
该方法能实现对单拷贝病毒基因组检测,可用于便携式可视化诊断,且在临床样本应用中展现了良好的检测性能,为病毒感染的快速、精准诊断提供了有力工具。


超高灵敏CRISPR-Cas12a分子诊断传感器构建用于非洲猪瘟病毒感染快速筛查
本研究开发了一种结合RPA、CRISPR/Cas12a和磁珠-酶新型报告系统,用于ASFV基因的快速精准诊断的方法。如图1所示,biotin-ssDNA-azide与DBCO修饰的碱性磷酸酶(ALP)通过点击化学反应合成biotin-ssDNA-ALP,biotin-ssDNA-ALP与链霉亲和素修饰的磁珠(SA-MB)结合获得MB-ssDNA-ALP报告系统。用RPA扩增ASFV基因序列,获得扩增子,扩增子与Cas12a-crRNA复合物结合,激活Cas12a反式切割活性,切割MB-ssDNA-ALP上的ssDNA,释放ALP;ALP催化pNPP水解生成pNP,引起比色信号变化,再加入量子点作为荧光报告子,实现比色和荧光的双模式信号输出。
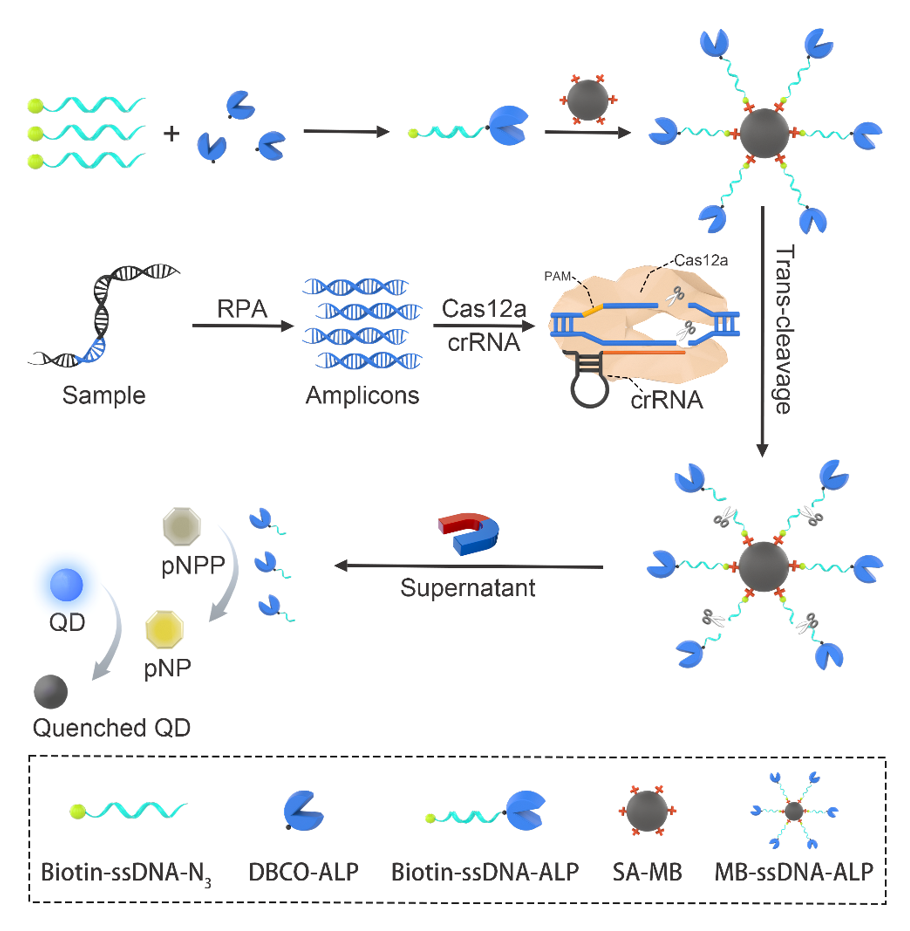
图1:探针构建及ASFV检测原理图。biotin-ssDNA-azide与DBCO-ALP通过点击化学反应获得biotin-ssDNA-ALP,biotin-ssDNA-ALP与SA-MB偶联获得MB-ssDNA-ALP报告子。RPA扩增ASFV基因,扩增子激活Cas12a-crRNA复合物,Cas12a非特异性切割biotin-ssDNA-ALP报告子,释放ALP;ALP水解pNPP,生成黄色pNP,加入蓝色QDs后,在内滤效应作用下,蓝色QDs荧光被猝灭。
在该研究中,团队首先合成、表征了biotin-ssDNA-ALP,并验证了biotin-ssDNA-N3与DBCO修饰ALP的偶联以及MB-ssDNA-ALP探针的合成。然后,考察了RPA扩增ASFV基因的能力。以高度保守的ASFV B646L基因为靶标,设计了三对RPA引物,通过琼脂糖凝胶电泳实验验证了三对引物都可高效扩增ASFV基因。接着,验证了CRISPR-Cas12a靶向剪切ASFV基因的能力。设计靶向三个RPA扩增子序列的crRNA,利用琼脂糖凝胶电泳验证了Cas12a被激活并切割RPA扩增子。最后,结合合成的MB-ssDNA-ALP探针、RPA-CRISPR/Cas12a系统以及蓝色CdZnSe QDs,实现了对ASFV基因的比色-荧光双模式精准检测,灵敏度达20 copies/mL,可视化检测104 copies/mL(图 2A-2D)。
磁分离技术的使用可有效降低背景信号,实现高信噪比检测。对比发现本研究开发的检测方法灵敏度高于qPCR,且具有良好的特异性,探针不与其它猪疾病相关病毒产生交叉反应。同时,还探究了该方法在实际样本中的检测能力,对12份猪血真实样本进行了分析,结果显示该检测方法具有100%的准确度(图2E和2F)。本方法结合荧光法的高灵敏度和比色法的易读性,具有良好的灵敏度、便携性和特异性,为病毒感染的快速、精准诊断提供了有效工具。
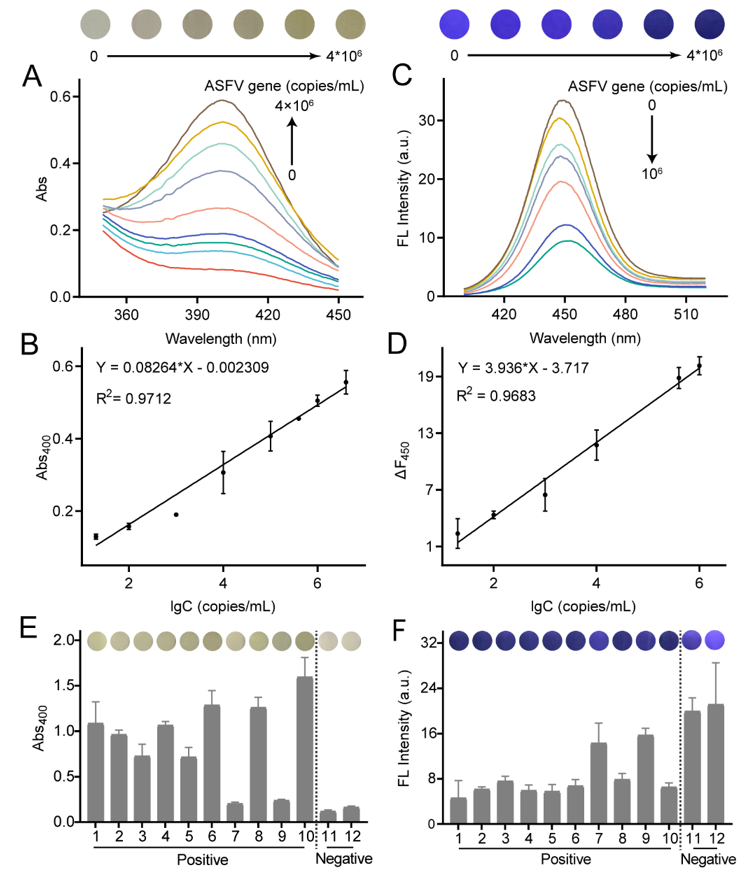
图2 比色-荧光双模式检测ASFV基因。(A)不同浓度ASFV基因下,pNP的紫外光谱。(B)400 nm处吸光度与ASFV基因浓度的对数值之间的线性关系。(C)不同浓度ASFV基因下,CdZnSe QDs的荧光光谱。(D)荧光强度变化与ASFV基因浓度的对数值之间的线性关系。比色(E)和荧光(F)检测方法用于临床样本的分析结果。可视化检测结果均列于图片上方。
论文链接:
https://pubs.acs.org/doi/10.1021/acs.analchem.3c01033
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








