本文概要
辅助化疗
1. JIPANG研究(非鳞):III期,培美曲塞/顺铂 vs. 长春瑞滨/顺铂,RFS和OS相似,培美曲塞给药周期方便仍具有优势
靶向治疗
EGFR突变
2. ADAURA研究:术后辅助治疗,III期,奥希替尼 vs 安慰剂,DFS分别为65.8 vs 21.9个月
3. INSIGHT2研究:II期,EGFR-TKI耐药(MET扩增),特泊替尼+奥希替尼ORR约55%
EGFR 20INS
4. WU-KONG6研究:后线治疗,II期,舒沃替尼,ORR为59.8%,脑转移ORR为48.4%
HER2突变
5. DESTINY-Lung02研究:后线治疗,DS-8201,5.4 vs 6.4mg/kg,低剂量疗效可、安全性优
KRAS G12C
6. CodeBreaK 200研究:后线治疗,III期,AMG-510 vs 多西他赛,PFS 5.6 vs 4.5个月,OS无差异(方案允许交叉)
免疫治疗
新辅助治疗
7. INCREASE研究:II期,放化疗+O药+Y药,pCR率63%,组合是否有点任性?
辅助免疫治疗
8. PEARLS/KEYNOTE-091研究:III期,帕博利珠单抗 vs 安慰剂,DFS为53.6 vs 42.0 个月,PDL1高表达无统计差异
EGFR-TKI耐药
9. ORIENT-31研究:III期,信迪利单抗±贝伐单抗类似物+化疗 vs 化疗,联合组PFS获益
晚期免疫治疗
10. KEYNOTE-189研究(非鳞):一线,III期,K药+化疗 vs 化疗,5年OS率为19.4% vs 11.3%
11. KEYNOTE-407研究(鳞癌):一线,III期,K药+化疗 vs 化疗,5年OS率为18.4% vs 9.7%
12. IPSOS研究:一线,III期,不适合含铂化疗,T药 vs 单药化疗,OS为10.3 vs 9.2个月
13. IFCT-1701研究:III期,O+Y药 6个月治疗(疾病控制) vs. 持续治疗,两者PFS无显著差异
一、辅助化疗
JIPANG研究
JIPANG研究:日本学者进行的一项随机对照Ⅲ期临床研究,以评价培美曲塞联合顺铂对比长春瑞滨联合顺铂作为Ⅱ-Ⅲ期非鳞NSCLC患者辅助化疗的疗效。之前在JCO发表的结果显示,在无复发生存期(RFS)方面的疗效相似。本次会议报告了OS的最终分析结果,同时报告了治疗方案和 EGFR 突变状态与OS之间的相互作用。
方法:完全切除的病理分期II-IIIA Ns-NSCLC患者以1:1的比例随机接受“培美曲塞(500mg/m2,第1天)/顺铂(75mg/m2,第1天)”或“长春瑞滨(25mg/m2,第1天和第8天)/顺铂(80mg/m2,第1天)”,并根据性别、年龄、病理分期、EGFR突变状态和研究机构进行分层。该分析是通过使用最后一例患者入组后 5 年的数据进行的。
结果:2012年3月至2016年8月期间,入组804例患者。783例患者的疗效分析中(培美曲塞/顺铂为389例,长春瑞滨/顺铂为394例),中位年龄为65/65岁;IIIA期52/52%;EGFR突变24/25%。培美曲塞/顺铂组、长春瑞滨/顺铂组更新中位RFS分别为43.4 vs 37.5 个月(HR 0.95,95% CI,0.79-1.14;P = 0.249)。中位随访时间为77.3个月,3年和5年的OS率:87.0%和75.0% vs 84.1%和75.6%(HR 1.04,95% CI,0.81-1.34,P=0.598)。在OS亚组分析中,伴/不伴EGFR突变的患者的HR分别为1.98(95% CI,1.13-3.28)和0.86(95% CI,0.64-1.14)(相互作用,P=0.011)。共观察到441例复发,报告了脑转移情况:伴EGFR突变患者(培美曲塞/顺铂;20(30.3%),长春瑞滨/顺铂;11(18.6%))和不伴EGFR突变的患者(培美曲塞/顺铂; 27(18.6%),长春瑞滨/顺铂; 47(27.5%))。
小结:最终分析表明,培美曲塞/顺铂在该类人群中的RFS和OS与长春瑞滨/顺铂相似。与历史数据相比,无论EGFR突变状态如何,培美曲塞/顺铂或长春瑞滨/顺铂辅助治疗的OS是这类人群中观察到的最长的OS之一。
靶向治疗——EGFR突变
ADAURA研究
NEJM丨肺癌,奥希替尼术后辅助治疗降低83%复发风险
III 期ADAURA研究初步分析显示,与安慰剂相比,奥希替尼辅助治疗可明显改善完全切除EGFR敏感突变(ex19del/L858R)患者的无病生存期(DFS)。II-IIIA 期患者中,DFS HR为0.17(P<0.0001),IB-IIIA期患者中,DFS HR为0.20(P<0.0001)。本次ESMO大会上,研究者报告了进一步随访2年后的DFS和复发模式的最新探索性分析结果。
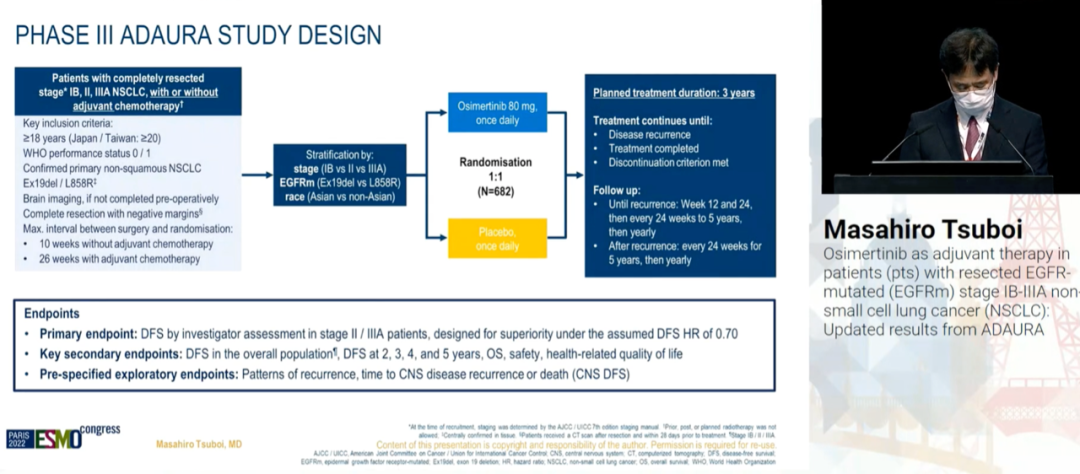
方法:符合条件的患者[年龄≥18岁(日本/中国台湾≥20岁),WHO PS 0/1,完全切除的EGFRm IB-IIIA期(AJCC 第7版)NSCLC;允许进行辅助CT]以1:1的比例,随机接受奥希替尼(80mg,每日一次)或安慰剂治疗,为期3年。主要终点是研究者评估的II-IIIA期患者的DFS。次要终点为IB-IIIA期的DFS、总生存期(OS)和安全性。复发模式和CNS DFS是预先设定的探索性终点(数据截止日期为2022年04月11日)。
结果:在全球范围内,682例患者随机分组(339例为奥希替尼组,343例为安慰剂组)。本次更新分析,1)II-IIIA期患者中,奥希替尼组、安慰剂组的中位DFS分别为65.8 vs 21.9个月[HR为 0.23,95% CI:0.18-0.30(242/470 事件;51%成熟度);两组的3 年DFS率分别为84%和34%]。2)总人群(IB-IIIA 期)中,DFS分别为65.8 vs 28.1个月[HR 为 0.27,95% CI:0.21-0.34;305/682事件] 。

DFS(II-IIIA)
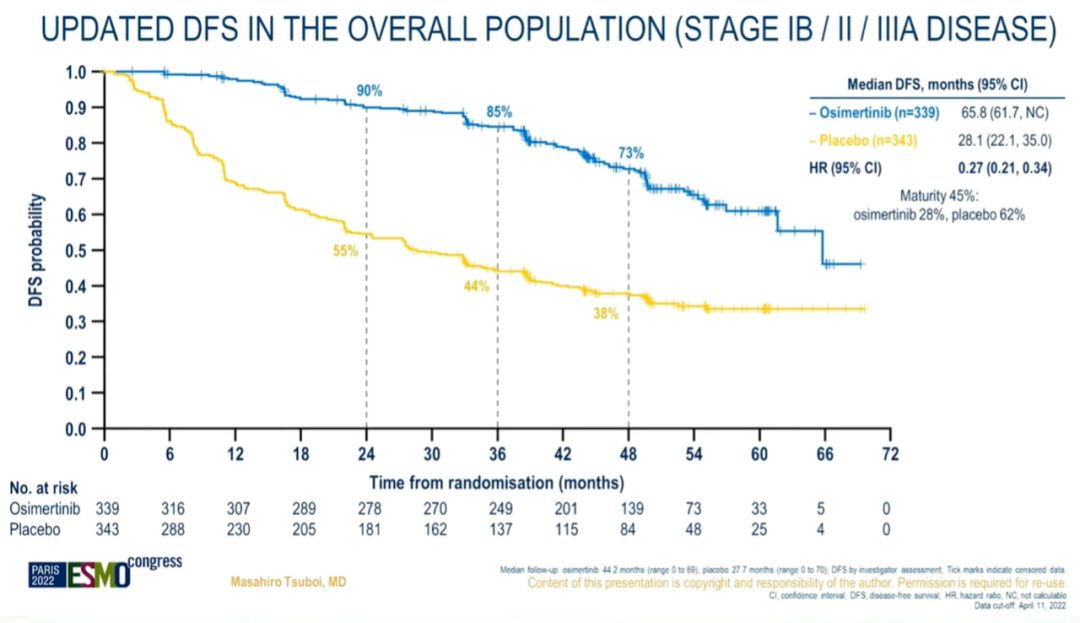
DFS(总人群)
3)值得注意的是,在所有预设亚组中都观察到了奥希替尼相对于安慰剂的DFS获益。在曾接受过辅助化疗的患者(n=410)中,DFS的HR为0.29(95%CI: 0.21-0.39);没有接受过辅助化疗的患者(n=272)的DFS HR为0.36(95%CI: 0.24-0.55)。4)在各疾病分期患者(AJCC第七版)中,IB期、II期、IIIA期患者DFS HR分别为0.41、0.34、0.20。

第七版分期
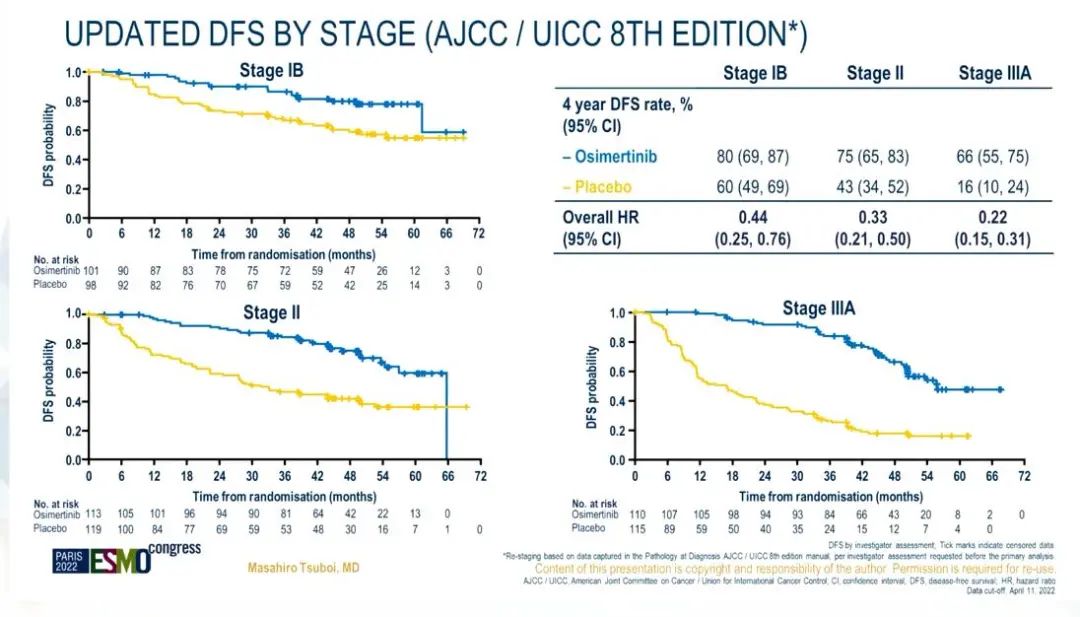
第八版分期

CNS
5)复发模式:a. 与安慰剂组相比,奥希替尼组发生局部/区域和远处复发的患者更少[复发率分别为27%(n=93/339)和60%(n=205/343)]。奥希替尼组中最常见的复发部位分别是肺(12%)、淋巴结(6%)和CNS(6%),安慰剂组最常见的复发部位分别是肺(26%)、淋巴结(17%)和CNS(11%)。b. 共有63名患者经历了CNS DFS事件;其中22名患者在奥希替尼组,41名在安慰剂组。两组中位CNS DFS均为达到,II-IIIA期患者的CNS DFS HR 为 0.24(95% CI 0.14, 0.42;63/470)。
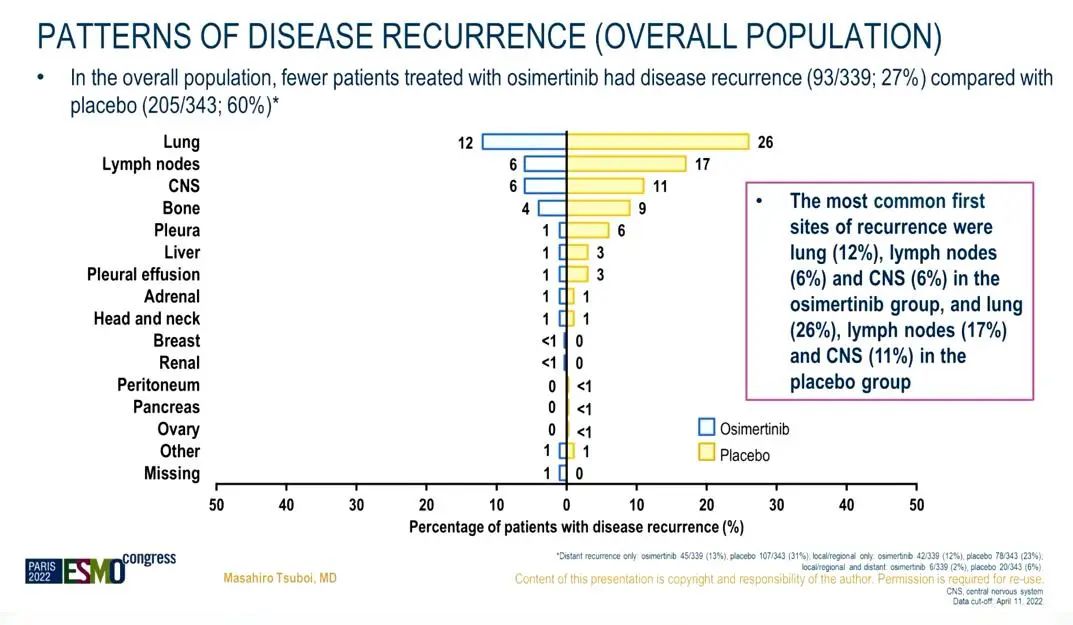 复发模式
复发模式
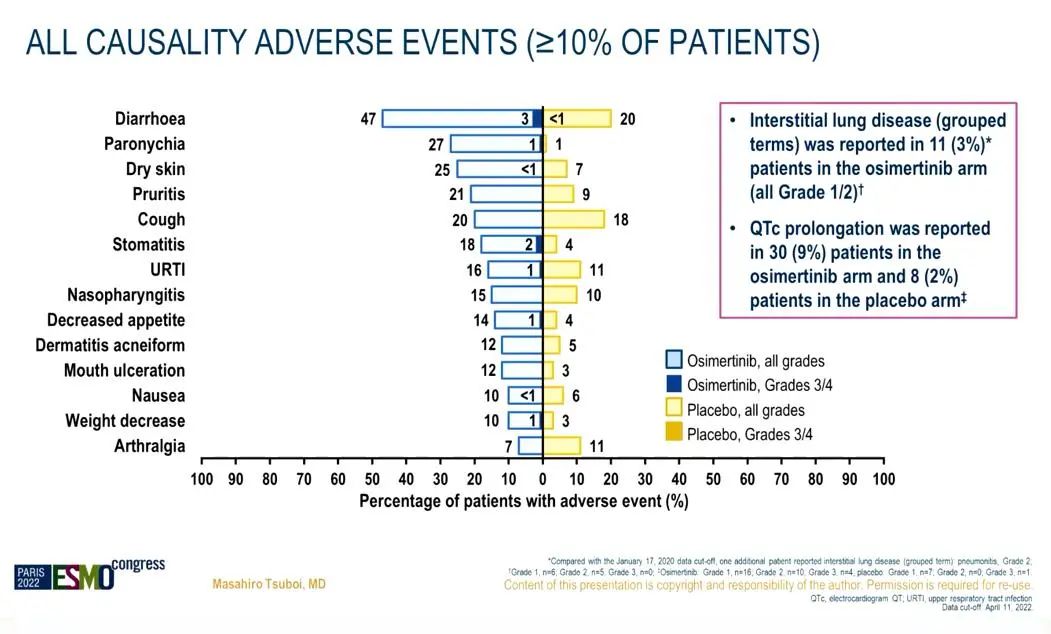
安全性
小结:进一步随访2年后,与安慰剂相比,奥希替尼显示出持续的DFS获益,与初步分析结果一致。这些成熟的数据强化了奥希替尼作为完全切除EGFRm IB-IIIA期NSCLC患者辅助治疗的标准疗法。
INSIGHT2研究
患者招募丨“赛沃替尼+奥希替尼”治疗经EGFR TKI治疗失败伴MET扩增的晚期非小细胞肺癌
患者招募丨“赛沃替尼+奥希替尼”一线治疗EGFRm+/MET+的局部晚期或转移性非小细胞肺癌
INSIGHT2研究:这是一项非随机、开放标签、II期临床研究,旨在评估Tepotinib单药(500mg,每天一次)或联合奥希替尼(80mg,每天一次)治疗MET扩增导致的一线奥希替尼治疗耐药的疗效和安全性。研究分为Tepotinib+奥希替尼联合治疗组和Tepotinib单药组,主要终点是BICR评估的联合治疗的客观缓解率(ORR)和剂量限制毒性(仅限于安全性导入期,Safety run-in)。次要终点包括研究者(INV)评估的联合治疗的ORR、由BICR和INV评估的Tepotinib单药治疗的ORR、由BICR和INV评估的DOR、疾病控制率(DCR)、PFS以及OS和安全性等。
2022AACR会议(点击)上已公布INSIGHT研究结果,与化疗相比,Tepotinib+吉非替尼联合治疗显著改善了伴有MET扩增的EGFR突变阳性NSCLC患者无进展生存期(16.6 vs 4.2个月,HR=0.13)和总生存期(21.1 vs 13.1个月,HR=0.10)。本次会议报道了一线奥希替尼治疗耐药的疗效。
研究设定的MET扩增标准使用了两种方式:1)组织活检FISH 检测为MET GCN ≥5和/或 MET/CEP7 ≥2;2)液体活检NGS 检测为MET GCN ≥2.3。
研究结果:425例患者接受了入组筛查,结果153例MET扩增阳性(36%),其中组织活检检出139例,占全体筛查患者的33%;液体活检检出47例,占全体筛查患者的11%。有33例组织活检和液体活检同时阳性。最终100 例患者接受了治疗,其中88例接受Tepotinib+奥希替尼,12例单药Tepotinib。接受治疗的患者56%为亚裔。
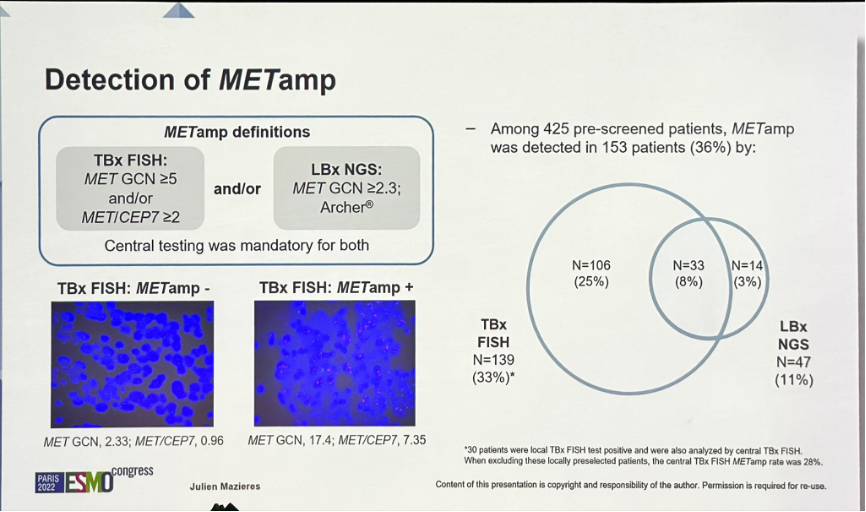
MET扩增标准和筛查结果
Tepotinib+奥希替尼组:1)组织活检经FISH确定的MET扩增,其中22例患者随访≥9个月,ORR为54.5%;另外,48例患者随访≥3个月,ORR为45.8%。2)液体活检经NGS确定MET扩增,其中16例患者随访≥9个月,ORR为50.0%;另外,23例随访≥3个月,ORR为56.5%。
Tepotinib单药组,12例患者均为组织活检经FISH确定的MET扩增,ORR为8.3%。

治疗反应
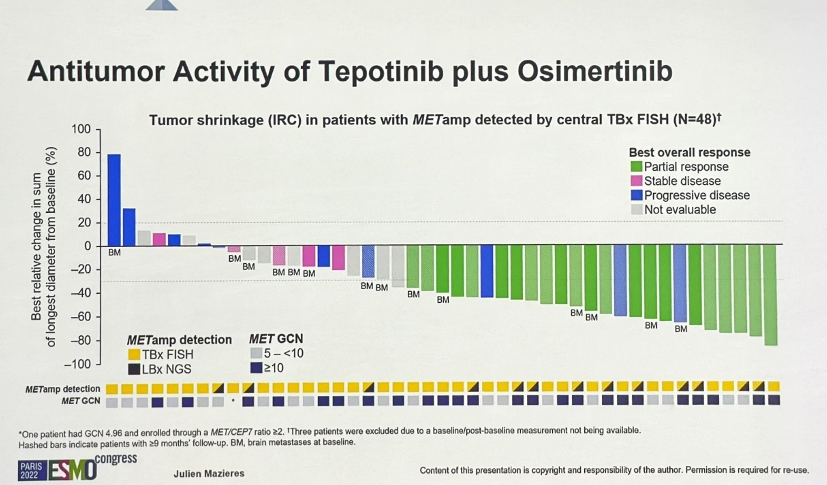
BM为基线脑转
安全性:在88例接受特泊替尼联合奥希替尼治疗的患者中,治疗相关不良事件的发生情况:

EGFR 20INS
WU-KONG6研究
患者招募丨DZD9008治疗EGFR 20号外显子插入突变的局部进展或转移性非小细胞肺癌
WU-KONG6研究:是一项在中国进行的开放、单臂、多中心II期注册研究,纳入既往接受过铂类化疗、携带EGFR exon20ins突变的晚期NSCLC患者,接受舒沃替尼单药治疗(300mg QD),直至疾病进展或出现不可耐受的毒性。主要研究终点是独立评审委员会(BICR)依据RECIST v1.1评估的客观缓解率。【舒沃替尼(DZD9008)是一款口服、针对多种EGFR突变亚型的高选择性EGFR酪氨酸激酶抑制剂(TKI),凭借出色的疗效和安全性,成为肺癌领域首个且目前唯一获得中、美两国“突破性疗法认定(简称:BTD)”的国产“I类新药”,目前已有多项关键临床研究在全球范围内开展。本次ESMO年会上报道的数据来自舒沃替尼首个中国注册研究WU-KONG6。】
研究结果:截至2022年7月31日,共入组97例经含铂化疗失败的、EGFR exon20ins突变型晚期NSCLC患者,中位治疗年龄为58岁,中位既往治疗线数为2线,基线伴脑转移患者占比达32%。1)经BICR确认的ORR为59.8%,达到主要研究终点;2)对于基线伴有脑转移的患者,ORR为48.4%。
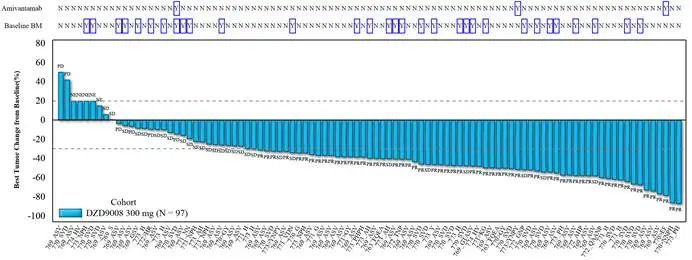
图1:靶病灶大小变化的最佳百分比;BM: brain metastasis,脑转移
3)研究共纳入30种EGFR exon20ins突变亚型,其中71例患者插入突变发生在近环端(near-loop),ORR达62%;24例患者插入突变位置发生在远环端(far-loop),ORR达50%。
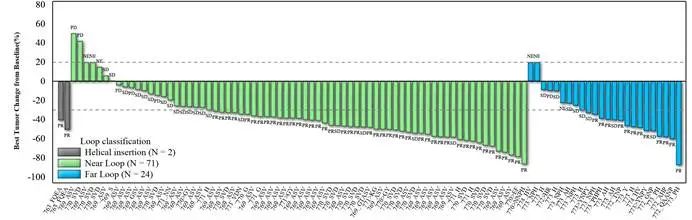
图2:舒沃替尼对于不同EGFR exon20ins突变亚型的抗肿瘤活性;Helical insertion: C-螺旋插入突变;Near Loop: 近环端插入突变;Far Loop:远环端插入突变
安全性:分析数据来自舒沃替尼国内外四项多中心临床研究(WU-KONG1、WU-KONG2、WU-KONG6和WU-KONG15*)的汇总分析。截至2022年7月31日,共纳入 277名接受至少 1 次舒沃替尼治疗的晚期NSCLC患者。研究结果提示:舒沃替尼整体安全性良好,常见不良反应类型与传统EGFR-TKI类似,且绝大多数为1-2级不良反应,临床可管理及恢复。*WU-KONG1研究作为国际多中心研究,覆盖美国、澳大利亚、韩国、日本及中国台湾等国家及地区;WU-KONG2和WU-KONG6均为中国多中心研究, WU-KONG15为研究者发起的研究,在中国进行。
HER2突变
DESTINY-Lung02研究
患者招募丨DS-8201一线,或一线进展后治疗HER2突变转移性非小细胞肺癌患者
DESTINY-Lung02研究:这是一项盲法、随机、非对照的2期试验,评估了T-DXd剂量5.4和6.4 mg/kg对经治的HER2突变转移性NSCLC患者的受益-风险。患者2:1随机分配至T-DXd 5.4或6.4 mg/kg Q3W。主要终点为BICR评审的确定性客观缓解率(cORR)。次要终点包括BICR确定的持续缓解时间(DoR)、确定的疾病控制率(cDCR)和安全性。预先设定的早期队列[PEC;在数据截止前(DCO)随机化≥4.5个月的患者]被定义为基线后进行肿瘤评估的患者。安全分析集(SAS)为所有接受T-DXd≥1剂量的随机患者。这项研究并没有对剂量进行统计上的比较。本次会议报告了DESTINY-Lung02的中期结果。【在DESTINY-Lung01中,T-DXd 6.4 mg/kg在经治的HER2突变NSCLC患者中显示出持久的活性。】
研究结果:DESTINY-Lung02(数据截止日期为2022年3月24日)预设的中期分析显示,接受T-DXd5.4mg/kg(队列1;n=52)或6.4mg/kg(队列2;n=28)的患者展现出具有临床意义的疗效,两种剂量的安全性与T-DXd的总体安全性保持一致,其中5.4mg/kg剂量的安全性和耐受性更佳。经盲态独立中心审查(BICR)评估,队列1和队列2的经证实客观缓解率(ORR)分别为53.8% vs 42.9%。对队列1进行的90天随访显示(截至到2022年6月22日),T-DXd展现出的经证实的ORR为57.7%(95%CI,43.2-71.3),中位DoR为8.7个月(95%Cl:7.1-NE),其中1.9%的患者达到CR,55.8%的患者达到PR。
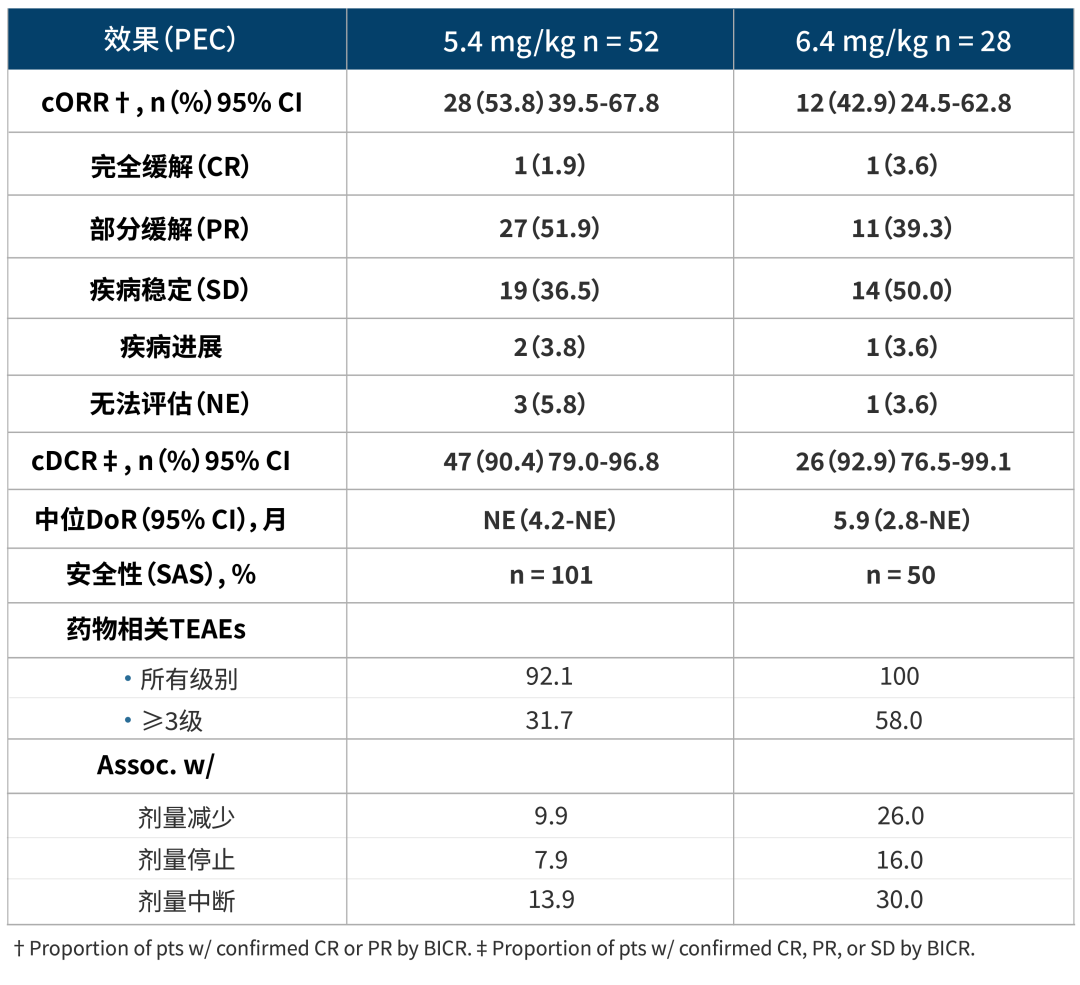
安全性:DESTINY-Lung02临床研究中观察到接受T-DXd(5.4mg/kg)治疗的患者的总体安全性特征与既往试验中所观察到的一致,没有发现新的安全性问题。治疗出现的不良事件(TEAEs)6.4 mg/kg较5.4mg/kg组高,在SAS中,接受T-DXd 5.4或6.4 mg/kg治疗的患者中,5.9%和14.0%的患者发生了任何级别的药物相关间质性肺病。大多数为1级或2级的低级ILD(5.4mg/kg列队的患者有5.0%,6.4mg/kg列队的患者有14.0%),报告了1例三级事件(5.4mg/kg列队的患者有1%)。未发生四级或五级ILD或肺炎。
小结:在经治的HER2突变非小细胞肺癌患者中,T-DXd 5.4 mg/kg和6.4 mg/kg显示了具有临床意义的活性,T-DXd 5.4 mg/kg具有更好的安全性。
KRAS G12C
CodeBreaK 200研究
患者招募丨D-1553治疗KRAS G12C突变的晚期或转移性实体瘤
患者招募丨MRTX849治疗KRAS G12C突变的晚期非小细胞肺癌患者
CodeBreaK 200研究:是一项随机对照、多中心、开放标签的III期研究,旨在评估Sotorasib与多西他赛在治疗携带KRASG12C突变的NSCLC患者中的有效性和安全性,这些患者既往接受过基于铂类的化疗和免疫检查点抑制剂治疗。该项研究共纳入345例患者,主要终点是PFS,关键次要终点包括总生存期、客观缓解率以及患者报告结局。【Sotorasib是全球首款KRAS G12C不可逆抑制剂,口服,一天一次。2021年5月,Sotorasib获FDA加速批准上市,用于二线治疗携带KRAS G12C突变的局部晚期或转移性NSCLC成人患者。】
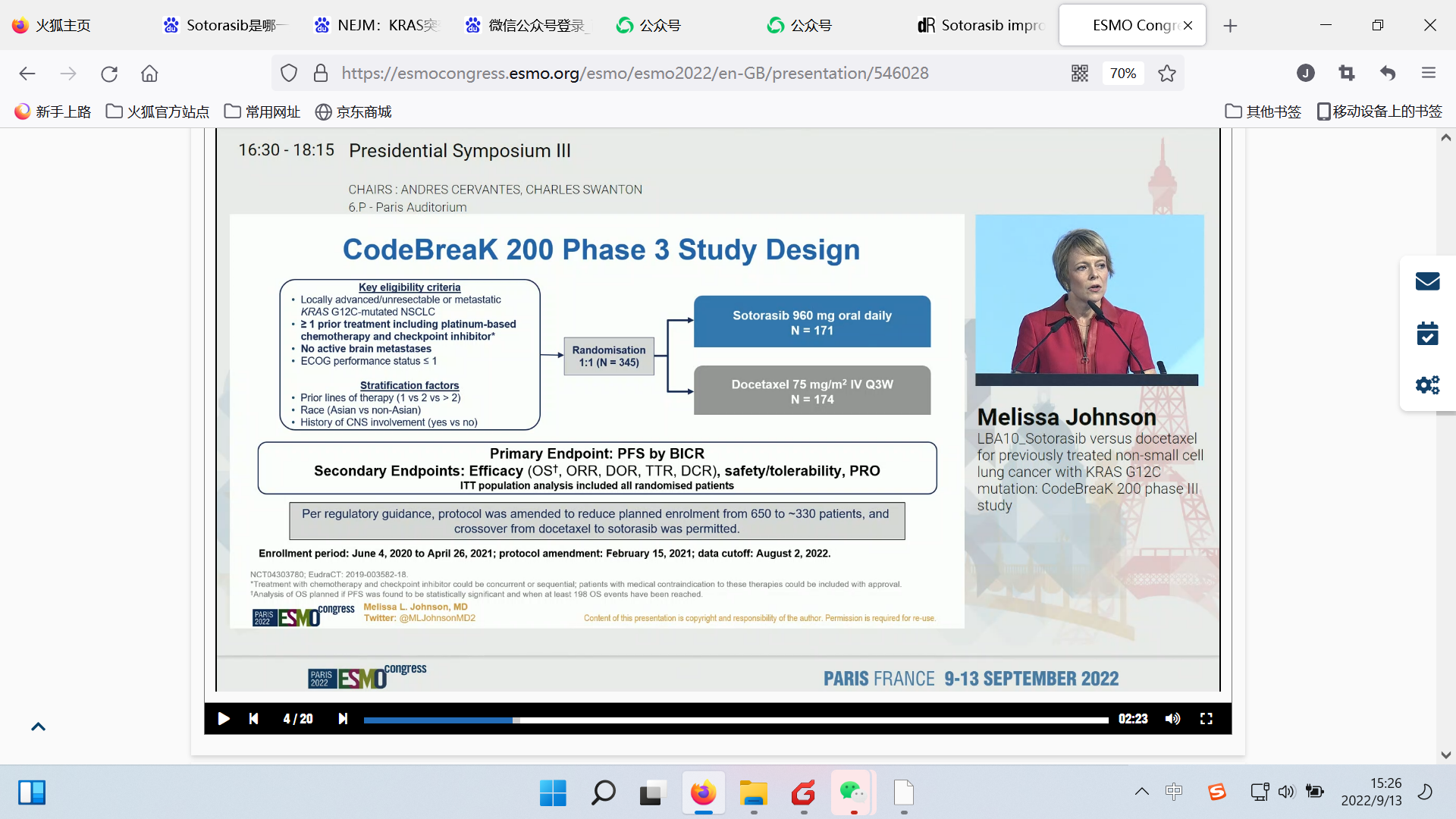
研究设计
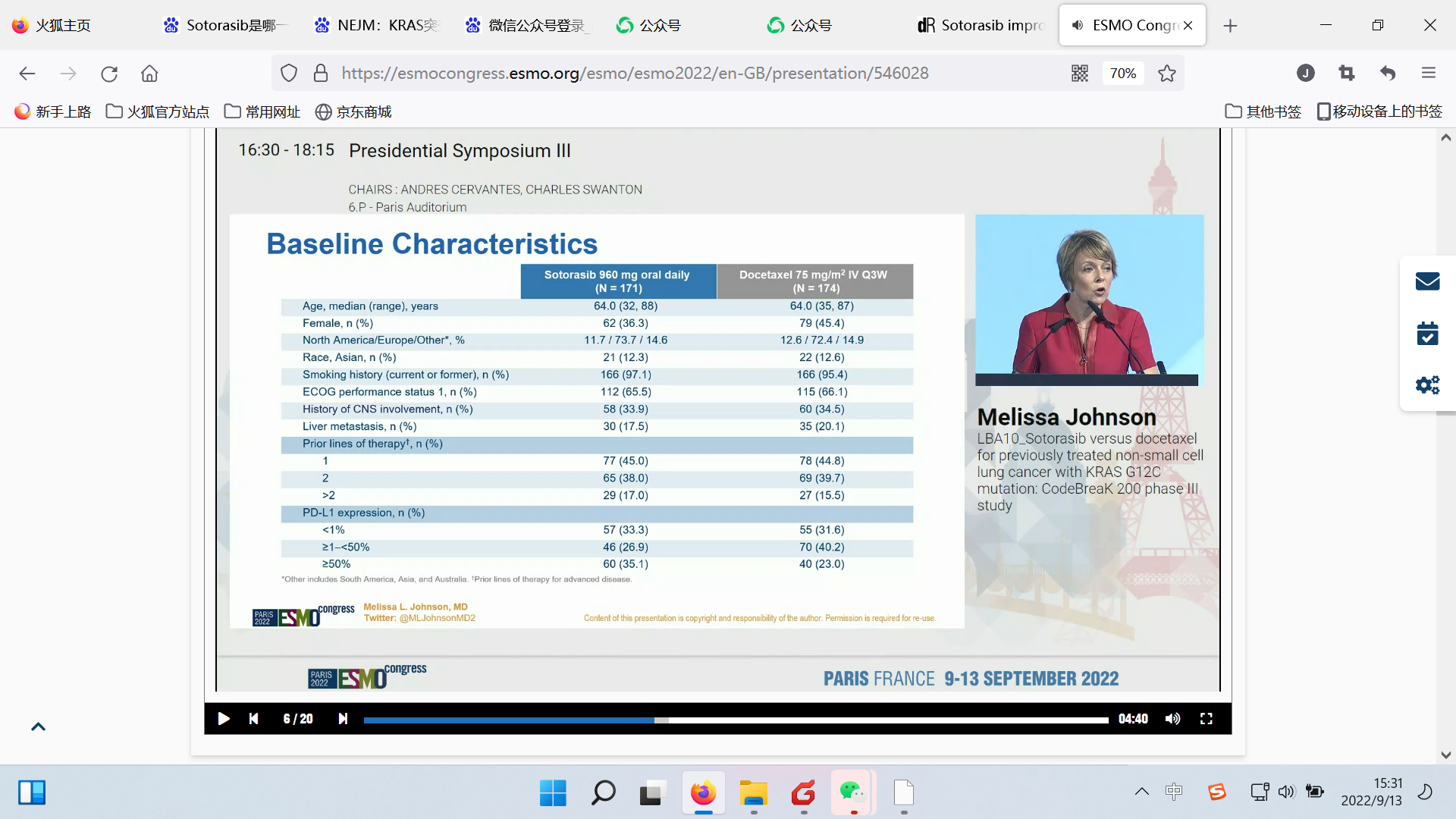
基线特征
研究结果:该研究达到了其主要终点,即在中位随访17.7个月后,相比多西他赛,sotorasib治疗使患者的无进展生存期(PFS)显著改善,中位PFS分别为5.6 vs 4.5个月(HR 0.66;95% CI: 0.51-0.86;p=0.002);1年PFS率分别为24.8% vs 10.1%,PFS获益在各亚组一致。
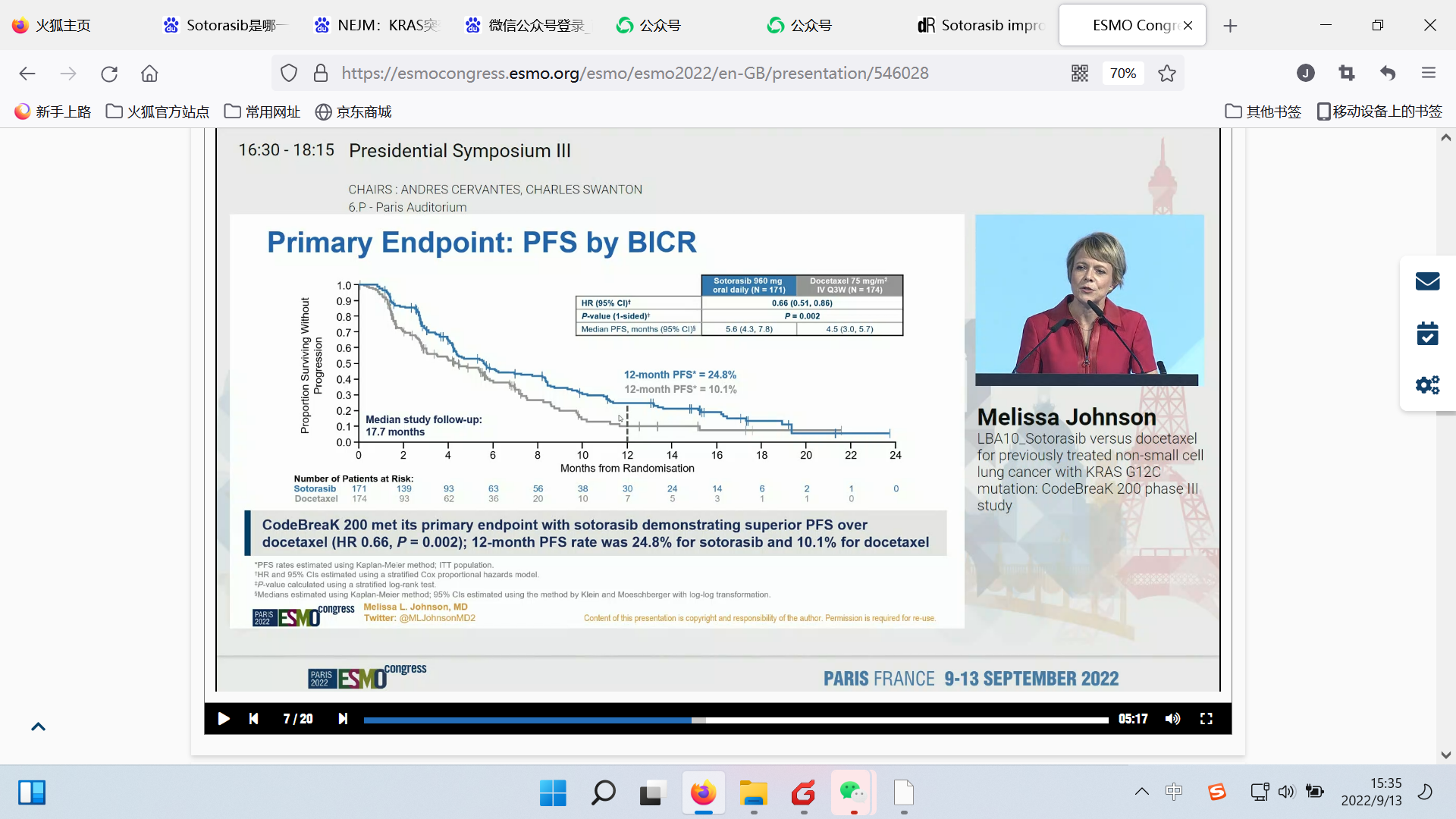
PFS
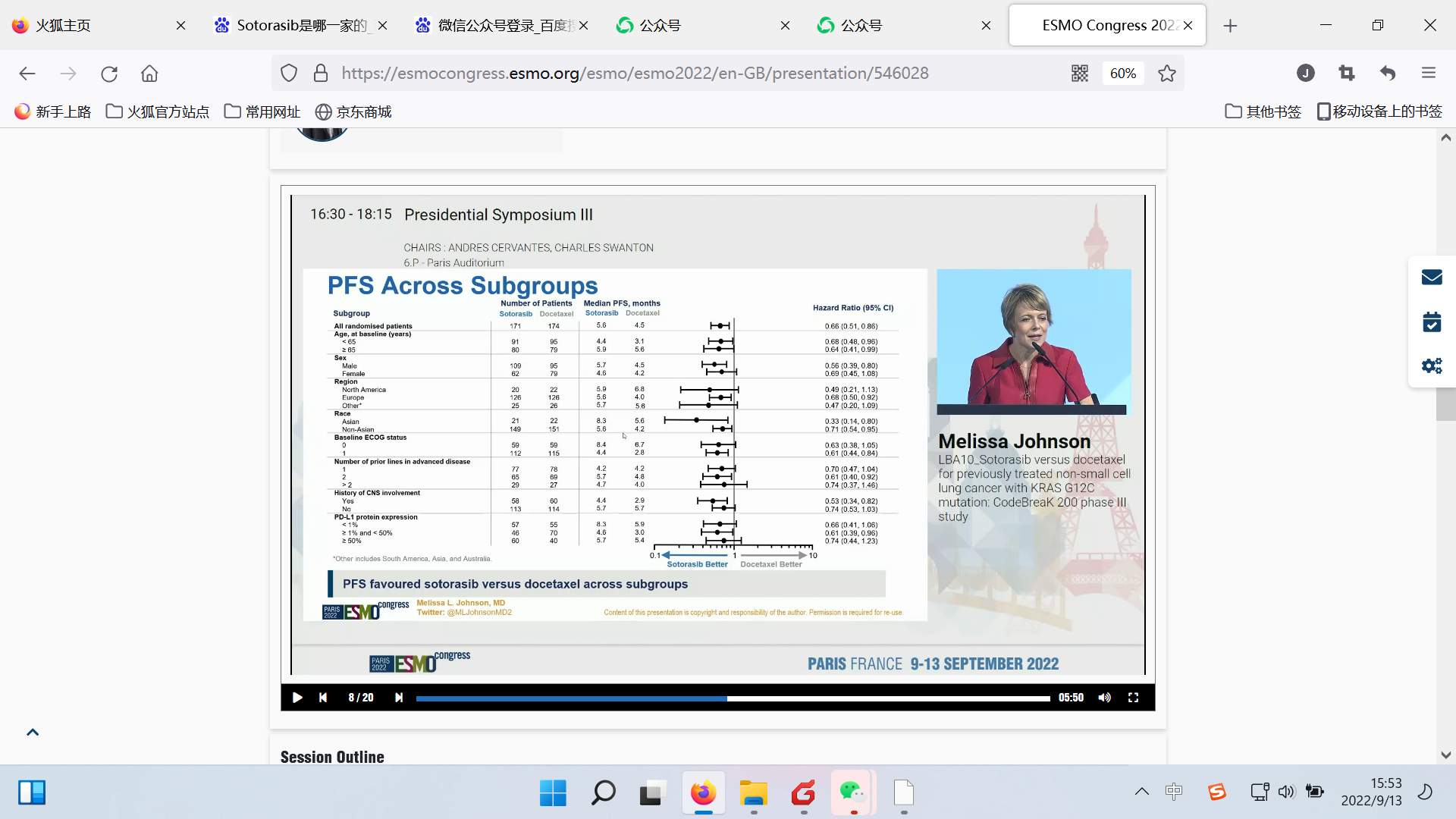
亚组分析
BICR评估的ORR,分别为28.1%(sotorasib,并不惊艳)和13.2%(多西他赛);两组分别有80.4%和62.8%的患者肿瘤缩小;疾病控制率(DCR)分别为82.5%和60.3%。
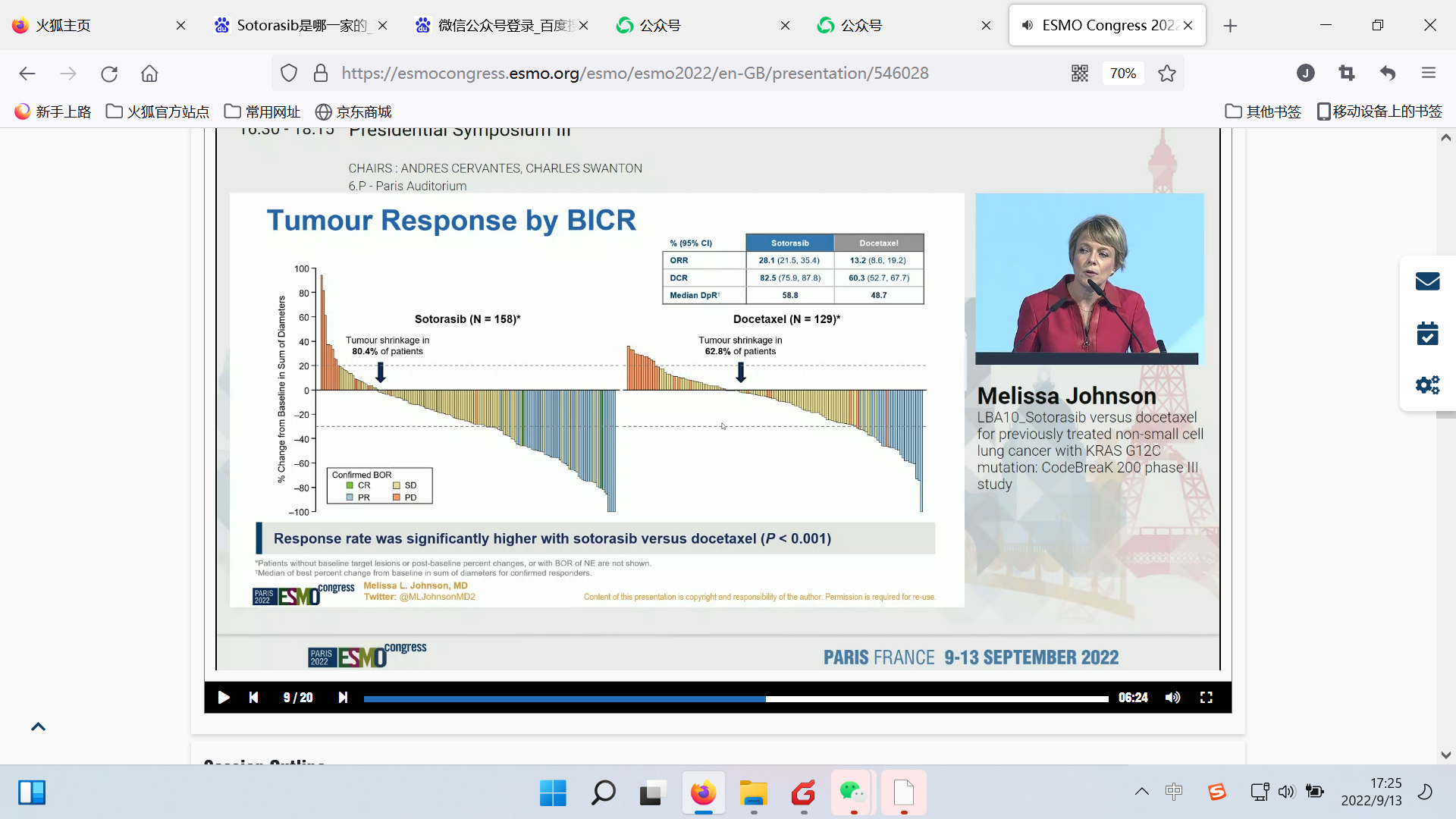
ORR
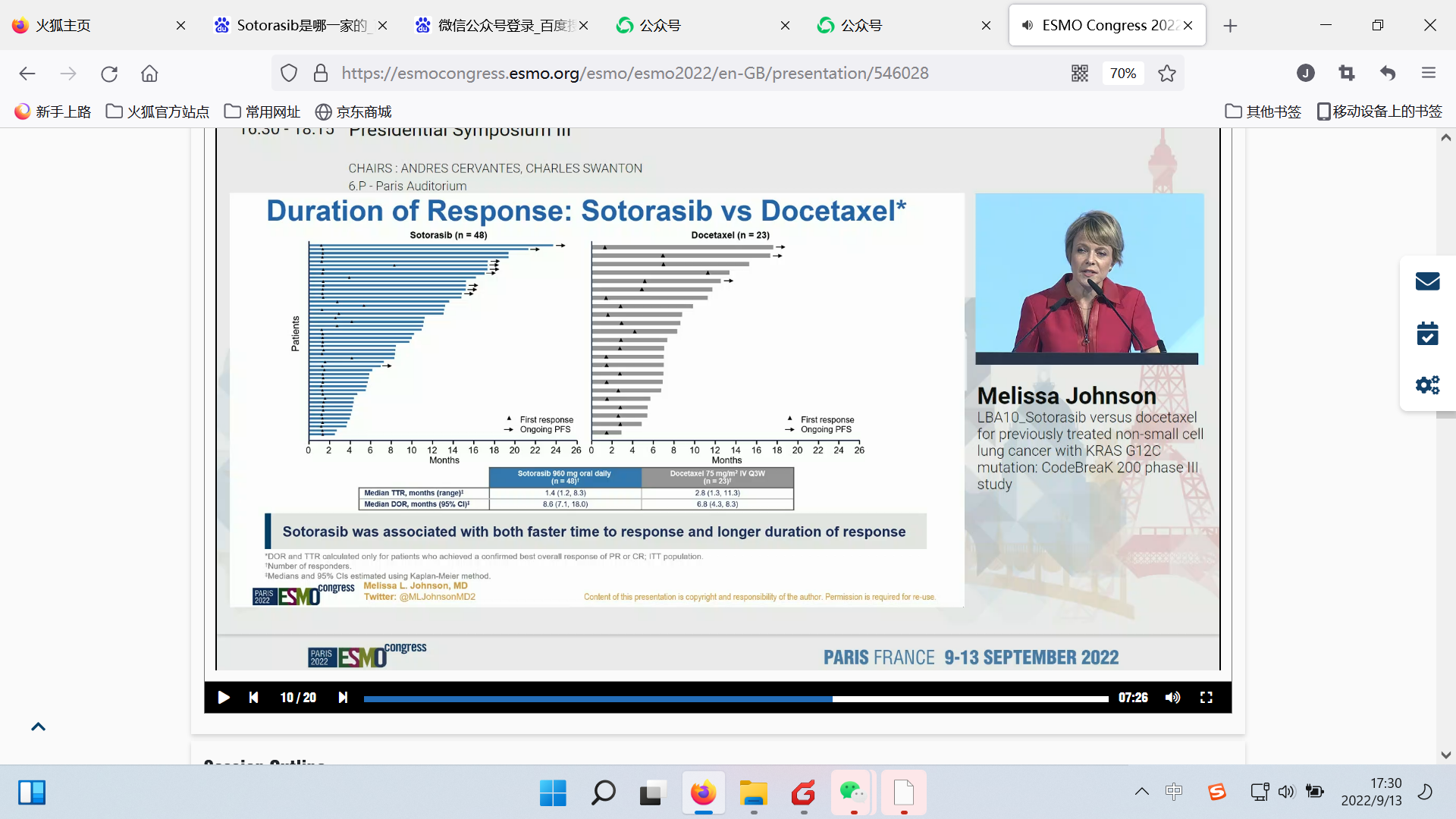
DoR
总生存期(OS)没有显示出差异,sotorasib和化疗组的中位OS分别为10.6和11.3个月(HR=1.01; p=0.53)。原因是研究方案允许交叉以及后续治疗影响了OS。
安全性:sotorasib优于多西他赛,≥3级治疗相关不良事件(TRAE)发生率分别为33.1%和40.4%,严重TRAE发生率分别为10.7%和22.5%。
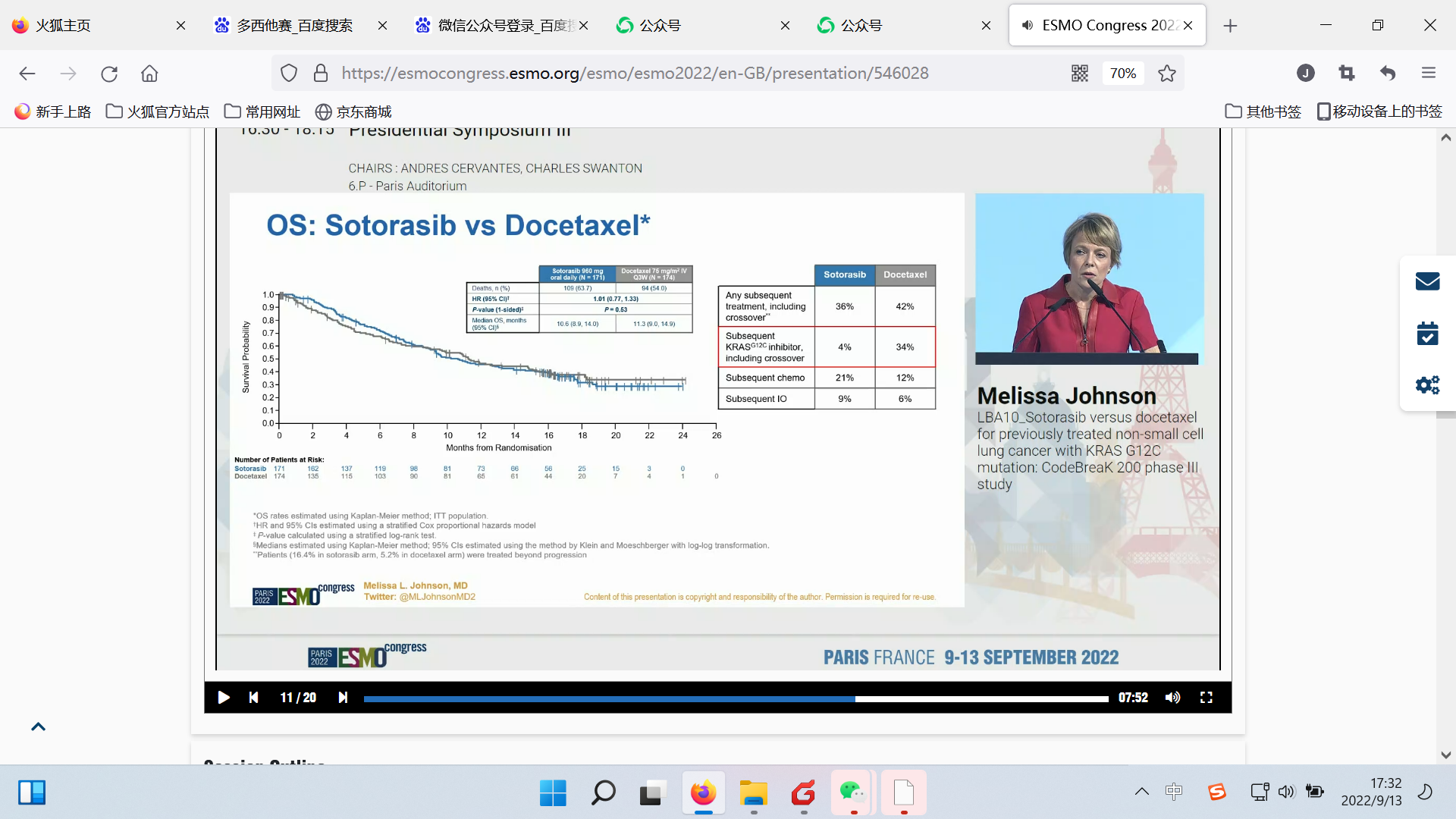
OS
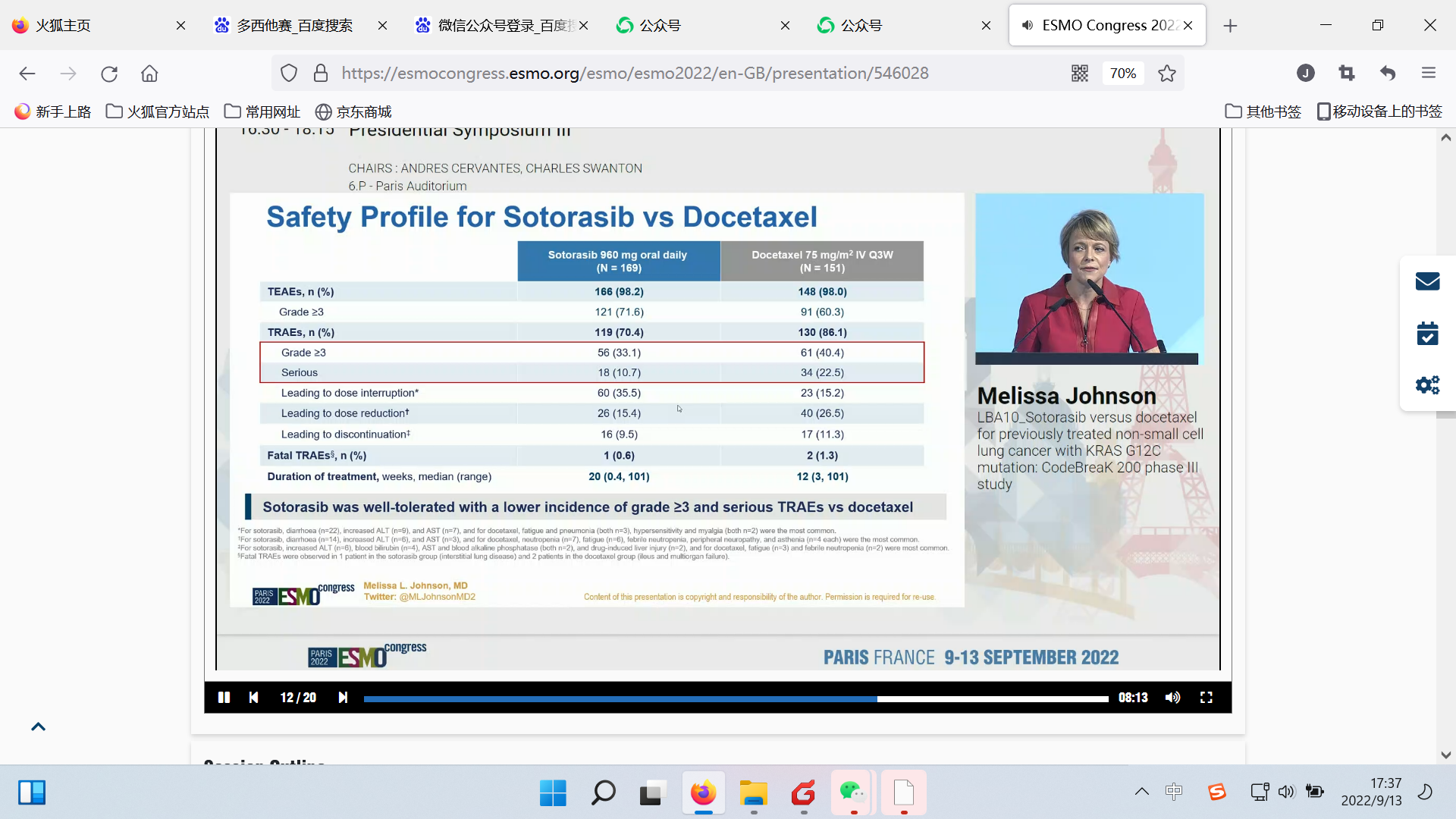
安全性
免疫治疗
新辅助治疗
INCREASE研究
INCREASE研究:是一项单臂、前瞻性II期研究,旨在探索诱导治疗阶段予以“CRT联合伊匹木单抗+纳武利尤单抗”方案的疗效和安全性。试验招募了26例可评估(临界)可切除的T3-4N0-2 NSCLC患者。于2020年2月开始入组。主要研究终点是pCR。研究假设与单独使用CRT的pCR历史数据30%相比,该方案可将pCR提高到60%。共同主要终点是安全性和主要病理缓解(MPR),即残存肿瘤细胞百分比≤10%。第1天,含铂双药化疗同步放疗,伊匹木单抗1 mg/kg和纳武利尤单抗 360mg 固定剂量,3周后给予纳武利尤单抗(360mg 固定剂量)。放疗总剂量为50-60 Gy,2Gy qd,在最后一次放疗的6周后进行切除。【新辅助放化疗 (CRT) 序贯手术是局部晚期非小细胞肺癌伴有限纵膈淋巴结转移的一种治疗选择。病理完全缓解 (pCR) 与生存期的改善相关,但仅约30%的患者在新辅助CRT后达到pCR。新辅助伊匹木单抗+纳武利尤单抗(IPI-NIVO)可以调节肿瘤微环境,并提高病理缓解。】
结果:迄今为止,在接受手术的24例患者中,有15例(63%)达pCR,MPR率为79%。在CRT中联用伊匹木单抗+纳武利尤单抗的毒性是可耐受的(3-4级治疗相关不良事件发生率为56%)。没有患者因新辅助治疗而延迟手术。没有发生与治疗相关的死亡。新辅助治疗增强了外周血CD4+和CD8+效应因子和记忆亚群的活化,增加了肿瘤引流淋巴结中CD8+T细胞增殖标志物的表达。
小结:结果表明,在新辅助CRT中联用伊匹木单抗+纳武利尤单抗是安全的,产生深度病理缓解并增强T细胞活化。这些数据支持在计划CRT后进行手术的局部晚期NSCLC患者中使用这种组合的进一步研究,并支持在无法手术的NSCLC患者中使用这种策略。
辅助免疫治疗
PEARLS/KEYNOTE-091研究
PEARLS/KEYNOTE-091研究:是一项随机对照、三盲III期临床试验,旨在评估帕博利珠单抗对比安慰剂作为肺癌根治术后IB(T≥4 cm),II期,IIIA期NSCLC患者辅助治疗的有效性和安全性,免疫治疗后的辅助化疗方案根据指南制定。符合条件的患者以1:1的比例随机分配到帕博利珠单抗 200mg或安慰剂Q3W,18次剂量。分层因素为PD-L1 TPS <1% vs. 1-49% vs. ≥50%。双主要终点是ITT和TPS≥50%人群中的DFS。
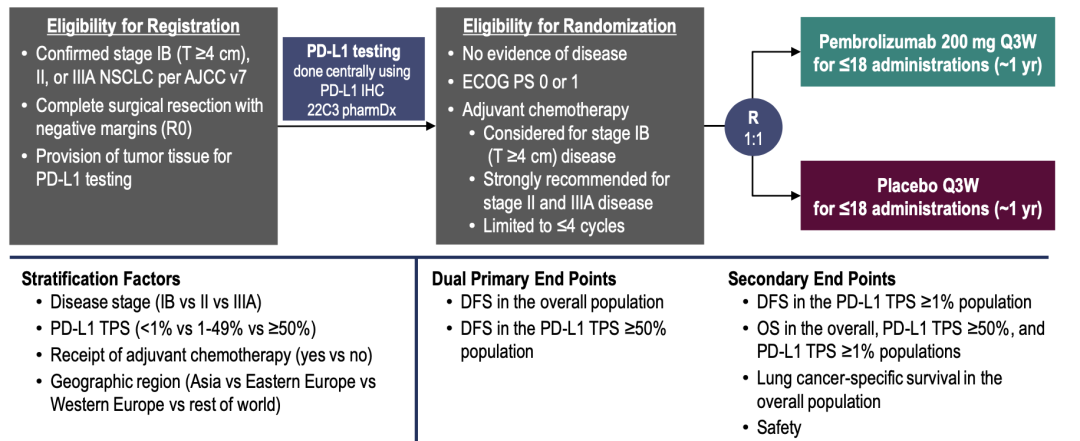
研究设计、基线特征

今年3月ESMO Virtual Plenary Resources发布的结果显示,帕博利珠单抗显着改善了 DFS(53.6个月 vs 42.0 个月;HR=0.76, 95% CI, 0.63-0.91;p=0.0014)。但未能证明PD-L1高表达(TPS≥50%)人群的的显著获益(两组均未达到中位数;HR=0.82;95%CI,0.57-1.18;P=0.14)。根据分析计划,将在未来继续分析中PD-L1表达人群的DFS和OS。本次会议介绍了PD-L1亚组更详细的结果。
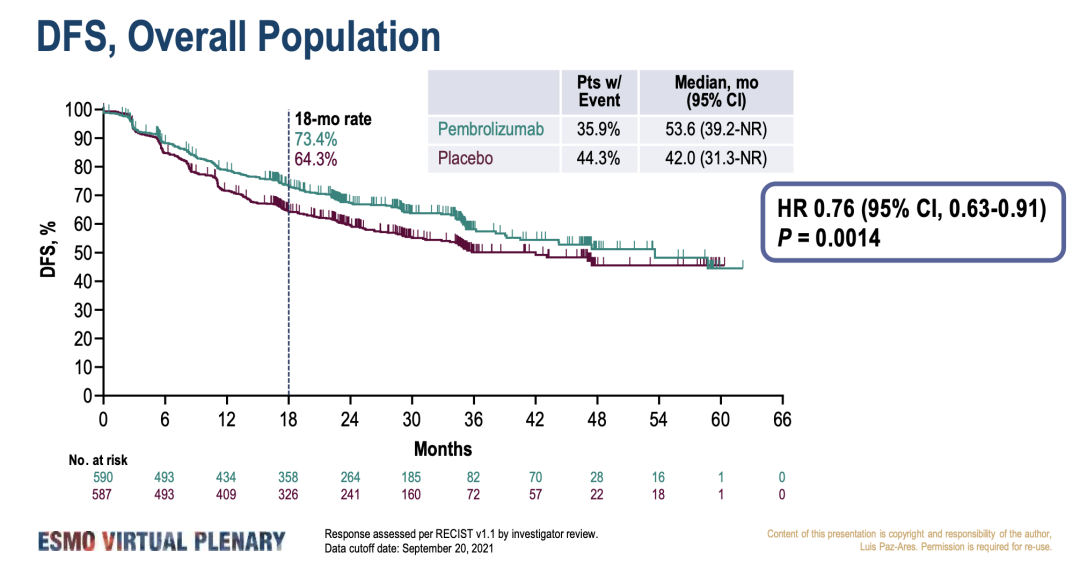
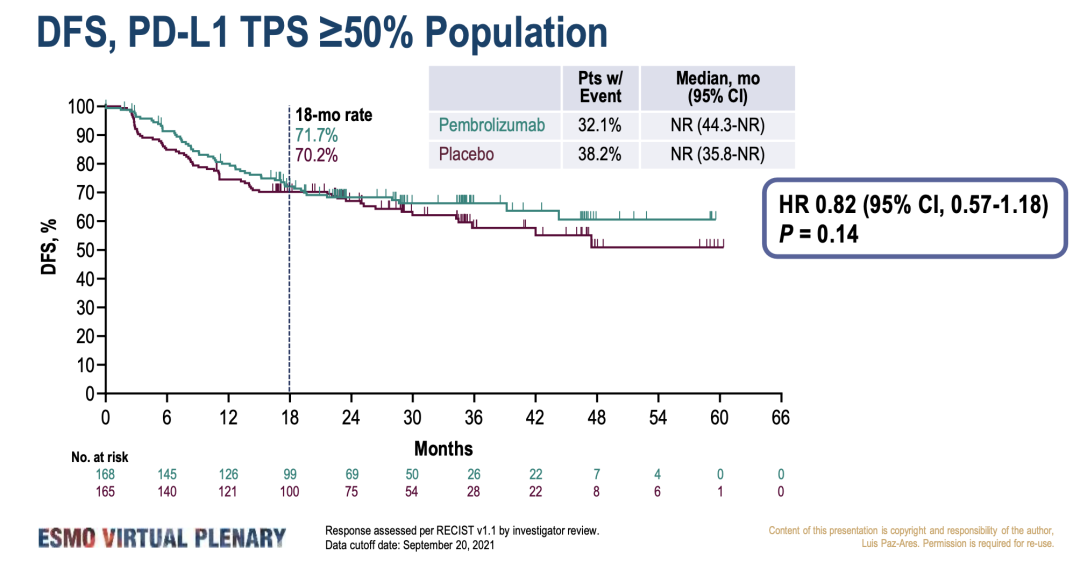

研究结果:在1177例随机患者中,PD-L1 TPS<1%、1-49%、≥50%占比分别为39.5%、32.2%、28.3%。在ITT和TPS≥50%人群中,帕博利珠单抗组和安慰剂组之间的基线特征基本平衡。帕博利珠单抗组与安慰剂组3-5级AE发生率:在ITT人群中为,34.1% vs 25.8%;在TPS≥50%人群中为,37.8% vs. 25.0%。AE导致停药的发生率:在ITT人群中为,19.8% vs 5.9%;在TPS≥50%人群中为,23.2% vs 6.7%。帕博利珠单抗改善了TPS≥50%,1-49%和<1%亚组的DFS。
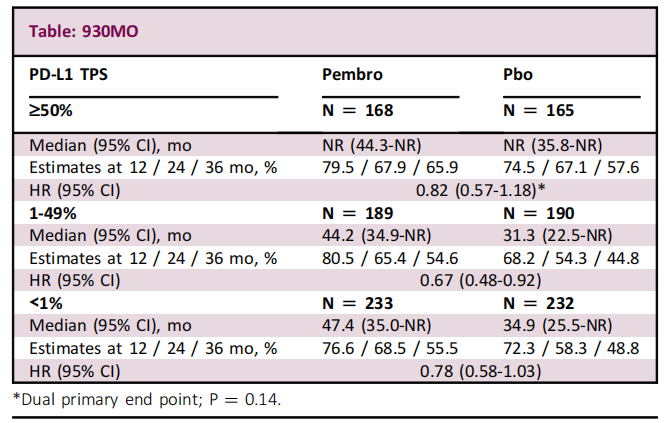
小结:正如预期的那样,与PD-L1 TPS为1-49%和<1%亚组相比,PD-L1 TPS≥50%亚组中帕博利珠单抗组的中位和长期DFS估计值在数值上有所改善。在第二次中期分析中,TPS≥50%人群未发现统计学差异的显著获益,可能是由于该人群中安慰剂表现较好和人群规模较小所致。PD-L1选定人群的DFS将在下一次期中分析中公布。总体而言,数据支持帕博利珠单抗使完全切除的IB-IIIA 期NSCLC 获益,可被推荐作为辅助治疗(无论 PD-L1 表达如何)。
EGFR-TKI耐药
ORIENT-31研究
ORIENT-31研究:是一项随机、双盲、III期研究,旨在评估信迪利单抗±IBI305(贝伐单抗类似物)+化疗对比化疗用于经EGFR-TKI治疗进展的EGFR突变的局部晚期或转移性非鳞状NSCLC患者的疗效和安全性。第一次中期分析显示,与化疗相比,信迪利单抗+IBI305+化疗可显著改善患者PFS,A组 vs C组(PFS HR 0.464,P<0.0001)(Lu, et al.Lancet Oncol 2022)。今年ESMO大会上,陆舜教授口头报告了第二次中期分析结果。

研究设计

基线特征
研究结果:中位随访时间为13.1 个月,由独立放射学审查委员会(IRRC)评估的信迪利单抗+贝伐珠单抗类似物联合化疗组(试验组A)、信迪利单抗联合化疗组(试验组B)和化疗组(对照组C)的mPFS分别为7.2个月、5.5个月和4.3个月。试验组B对比对照组C获得了显著且具有临床意义的中位无进展生存期(mPFS)延长,风险比(HR)为0.723(95%CI: 0.552, 0.948, P=0.0181),达到预设的优效性标准。

PFS

ORR、DCR、DOR
由IRRC评估确认的 A、B、C组的ORR分别为 48.1%、34.8% 和 29.4%。三组的DCR分别为 86.1%、81.6%和75.6%;三组的中位 DoR 分别为8.5个月、7.4个月和5.7个月。三组的3 级及以上治疗期间出现的不良事件发生率分别为 59.5%、46.2% 和 56.9%。
小结:与单独化疗(C组)相比,信迪利单抗+化疗(B组)可显著改善EGFR TKI 治疗进展后EGFR突变非鳞状NSCLC患者的PFS。OS结果尚不成熟,未发现新的不良事件。
晚期免疫治疗
KEYNOTE-189研究
肺癌丨帕博利珠单抗(K药)系列研究汇总
在 III 期 KEYNOTE-189 研究 (NCT02578680)中,无论 PD-L1表达如何,与安慰剂 + 培美曲塞+铂类相比,帕博利珠单抗+培美曲塞+铂类显著改善了既往未经治疗的、EGFR/ALK影像、转移性非鳞状NSCLC 患者的生存期。本次会议报告了5年随访的更新结果。
方法:患者按2:1随机接受帕博利珠单抗 200mg或安慰剂 Q3W,最多35个周期(2年)。所有患者还接受了培美曲塞+卡铂/顺铂4个周期,然后维持培美曲塞直至疾病进展或不可耐受的毒性。疾病进展后允许从安慰剂+培美曲塞+铂类组交叉到帕博利珠单抗单药治疗,主要终点是OS和PFS。
结果:在随机化分组的616例患者(帕博利珠单抗+培美曲塞+铂类,n = 410;安慰剂+培美曲塞+铂类,n = 206)中,从随机化到数据截止(2022年3月8日)的中位时间为64.6个月(范围,60.1-72.4)。116/202(57.4%)接受治疗的患者在研究期间/研究外从安慰剂+培美曲塞+铂类组交叉到抗PD-(L)1治疗。免疫组、安慰剂组中位OS分别为:22.0 vs 10.6个月(HR,0.60;95% CI,0.50-0.72),5年OS率分别为:19.4% vs 11.3%;中位PFS分别为:9.0 vs 4.9个月(HR,0.50;95% CI,0.42-0.60)。在分配治疗≥1剂量的患者中,3-5级AE发生率:295/405(72.8%)vs. 136/202(67.3%)。在完成35个帕博利珠单抗周期的57例患者中,ORR为86.0%(CR,n = 8;PR,n = 41),3年OS率为71.9%。
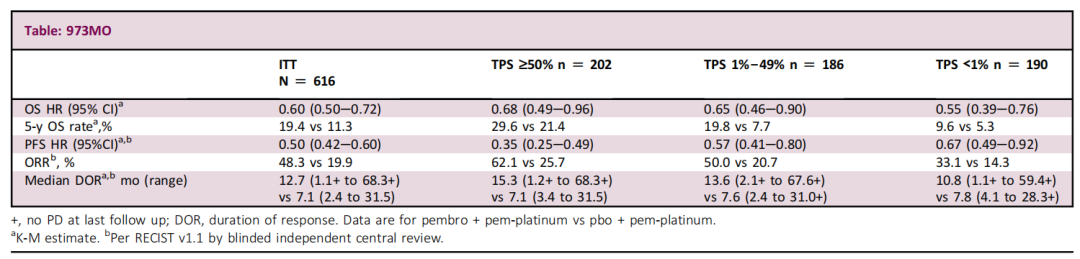
小结:与安慰剂+培美曲塞+铂类相比,无论PD-L1表达如何,一线帕博利珠单抗+培美曲塞+铂类继续显示出OS和PFS获益,且毒性可控。完成35个周期帕博利珠单抗治疗的患者出现持久缓解。这些数据进一步支持帕博利珠单抗联合培美曲塞-铂类化疗作为 EGFR/ALK阴性、转移性非鳞状 NSCLC 的一线标准治疗。
KEYNOTE-407研究
背景:在III期KEYNOTE-407研究(NCT02775435)中,与安慰剂+化疗相比,帕博利珠单抗+铂类为基础的化疗显著延长了既往未经治疗的转移性鳞状NSCLC的患者的OS和PFS。本次会议,研究者报告了ITT人群和完成帕博利珠单抗治疗35个周期(2年)患者的5年结果。
方法:符合纳入标准的患者以1:1的比例随机接受帕博利珠单抗 200mg或安慰剂+卡铂和紫杉醇/白蛋白紫杉醇,Q3W,4个周期,随后接受帕博利珠单抗或安慰剂,最多35个周期。经BICR评估为PD(疾病进展)的患者揭盲后,允许安慰剂+化疗组中的PD患者在研究中交叉接受开放标签≤35周期帕博利珠单抗单药治疗。主要终点为BICR根据RECIST v1.1评估的OS和PFS。
结果:患者被随机分配到帕博利珠单抗+化疗组(n = 278)或安慰剂+化疗组(n = 281)。截至2022年2月23日,从随机化到数据截止的中位时间为56.9个月(范围,49.9-66.2);117例患者从安慰剂+化疗组交叉接受帕博利珠单抗单药治疗,另外26例患者接受随后的抗PD-(L)1治疗;有效交叉率为51.1%。帕博利珠单抗+化疗组、安慰剂+化疗组中位OS分别为:17.2 vs 11.6个月[HR,0.71(95% CI, 0.59–0.85)];5年OS率分别为:18.4% vs 9.7%;3-5级AEs发生率:74.8% vs 70.0%。在完成35个帕博利珠单抗周期的55例患者中,ORR为90.9%,完成35个周期后(随机分组后5年)的3年OS率为69.5%。
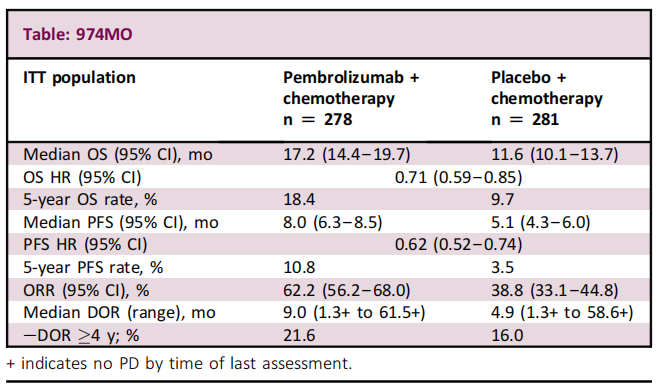
小结:随访5年后,与单独化疗组相比,帕博利珠单抗+化疗组继续显示出更长的OS和PFS,且毒性未增加。大多数完成35个周期的患者都有客观缓解,且在数据截止时仍存活。这些长期数据支持帕博利珠单抗+化疗作为转移性鳞状NSCLC的标准一线治疗选择。
IPSOS研究
IPSOS研究:是一项随机、对照III期临床研究,旨在评估一线阿替利珠单抗 vs. 单药化疗(长春瑞滨或吉西他滨)治疗不符合含铂方案条件的NSCLC患者的疗效和安全性。研究纳入驱动基因阴性、PS较差(≥2)或 70岁以上有并发症不适合接受含铂双药化疗局部晚期/转移性NSCLC患者。主要终点是OS。
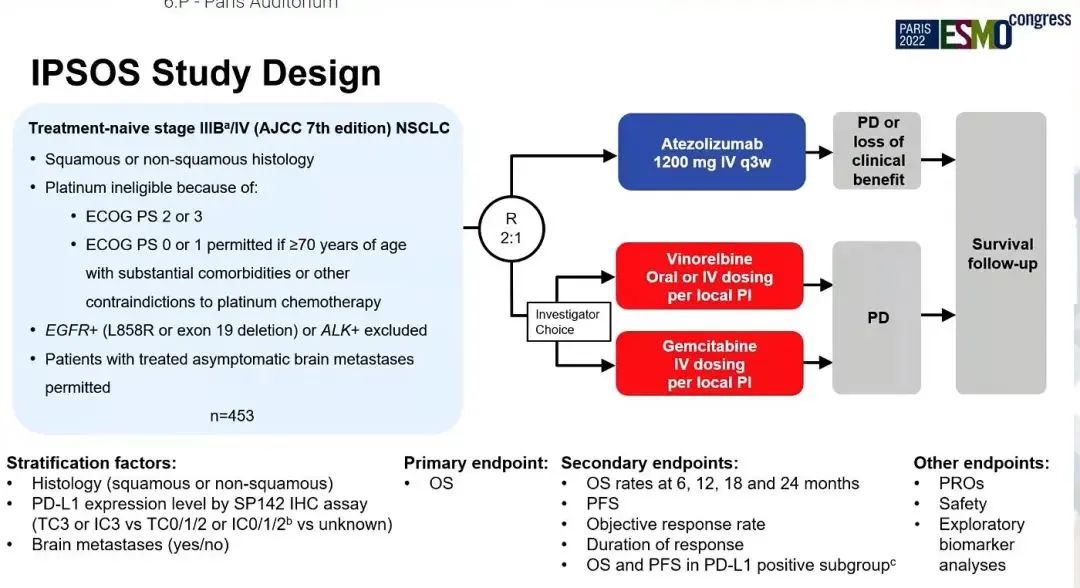
研究结果:纳入453例患者,并被随机分配至阿替利珠单抗组(302例)和化疗组(151例)。中位年龄为75岁(范围,33-94),80岁以上患者占31%,男性占72%,ECOG PS ≥2患者占比83%。2022年4月30日数据截止时,中位随访时间为 41.0 个月,阿替利珠单抗组、化疗组中位OS分别为10.3 vs 9.2个月(HR=0.78;95% CI:0.63,0.97;P=0.028)。在关键亚组中也观察到一致的生存获益,包括PD-L1不同表达水平、不同PS和不同组织学类型亚组。

OS
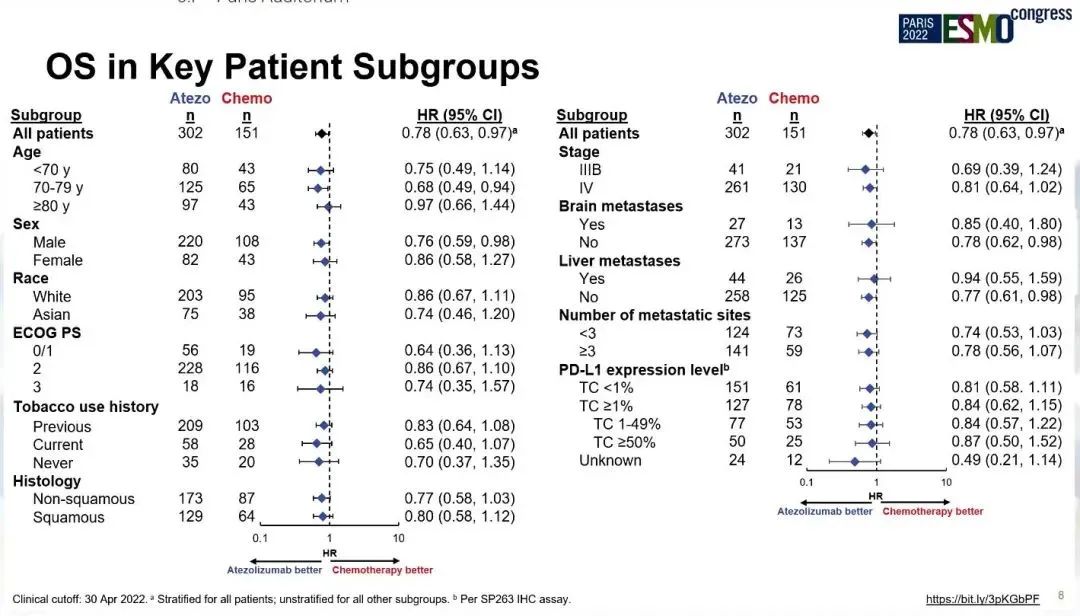
亚组分析
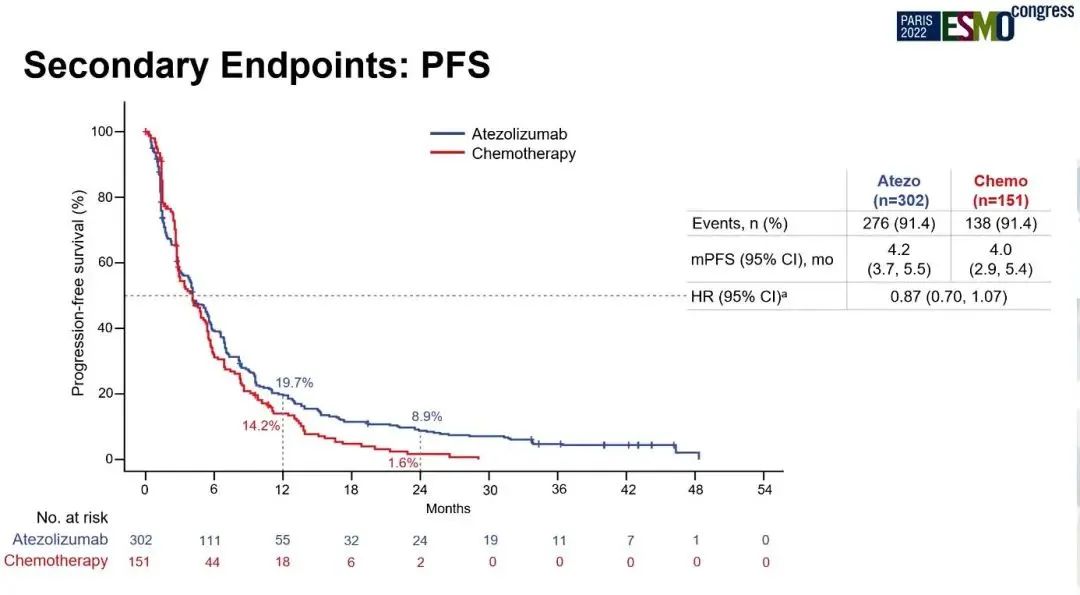
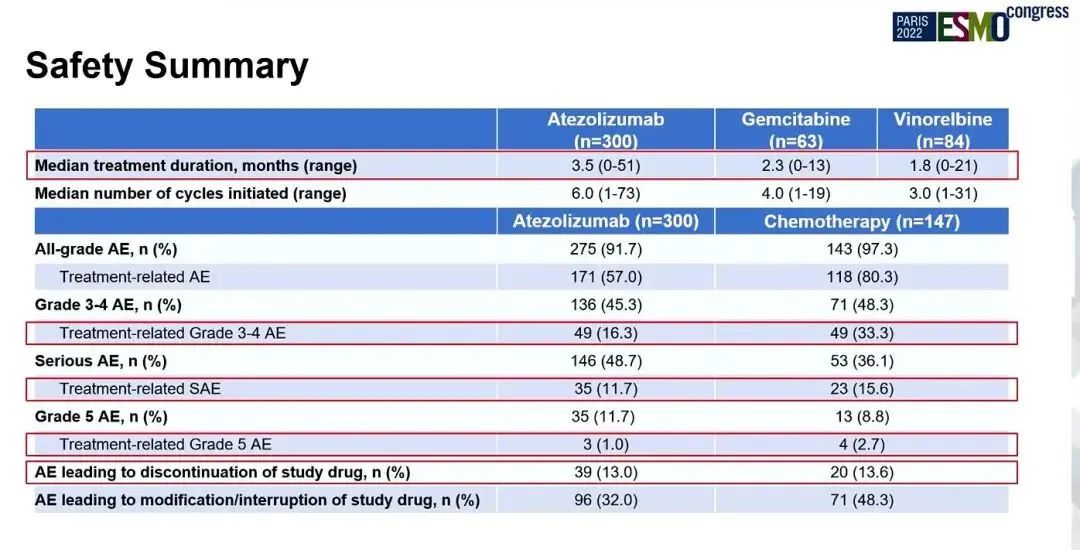
两组ORR分别为16.9% vs 7.9%,DOR分别为14 vs 7.8个月,PFS分别为4.2 vs 4.0个月(HR=0.87;95% CI:0.70,1.07)。阿替利珠单抗组和化疗组3/4治疗相关不良事件(TRAE)发生率分别为16.3%、33.3%,5级TRAE发生率分别为1.0%、2.7%。
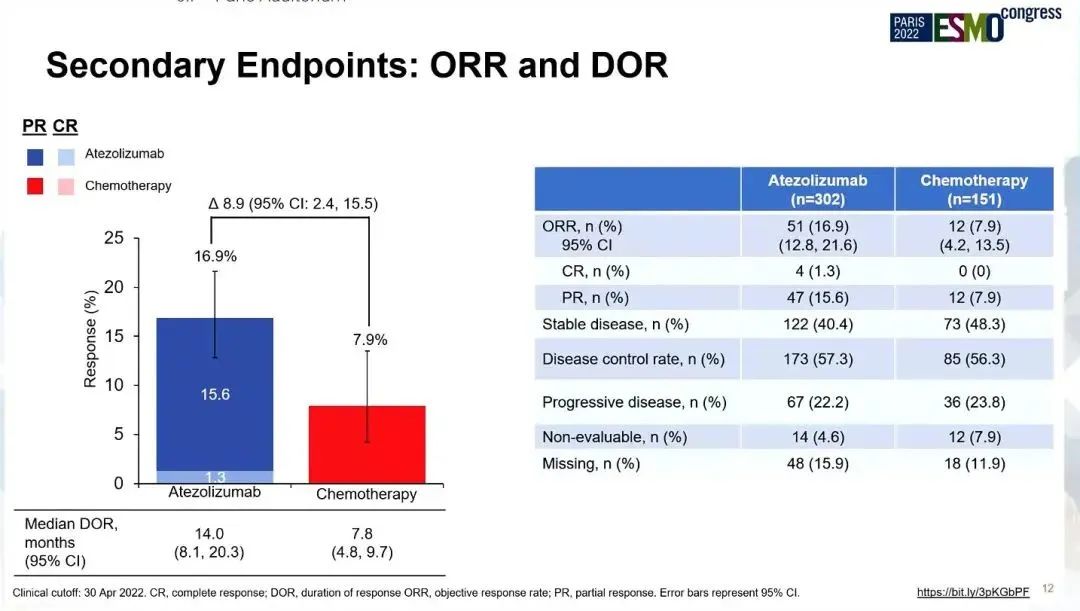
小结:不论组织学类型、PD-L1表达和ECOG PS评分如何,与化疗相比,一线阿替利珠单抗可明显改善不适合铂类患者的OS,推荐单免用于该类人群的治疗。
IFCT-1701研究
背景:对于驱动基因突变阴性的非小细胞肺癌患者,免疫疗法是标准一线治疗。然而,经典的两年免疫持续治疗周期尚缺乏确凿的证据。本研究旨在评估6个月的纳武利尤单抗/伊匹木单抗治疗后,疾病未进展的患者应当继续治疗还是临床观察,6个月免疫治疗的效果是否等同于免疫治疗直至疾病进展。
方法:在这项多中心、非劣效性随机III期试验中,患者的纳入标准为既往未经治疗,年龄>18岁,PS 0-1,组织学证实为IV期NSCLC和具有可测量的病灶。患者接受了纳武利尤单抗3mg/kg q2w+伊匹木单抗1mg/kg q6w,直至疾病进展或不可耐受的毒性。在6个月时,将达到疾病控制且未出现严重 TRAE 的患者随机1:1分组:A 组患者接受免疫持续治疗,B组患者进行临床观察。在疾病进展时,A组患者接受研究者选择的2线含铂化疗,而B组患者重启双免治疗。主要终点是无进展生存期(PFS)。两组将各随机入组450例患者,以达到80%的效能,单边误差值为0.025。鉴于未提交免疫组合方案的欧洲申请,试验委员会决定于2021年1月15日停止试验。
结果:2018年5月-2021年1月,入组265例患者(男性:70.6%;中位年龄:62.7岁;IVB期:60%;SCC:22.3%;PD-L1≥50%:9.9%;PD-L1<1%:12.2%)。137例患者(72.1%)在完成6个月免疫治疗出现疾病进展,11例(5.8%)死亡,29例(15.3%)因TRAEs而无法继续治疗,13例(6.8%)被认为不符合随机分组条件。最终,71例疾病稳定的患者被随机分组。
从随机化开始,中位随访时间为21.0个月,A组的中位PFS为20.8个月(8.3-NR),B组未达到(17.7-NR),A组和B组的12个月PFS率分别为57.1%(39.3-71.5)和77.6%(58.7-88.7)(p=0.09)。校正HR(B组 vs A组)为0.65(95%CI 0.29-1.49,p=0.31)。尚未成熟的OS在两组之间没有显著差异,校正后的HR(B组vs A组)为0.52(95%CI : 0.13-2.12,p=0.36)。3-5级iTRAEs发生率有显著差异。
小结:6个月治疗组和持续治疗组之间PFS无显著差异,由于试验过早终止导致数据不足。
本文作者



本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言