第三批临床急需境外新药名单公布
2020-10-29 医谷网 医谷网
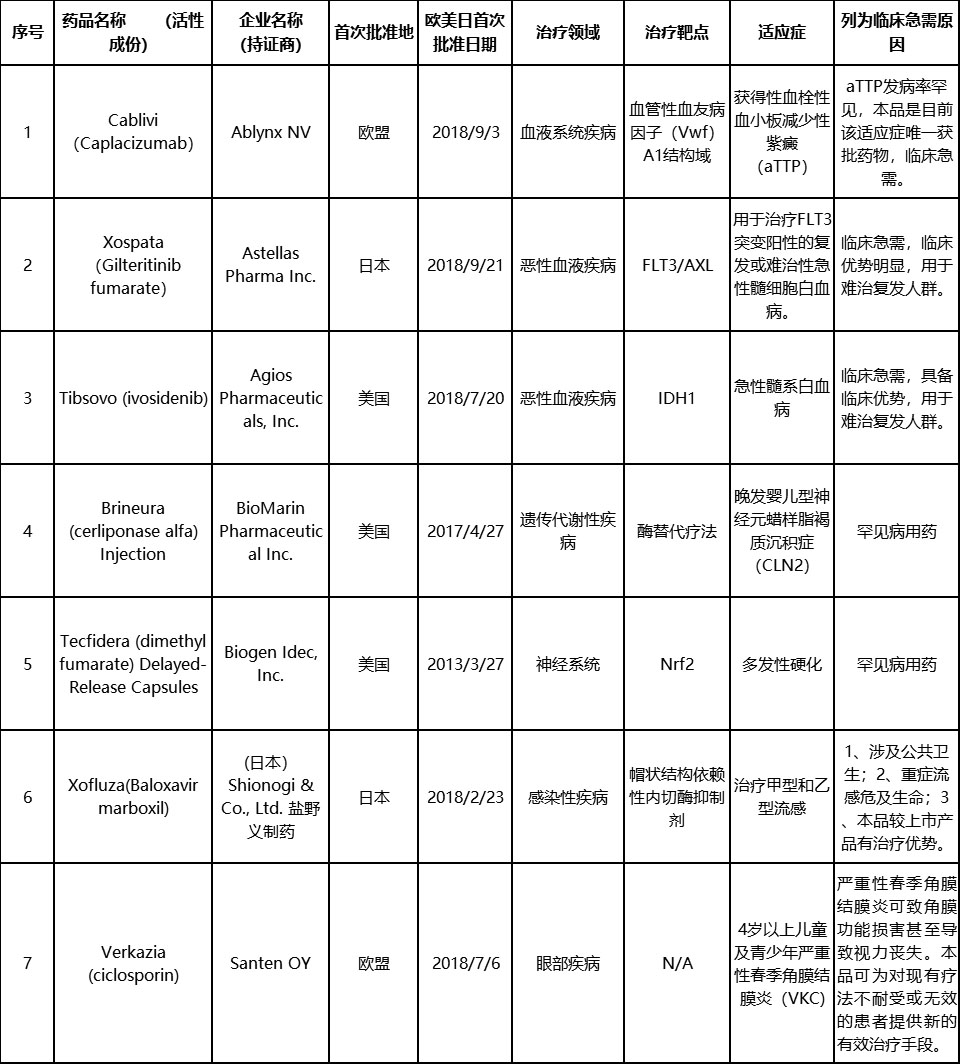
国家药品监督管理局药品审评中心(CDE)官网正式公布了第三批临床急需境外新药的名单,此次名单共纳入了7急需境外新药,针对的适应症包括获得性血栓性血小板减少性紫癜(aTTP)、急性髓系白血病、晚发婴儿型
今日(10月29日),国家药品监督管理局药品审评中心(CDE)官网正式公布了第三批临床急需境外新药的名单,此次名单共纳入了7急需境外新药,针对的适应症包括获得性血栓性血小板减少性紫癜(aTTP)、急性髓系白血病、晚发婴儿型神经元蜡样脂褐质沉积症、多发性硬化、甲型和乙型流感、严重性春季角膜结膜炎等,涉及企业包括安斯泰来、Agios、BioMarin、盐野义、渤健等。
2018年8月,CDE曾发布《关于征求境外已上市临床急需新药名单意见的通知》明确,“临床急需境外新药名单品种”将重点考虑近年来美国、欧盟或日本批准上市我国尚未上市的用于罕见病治疗的新药,以及用于防治严重危及生命或严重影响生活质量的疾病,且尚无有效治疗手段或具有明显临床优势的新药。
同时,《通知》还提出,纳入境外已上市临床急需新药名单的药品,尚未进行申报的或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,国家药品监督管理局将按照优先审评审批程序,加快审评审批。
此外,CDE建立专门通道开展审评,对罕见病治疗药品,在受理后3个月内完成技术审评;对其他境外新药,在受理后6个月内完成技术审评。尚未申报的品种,可随时提出与CDE进行沟通交流,尽快提出上市申请。
此前,CDE已经发布两批临床急需境外新药名单,共计74个药品,其中已有多款已在中国获批,包括西安杨森用于治疗中重度斑块状银屑病的特诺雅?(古塞奇尤单抗注射液)、赛诺菲用于治疗中至重度特应性皮炎。的靶向生物药Dupilumab(Dupixent)、辉瑞用于治疗2岁及以上轻度至重度特应性皮炎患者的特应性皮炎新药克立硼罗软膏(Eucrisa,中国商品名为舒坦明)等。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言