EGFR篇概要
第1代EGFR-TKIs
1. IPASS研究:吉非替尼 vs 化疗,PFS为9.6 vs 6.3个月
2. ENSURE研究:厄洛替尼 vs 化疗,PFS为11.0 vs 5.5个月
3. 一项研究:脑转移,厄洛替尼脉冲治疗
4. CONVINCE研究:埃克替尼 vs 化疗,PFS为11.2 vs 7.9个月
5. INCREASE研究:埃克替尼加量,L858R亚组PFS延长
第2代EGFR-TKIs
6. LUX-LUNG系列研究:阿法替尼延长PFS,具有抗少见突变活性
7. ARCHER 1050研究:达克替尼 vs 吉非替尼,OS分别为34.1 vs. 27.0个月,并且减量不减效
第3代EGFR-TKIs
奥希替尼
8. ADAURA研究:奥希替尼术后辅助治疗,降低了80%的疾病复发或死亡风险
9. AURA3研究:晚期二线,奥希替尼 vs 化疗,PFS分别为10.1 vs 4.4个月
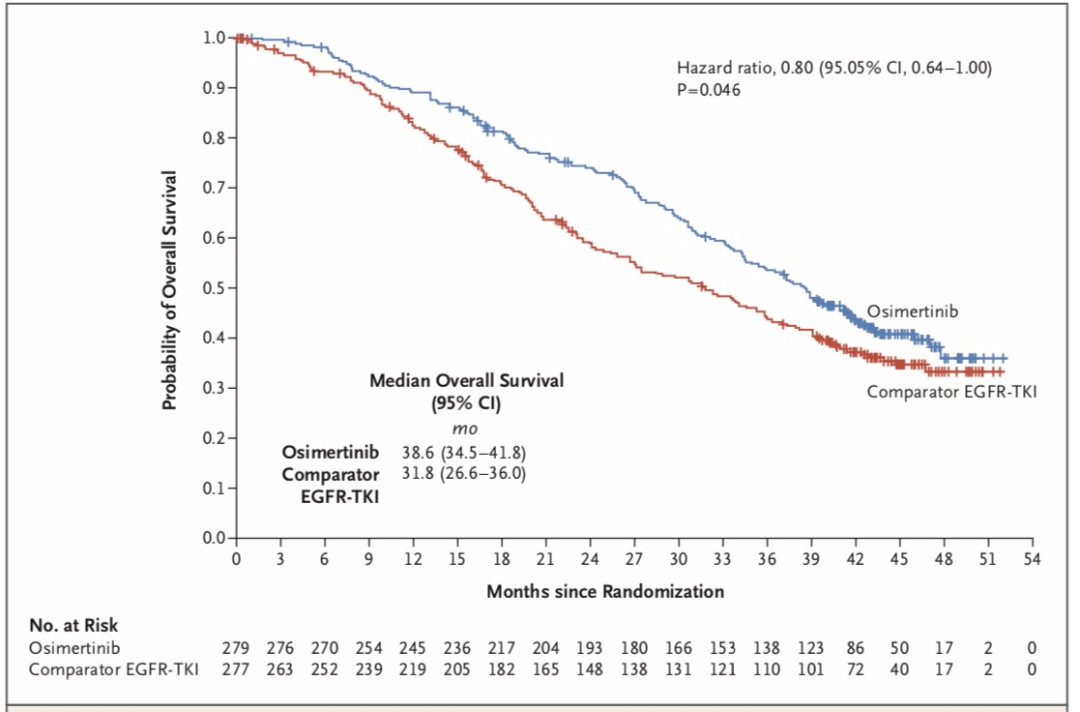
10. FLAURA研究:晚期一线,奥希替尼 vs 一代靶向药,OS分别为38.6 vs 31.8个月
11. 脑转移:AURA3研究、FLAURA研究亚组分析,奥希替尼可显著延长PFS
阿美替尼
12. APOLLO研究:晚期二线,阿美替尼ORR达68.9%,PFS为12.3个月;脑转延长PFS
13. AENEAS研究:一线,III期,阿美替尼 vs 吉非替尼,PFS为19.3 vs 9.9个月
伏美替尼
14. 一项研究:晚期二线,伏美替尼ORR为74.1%,PFS为9.6个月;脑转延长PFS
EGFR-TKIs+抗血管
15. A+T(1代靶向药):RELAY、NEJ026、ARTEMIS研究,A+T延长PFS
16. A+T(奥希替尼):不论一线、还是二线,均不能明显延长PFS
EGFR-TKIs+化疗
17. JMIT研究:吉非替尼+化疗 vs 吉非替尼,PFS为15.8 vs 10.9 个月
18. NEJ009研究:吉非替尼+化疗 vs 吉非替尼,OS为52.5 vs 38.8个月
19. NEJ032A研究:奥希替尼+化疗 vs 奥希替尼,PFS为14.6 vs 15.8个月
耐药治疗策略
20. 详见正文
第1代EGFR-TKIs
第2代EGFR-TKIs
ARCHER 1050是一项全球多中心、随机、开放性的Ⅲ期临床研究,旨在比较达可替尼与吉非替尼一线治疗EGFR敏感突变晚期NSCLC患者的疗效和安全性。第二代的EGFR TKI达可替尼是一种泛HER(EGFR/HER1、HER2和HER4)抑制剂,可选择性、不可逆地与其HER家族受体靶点结合,提供长效抑制作用。

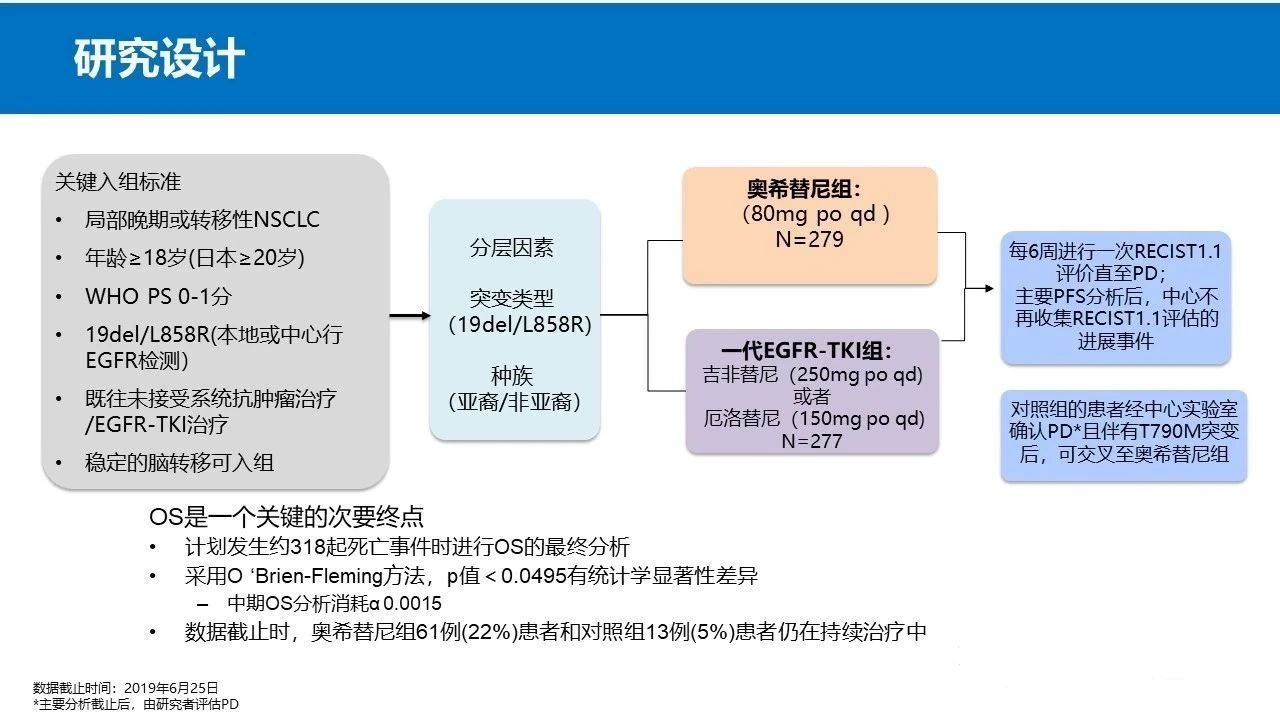
研究设计(脑转排除)
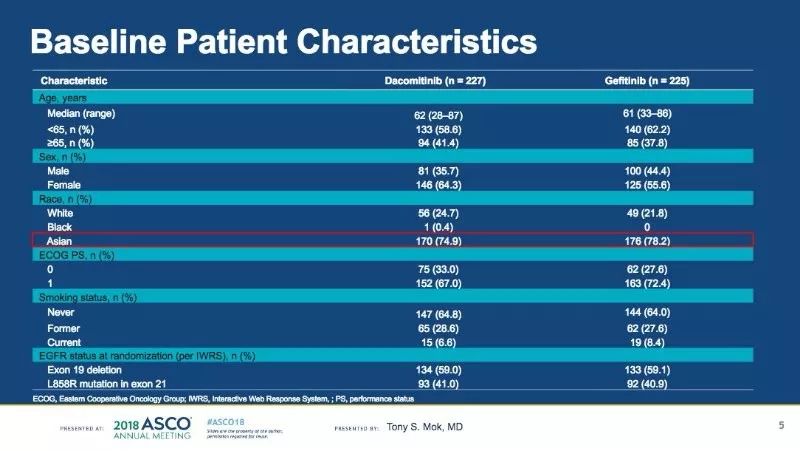
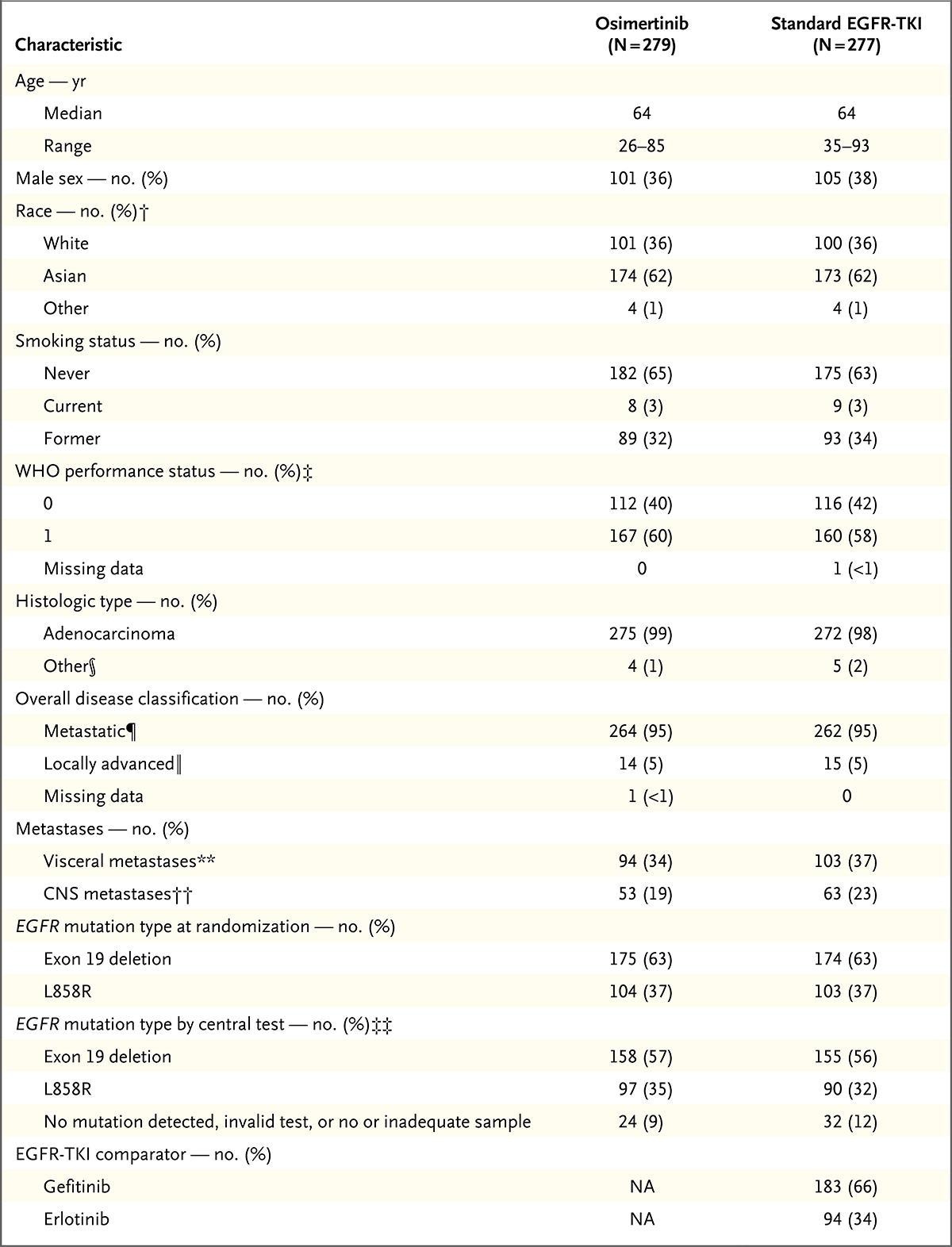
患者基线特征
2018年美国临床肿瘤学会(ASCO)年会公布的ARCHER 1050研究数据显示,相比吉非替尼组,达可替尼组在无进展生存期(PFS)和OS上均有延长[1],达可替尼成为首个提供临床意义OS改善的EGFR TKI。基于ARCHER 1050研究结果,达可替尼在全球陆续上市,2019年5月同样获批再国内上市。
2019年ESMO Asia大会上,经过47.9个月的随访后,ARCHER 1050研究的OS数据更新[2]。达可替尼组和吉非替尼组OS分别为:34.1个月 vs. 27.0个月。在亚洲患者中,两组的中位OS分别为:37.7个月vs. 29.1个月,提升了8.6个月(双侧检验P=0.0457)。

总人群OS
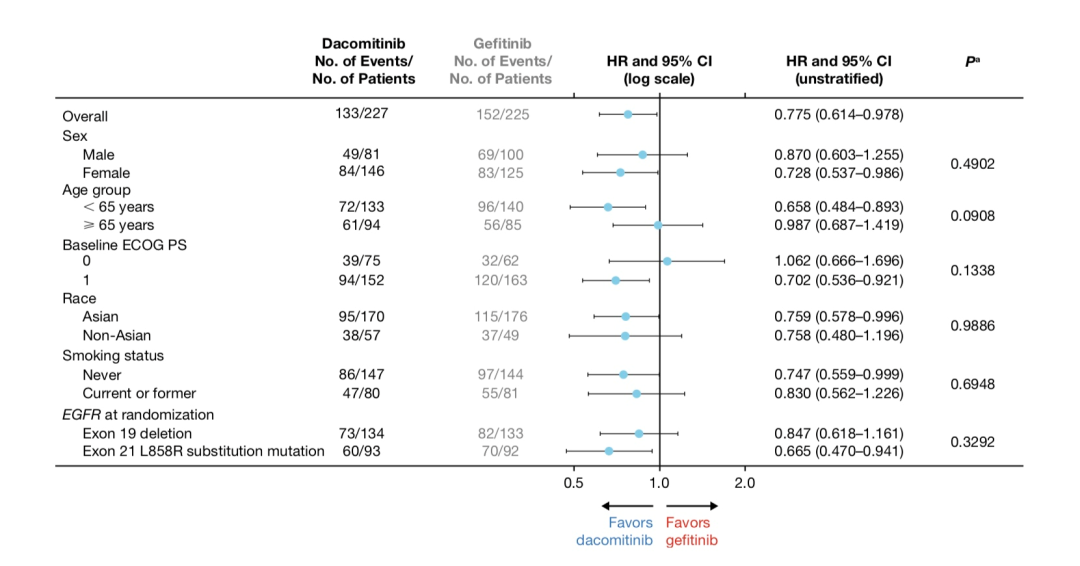
亚组分析
根据患者基因突变类型进行分析,19del突变患者中,达可替尼组和吉非替尼组的中位OS分别36.7个月 vs. 30.8个月;21 L858R突变患者中,两组中位OS分别为32.5个月vs. 23.2个月。除此之外,研究还发现,达可替尼剂量降低后,并不影响患者的OS获益。
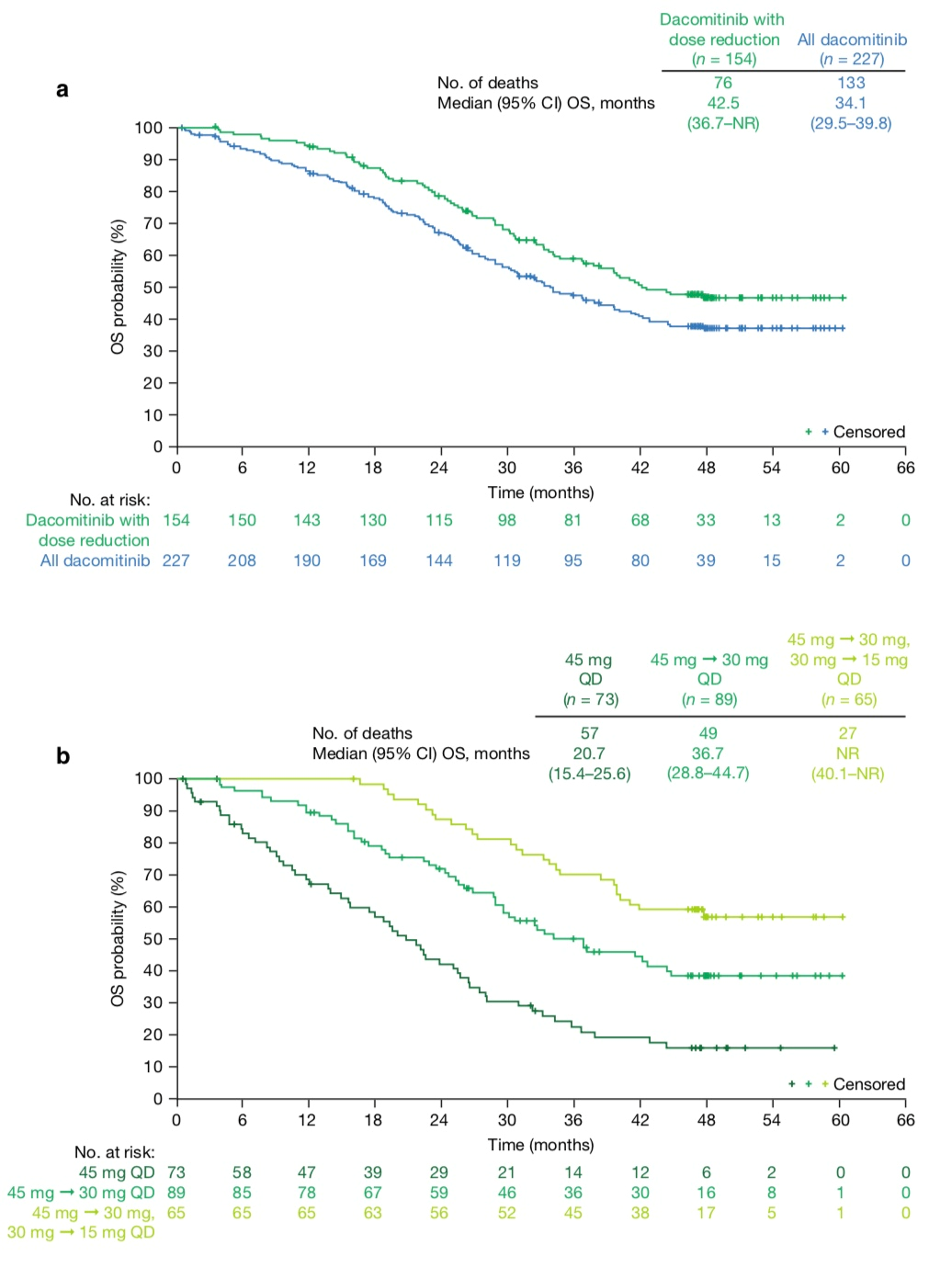
剂量减少vs亚洲人群OS
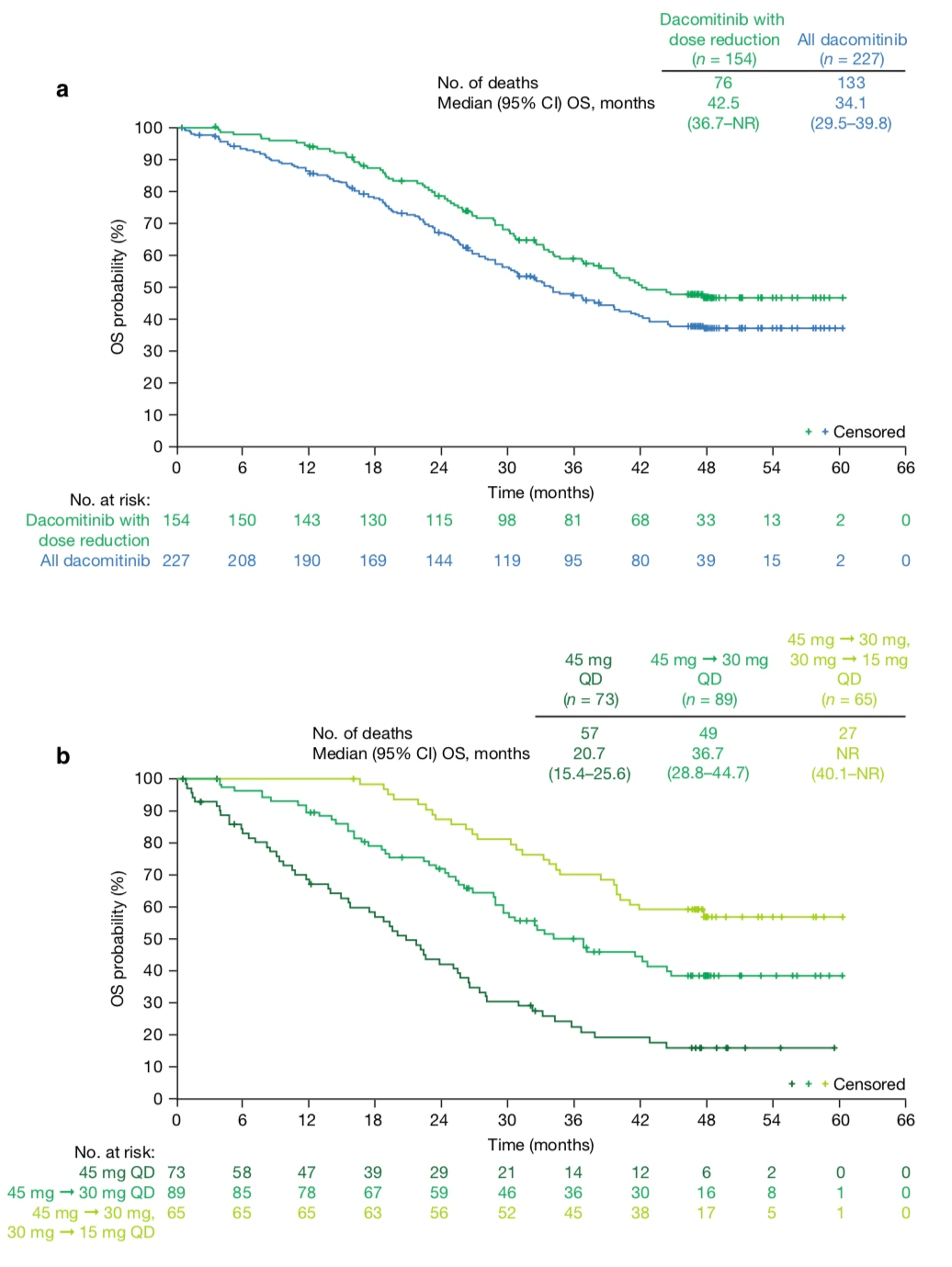
各剂量水平患者OS
2021年,Lung Cancer 公布了III期ARCHER 1050研究的更新结果[3]:在中国人群中,达可替尼相对于吉非替尼,两组ORR分别为77.1% vs. 72.7%,PFS分别为16个月 vs. 9.2个月,OS分别为32.5个月和24.9个月,与研究总体人群、亚洲人群有一致的OS获益。
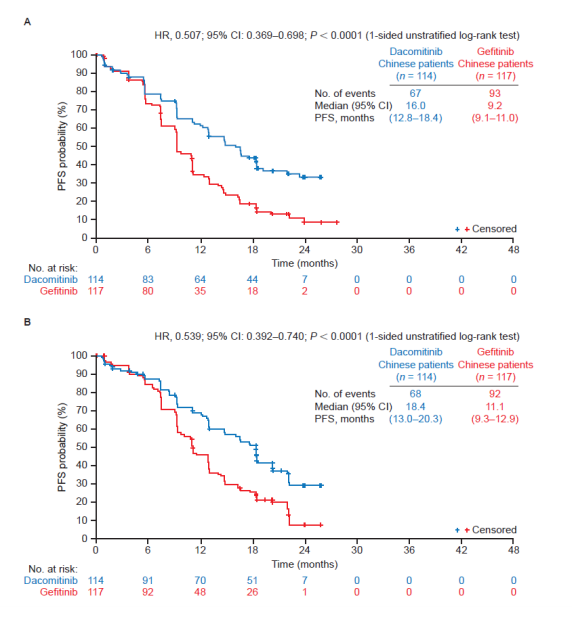
IRC评估的PFS
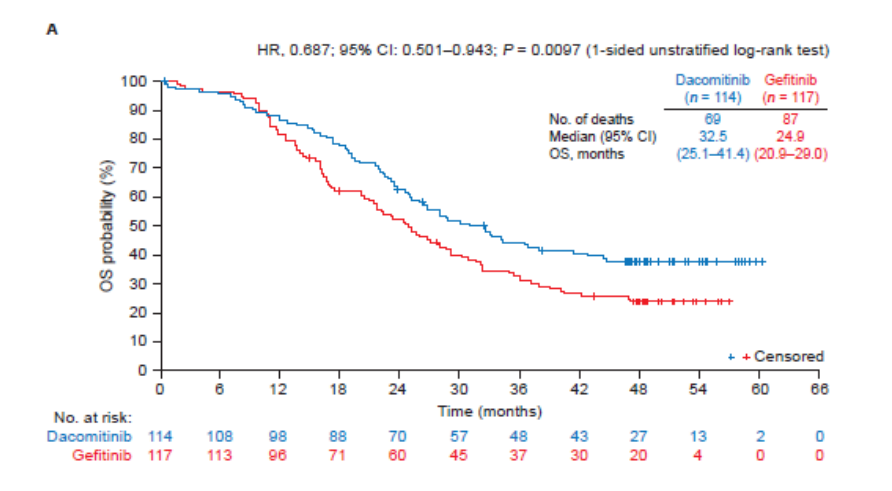
中国人群OS
根据患者基因突变类型进行分析,19del突变患者中,达可替尼组和吉非替尼组的中位OS分别33.2个月 vs. 25.9个月;21 L858R突变患者中,两组中位OS分别为26.7个月vs. 23.2个月。
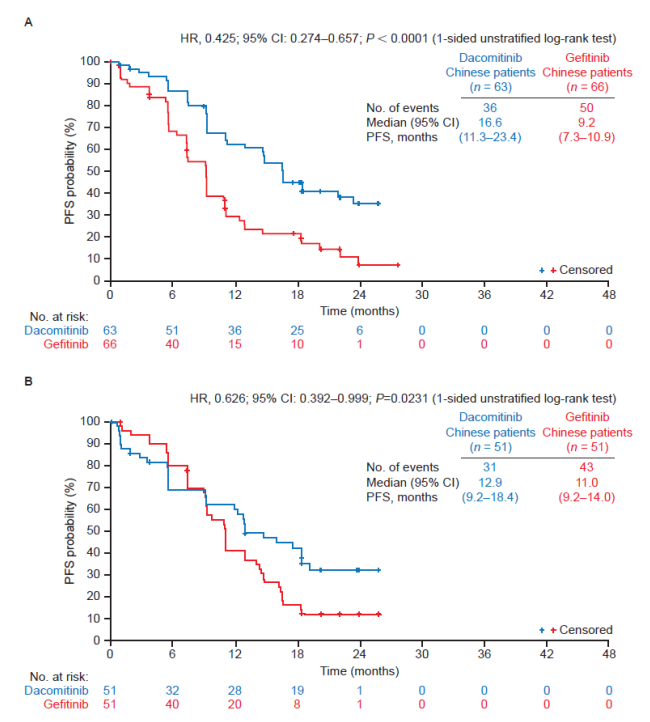
中国人群PFS:19del(上),L858R(下)
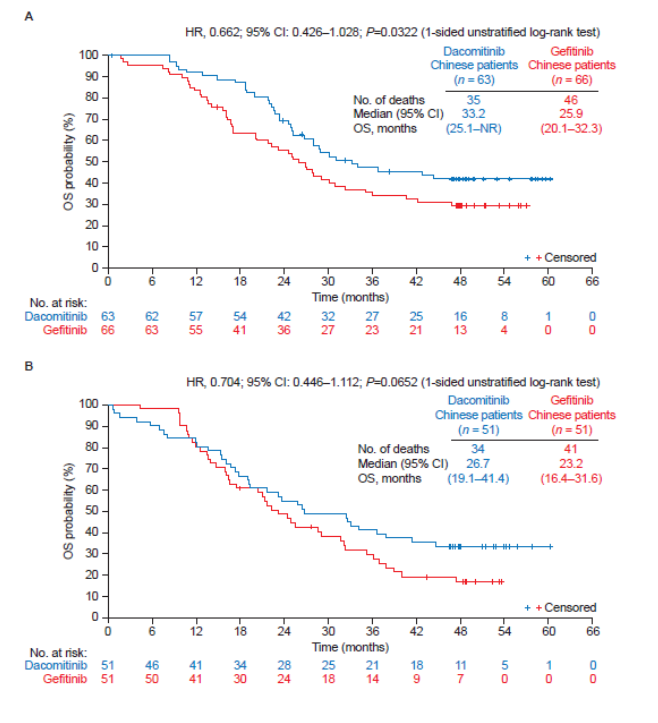 中国人群OS:19del(上),L858R(下)
中国人群OS:19del(上),L858R(下)
第3代EGFR-TKIs
NSCLC丨EGFR-TKI吹响早期NSCLC辅助治疗的号角,临床准备好了吗?
NSCLC|奥希替尼再获新适应症:FDA批准首个NSCLC术后辅助靶向疗法!
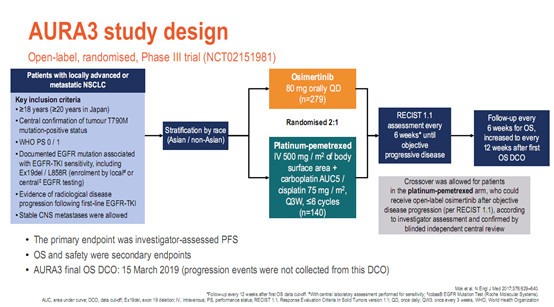
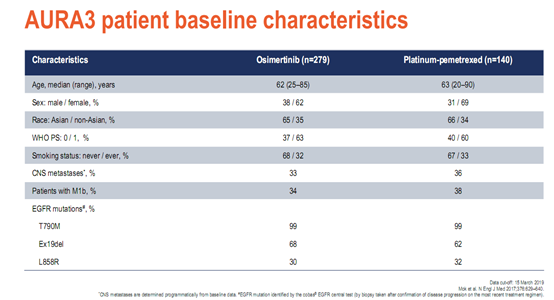
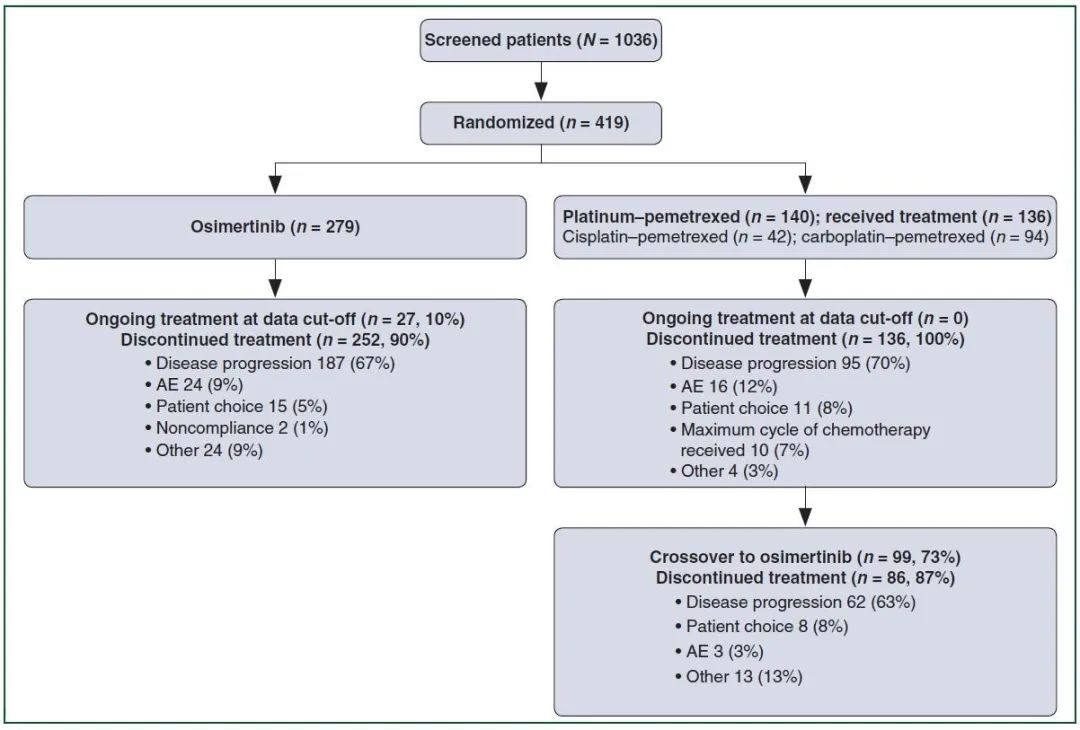
既往已发表的AURA3结果报告显示[5],奥希替尼组、化疗组中位PFS(10.1个月vs 4.4个月),ORR(71% vs 31%),144例CNS转移中位PFS(8.5个月vs 4.2个月),ADR(23% vs47%)。
2020年《Ann Oncol》发布最终OS,两组中位随访时间分别为23.5个月和20.3个月。奥希替尼组和化疗组的中位OS分别为26.8个月和22.5个月,HR=0.87,P=0.277,差异无统计学意义。两组12个月OS率分别为83%和78%,24个月OS率分别为55%和43%,36%个月OS率分别为37%和30%(图2)。
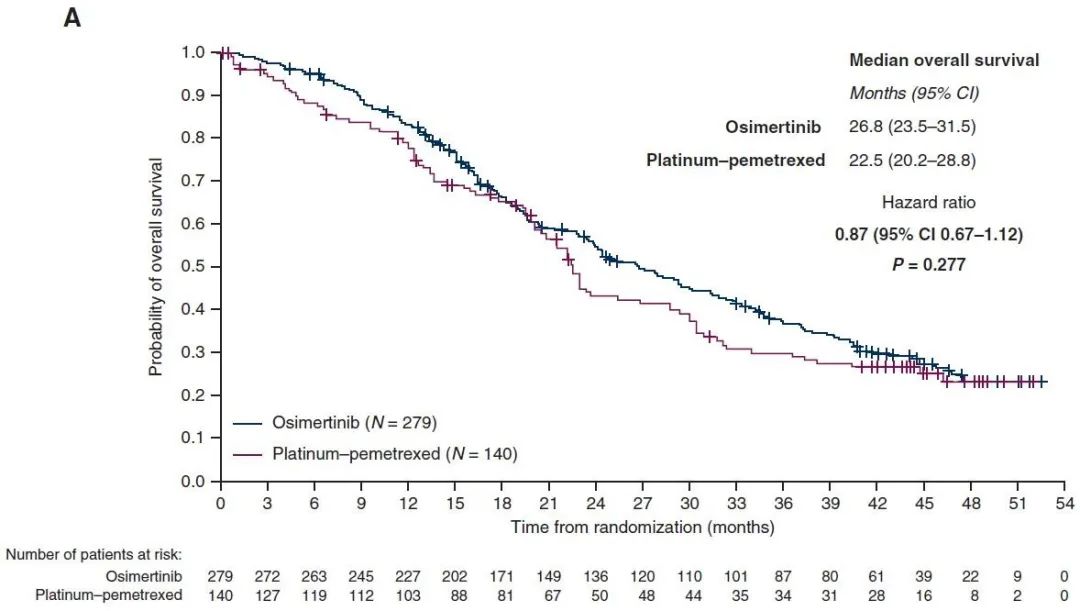
两组的OS分析
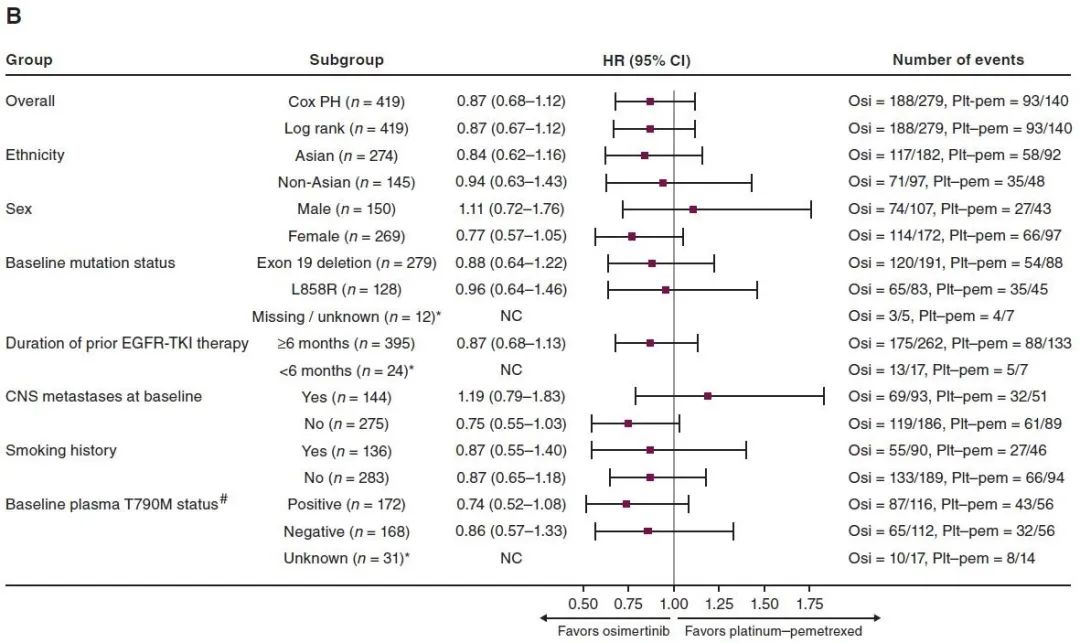
OS的亚组分析
亚组分析:在绝大多数亚组中,奥希替尼展示了更好的疗效,但在男性以及基线有中枢神经系统转移的亚组中,率先接受化疗展现出了更好的获益趋势。基于外周血分析发现,外周血T790M突变阴性患者的中位OS为34.9个月,在数值上优于阳性患者的23.9个月。对交叉效应进行校正后,两组的OS分别为26.8个月和15.9个月。
安全性:安全性分析结果与既往报道一致,未出现新的安全性信号。两组分别有85%和89%的患者出现不良反应,其中3度以上不良反应发生率分别为9%和34%。奥希替尼组间质性肺疾病以及肺炎的发生率分别为2%和3%,其中分别有1%和2%的间质性肺疾病以及肺炎考虑和研究药物有关。两组分别有4%和1%的患者,因不良反应导致死亡。

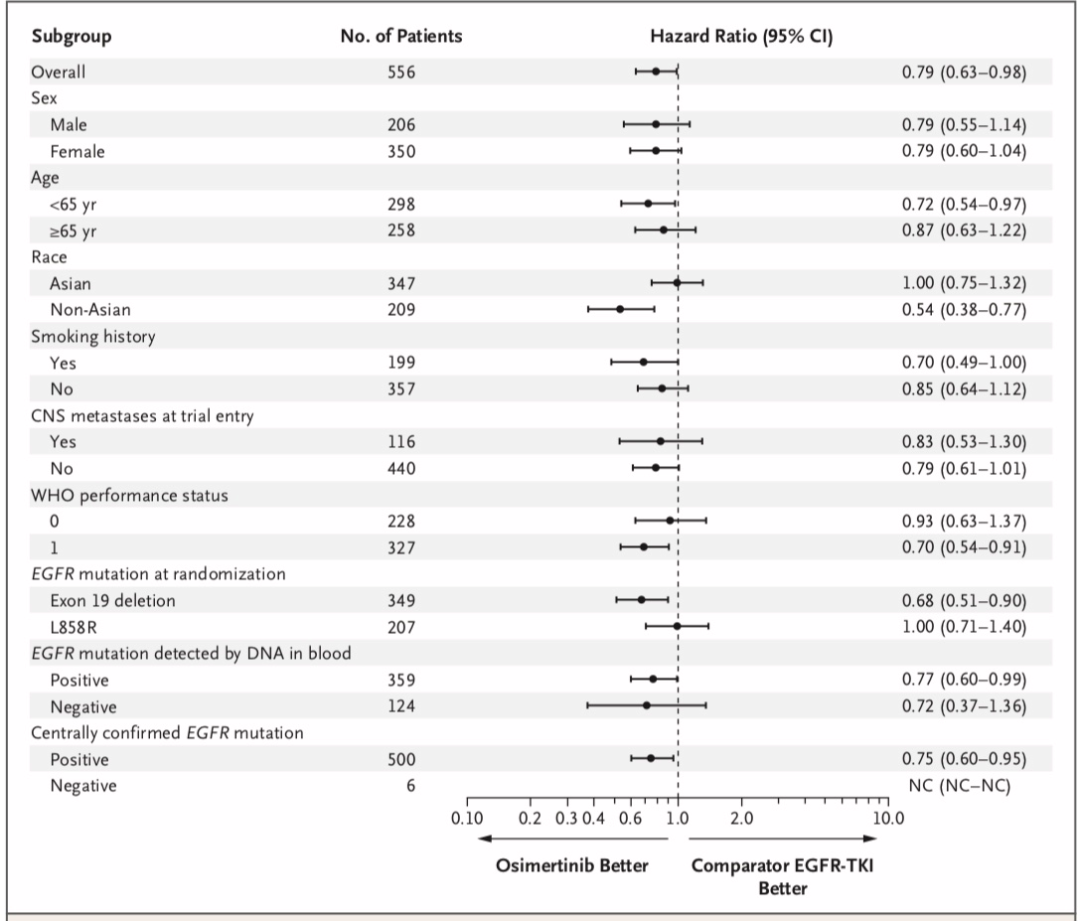
亚组分析
重磅丨国产三代EGFR-TKI阿美替尼,惊艳疗效亮相AACR
AENEAS研究:是一项评价阿美替尼作为一线治疗方案疗效和安全性的多中心、随机、双盲Ⅲ期研究。研究入组429例携带EGFR 19外显子缺失或L858R突变的晚期NSCLC患者,1:1随机接受阿美替尼或吉非替尼治疗,治疗直至疾病进展或毒性不可耐受。研究主要终点为PFS,次要终点包括总生存(OS),客观缓解率(ORR),反应持续时间(DoR)和安全性。
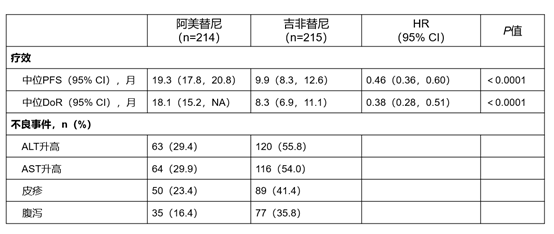
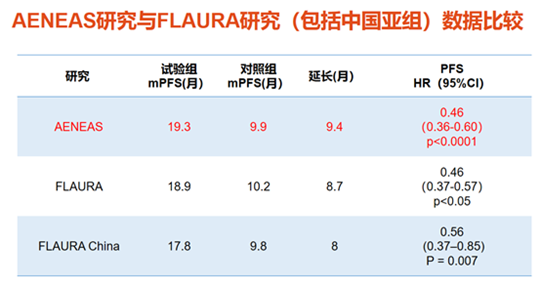
图3并非头对头研究数据对比,仅供参考
研究结果:与吉非替尼相比,使用阿美替尼作为一线治疗的患者,无进展生存期(PFS)及持续缓解时间(DoR)均显著延长——mPFS 19.3个月 vs 9.9个月(HR 0.46 , p<0.0001),mDoR 18.1个月 vs 8.3个月(HR 0.38 , p<0.0001)。
安全性方面,尽管阿美替尼组治疗持续时间更长(中位用药时间 463天 vs 254天),但是皮疹、腹泻、AST/ALT升高和治疗相关严重不良事件(4.2% vs 11.2%)发生率更低。(2021ASCO,9013)
2020年美国临床肿瘤学会(ASCO)年会公布了伏美替尼Ⅱb期研究结果[8],伏美替尼治疗EGFR T790M突变阳性局部晚期或转移性NSCLC的肿瘤客观缓解率(ORR)为74.1%,疾病控制率(DCR) 为93.6%,无疾病进展生存期(PFS)为9.6个月, 而且对于预后生存不佳的脑转移NSCLC也显示较强的疗效。
在今年召开的第21届世界肺癌大会 (World Conference on Lung Cancer, WCLC 2020)上,公布了伏美替尼治疗CNS转移NSCLC的分析结果[9]。该结果来自于伏美替尼治疗EGFR T790M突变阳性局部晚期或转移性NSCLC的I-II期剂量扩展研究。结果显示,80mg伏美替尼治疗CNS转移NSCLC患者的CNS ORR为60.0%,160mg 伏美替尼治疗CNS转移NSCLC患者的CNS ORR为84.6%,DCR为100%。
不同剂量组CNS转移患者疗效结果(数据截止日期:2020-01-29)
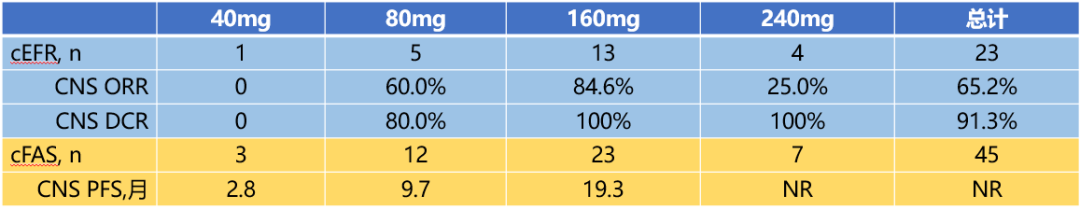
在安全性方面,伏美替尼治疗组有26%的患者观察到≥3级不良事件(AE),其中11%为治疗相关,各单项≥3级治疗相关不良事件均不高于1%;治疗相关腹泻和皮疹发生率较低,分别为5%和7%,且均为1~2级。最常见≥3级治疗相关的不良反应主要为谷草转氨酶升高(1%)、谷丙转氨酶升高(1%)、γ谷氨酰转肽酶升高(1%),未发现预期外的特殊不良事件。
2021年3月3日,国家药监局基于上述研究结果附条件批准了伏美替尼用于治疗既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
EGFR-TKIs+抗血管
肺癌丨EGFR突变,奥希替尼联合抗血管治疗无优势
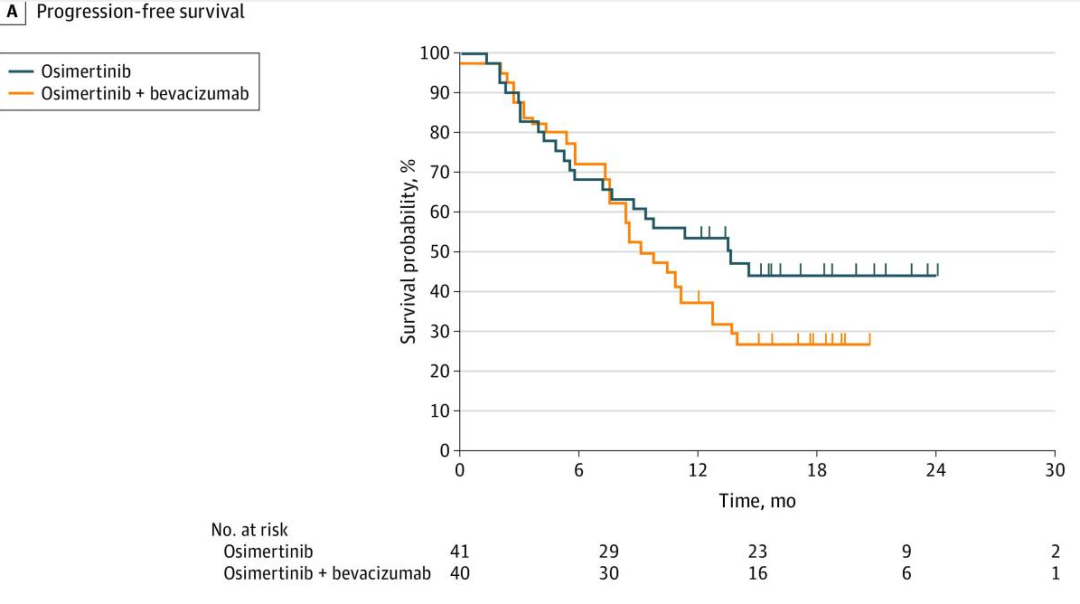
PFS
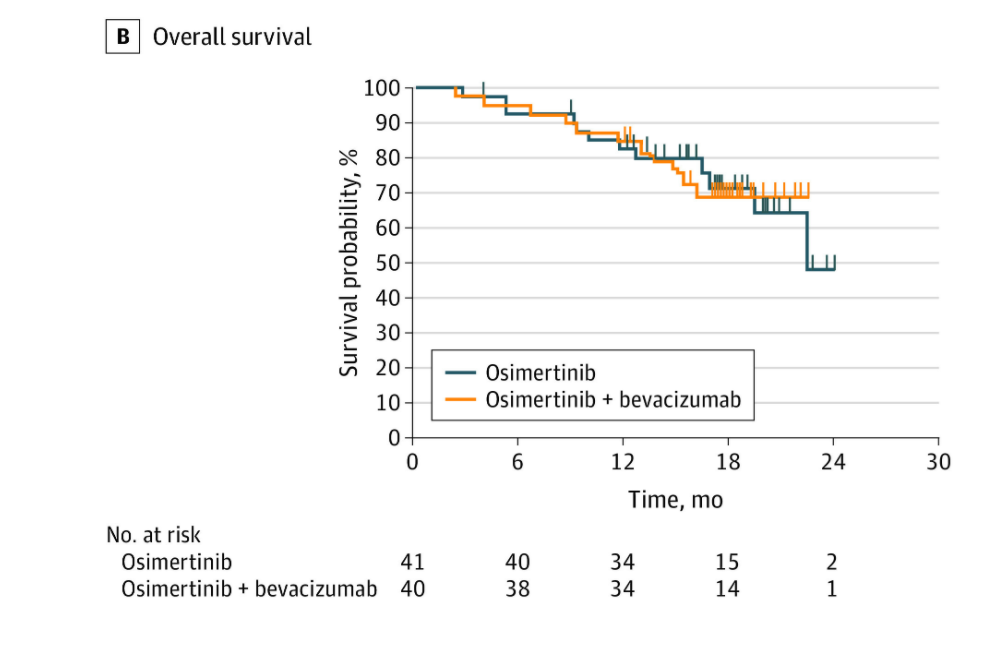
OS
研究结果:PFS(奥希替尼+贝伐珠单抗 vs 奥希替尼):15.4个月 vs 12.3个月,HR=0.96,95% CI 0.68-1.37,P=0.83;mOS:24.0个月 vs 24.3个月,HR=1.03,95% CI 0.67-1.56,P=0.91;ORR:55% vs 55%。亚组分析:吸烟史与治疗的PFS和OS显著相关(校正P=0.0052和0.029);≥3级治疗相关AEs:47% vs 18%。结果显示奥希替尼联合贝伐珠单抗二线治疗EGFR(敏感突变合并T790M突变)晚期NSCLC患者不能延长OS和PFS。
EGFR-TKIs+化疗

研究设计
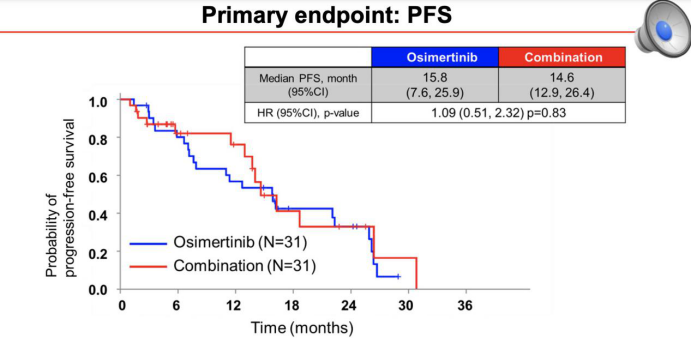
PFS
从现有的数据看,晚期NSCLC患者的联合治疗策略似乎并不适用于奥希替尼;在术后辅助治疗领域,联合化疗似乎更好,但还需要等待NeoADAURA研究给出确认性结论。虽然一代EGFR-TKI联合化疗及抗血管生成治疗得到了众多II期及III期临床研究数据的支持,但目前,三代药物奥希替尼为基础的联合治疗策略并未得到显著的阳性结果。所以,如果考虑联合治疗,目前一代药物的可能还是首选。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









很实用
28
#GFR#
40