盘点全球已上市的8种CAR-T细胞治疗
2022-09-14 找药宝典 找药宝典
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。近些年来,随着生物医学发展,这种新型疗法也逐渐成为备受关注的对
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。近些年来,随着生物医学发展,这种新型疗法也逐渐成为备受关注的对象,该疗法在血液肿瘤领域被认为是最具有前景的治疗方法之一。去年,一则关于天价CAR-T产品120万1针的阿基仑赛注射液新闻也曾引起过轰动。那么CAR-T疗法到底是什么?现在又有哪些已经上市的药物呢?
CAR-T疗法
CAR-T是一种过继性细胞治疗方法,其概念最早于1989年被提出。CAR-T疗法通过基因工程技术,将患者外周血T细胞在体外修饰,赋予T细胞靶向识别肿瘤细胞表面抗原,并经过体外扩增培养,最终回输到患者体内以达到杀伤肿瘤的方法。目前CAR-T疗法主要运用于非实体肿瘤,对于实体瘤的效果有限。
CAR结构
CAR结构即嵌合抗原受体结构,主要包括3个组成部分:细胞外抗原识别结构域、跨膜结构域和细胞质信号结构域。细胞外抗原识别结构域一般是肿瘤抗原反应性抗体的单链可变片段(single-chain variable fragment,scFv),负责提供靶向抗原特异性。CAR的scFv对抗原识别不需要在MHC分子中进行抗原加工和肽表位提呈,这使得其靶向作用更为优秀。
目前的CAR结构已经经历了五代的演变,其各自具有不同的优缺点。第一代CAR结构以TCR结构和抗体作为基础,将三硝基苯基抗体的可变区域与TCR恒定区相融合表达,该结构能使MHC非限制性识别杀伤靶细胞并分泌IL-2,具有体外肿瘤杀伤的优势,但其扩增能力及体内持续时间有限,无法完全清除肿瘤细胞。第二代CAR结构在第一代的基础上增加了1个共刺激分子,不仅保留了第一代T细胞活化的经典信号,同时使CAR-T细胞的活化水平与增殖能力得到了显著提升,使得肿瘤患者的肿瘤负荷能够获得长期有效的控制,目前在临床上应用最为广泛的也是第二代CAR结构。第三代CAR结构则是在二代基础上再增加1个共刺激分子,共刺激分子可以激活T细胞内的JNK、ERK、NF-κB等信号通路,提高细胞毒性并延长抗肿瘤活性。第四代CAR则增加了可选择性的标记及启动子,又称通用细胞因子介导杀伤的T细胞,这些分子具有不同作用,或可以促进T细胞增殖,或可以提升T细胞效应能力,或可以趋化免疫细胞。第五代仍在广泛开发中,其作为抗免疫排异及移植物抗宿主病的通用型CAR-T。
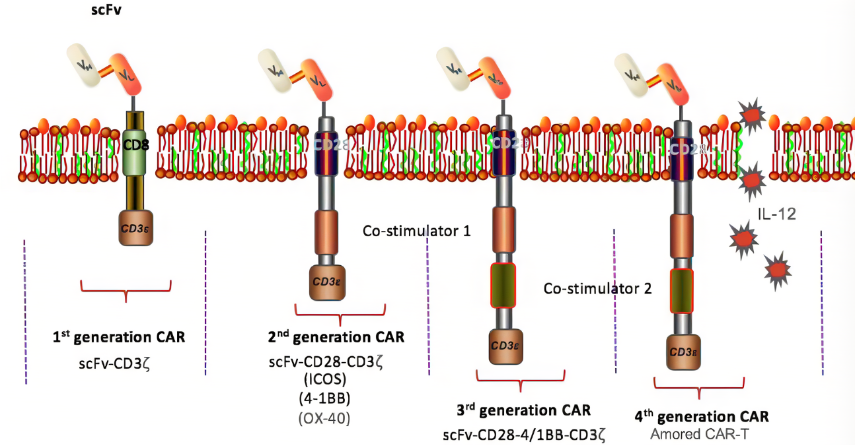
(图片来源:生物器材网)
CAR疗法
2017年,由诺华研发的CAR-T细胞疗法Kymirah被美国FDA批准上市,这是全球首个获批的CAR-T细胞疗法。至此之后,先后由七款药物上市,治疗范围主要在于血液系统肿瘤,涵盖包括B细胞急性淋巴细胞白血病、复发或难治性滤泡瘤、复发或多发性骨髓瘤等。
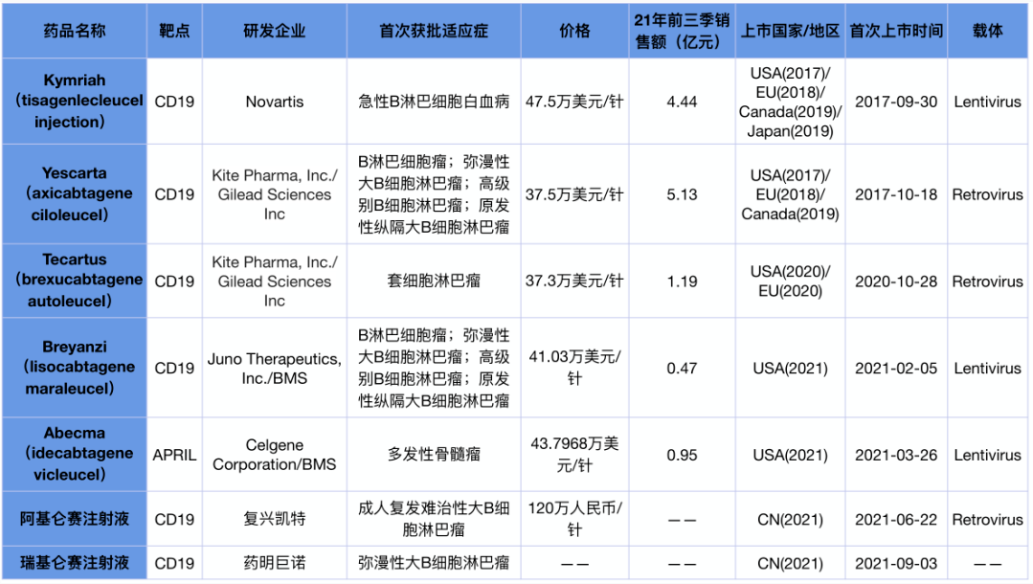
(图片来源于网络)
1.Kymirah(Tisagenlecleucel)
全球首个上市的CAR-T细胞疗法,被FDA批准用于治疗25岁以下、难治性或两次或多次复发的B细胞前体急性淋巴细胞白血病(B-ALL)患者。Kymirah靶向CD19,这也是目前被认为对于ALL最为有效的靶点。该疗法的批准是基于一项全球多中心的单臂II期ELIANA研究,63名接受疗效评估的患者中显示83%(52/63;95%CI:71%-91%)在接受输注的三个月内达到了完全缓解(CR)或显示血细胞计数未完全恢复的CR(CRi)。2018年又获批用于治疗先前接受过两次或以上的系统治疗的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的成人患者。
2.Yescarta(Axicabtagene)
2017年10月18日,FDA批准吉利德的Yescarta用于既往接受二线或多线系统治疗的复发性或难治性大B细胞淋巴瘤(LBCL)成人患者的治疗,包括弥漫性大B细胞淋巴瘤(DLBCL)、原发纵膈大B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤(HGBL),以及源于滤泡性淋巴瘤(FL)的DLBCL。该药物靶向CD19,其获批源于ZUMA-1临床试验,验证了101名患者中72%的总缓解率以及尚可控的不良反应。
3.Tecartus(Brexucabtagene Autoleucel)
同由吉利德研发的Tecartus也是靶向CD19的CAR-T细胞疗法,被批准治疗复发/难治性套细胞淋巴瘤(MCL)成人患者,此外还获批用于治疗复发或难治性B细胞急性淋巴细胞白血病(B-ALL)成年患者。两项适应症的获批分别基于ZUMA-2和ZUMA-3临床试验,18岁以上的MCL成人患者和复发或难治性B-ALL成人患者都取得了令人满意的缓解率。
4.Abecma(Idecabtagene Vicleucel)
由BMS与蓝鸟生物联合研发的Abecma于2021年3月被FDA批准用于治疗复发性/难治性多发性骨髓瘤(R/R MM)成人患者(既往接受过4种或更多种疗法,包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)。该药物靶向B细胞成熟抗原(BCMA),BCMA普遍表达于多发性骨髓瘤癌细胞。在关键性Karmma试验中,在接受单次注射后,72%患者获得了持久的缓解,此外,该药物具有良好的安全性,细胞因子释放综合征(CRS)和神经系统毒性(NT)的发生可控且低级别。
5.Breyanzi(Lisocabtagene Maraleucel,liso-cel)
2021年FDA批准用于治疗复发或难治性大B细胞淋巴瘤(R/R LBCL)成人患者(先前已接受过2种或2种以上系统疗法),包括未另行说明的弥漫性大B细胞淋巴瘤(包括由惰性淋巴瘤引起的弥漫性大B细胞淋巴瘤)、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和滤泡性3B淋巴瘤。Breyanzi是一种CD19导向的CAR-T细胞疗法,被FDA授予孤儿药、再生医学先进疗法和突破性疗法的称号。
6.奕凯达(阿基仑赛注射液)
奕凯达是我国首个获批上市的CAR-T细胞疗法,由复星凯特引进美国Kite的Yescarta进行技术转移并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品,也是当初引起轰动的一针120万的“肿瘤神药”。该药物获批用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤(r/r LBCL)成人患者。复星凯特开展的一项单臂、开放性、多中心桥接临床研究数据证明奕凯达与Yescarta安全性与有效性数据高度相似,也因此获得NMPA批准上市。
7.倍诺达(瑞基奥仑赛注射液)
倍诺达是首款我国独立自主开发的CAR-T细胞疗法,由药明巨诺研发,目前唯一同时获得“重大新药创制”专项、优先审评和突破性治疗药物三项殊荣的已获批CAR-T产品。2021年9月6日,NMPA批准用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。该药物也靶向CD19,其获批基于单臂、多中心、关键性研究(RELIANCE研究)的结果,入组了28例接受了包括CD20靶向药物和蒽环类药物的至少二线治疗后失败的r/r FL患者,在27例可评估有效性的患者中,3个月完全缓解率(CRR)和客观缓解率(ORR)分别为85.19%及100%,最佳完全缓解率和客观缓解率分别为92.6%及100%;在28例接受治疗的患者中,任何级别的细胞因子释放综合征(CRS)及神经毒性(NT)的发生率分别为42.9%及17.9%,≥3级CRS和NT的发生率分别为0%及3.6%。其显示了具有持续的缓解率与可控的药物毒性。
8.Carvykti(西达基奥仑赛)
由传奇生物研发,于2022年2月被FDA批准用于复发或难治性多发性骨髓瘤(R/R MM)患者(既往接受过四线或以上的治疗,包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体),该药物靶向BCMA。临床1b/2期 CARTITUDE-1研究结果显示既往接受过四线或者以上治疗R/R MM患者达到了高达98%的总缓解率,因此Carvykti获得FDA批准上市。
除了上述已上市的CAR-T细胞疗法,全球各团队仍在开发颇有前景的CAR-T疗法,目前的治疗靶点以CD19、CD20、BCMA、CD22为主,此外一些如CD38、CD133、Siglec-6等新兴靶点也备受关注。相信将来会有更多的CAR-T细胞疗法问世,也能使得原本高昂的价格逐渐易于接受,最终为更多患者带来希望。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#CAR-#
48