J Control Release:mRNA疫苗迎来黎明,我们准备好了吗?
2021-06-28 “E药世界”公众号 “E药世界”公众号
近几十年来mRNA疫苗的发展与技术突破,为其在COVID-19大流行期间的快速崛起奠定了基础。在COVID-19全球爆发不到一年的时间里,已有两种基于mRNA的疫苗BNT162b2和mRNA-1273
近几十年来mRNA疫苗的发展与技术突破,为其在COVID-19大流行期间的快速崛起奠定了基础。在COVID-19全球爆发不到一年的时间里,已有两种基于mRNA的疫苗BNT162b2和mRNA-1273获得了紧急使用授权,而CVnCoV mRNA疫苗也已进展到3期临床试验。
近期,Journal of Controlled Release 期刊执行主编,比利时根特大学的 StefaanC. De Smedt 教授发表了题为:The dawn of mRNA vaccines: The COVID-19 case 评述性文章。
该综述详细描述了这三种疫苗的组成及临床(前)研究情况,并深入讨论了其结构设计对免疫原性的影响,对mRNA疫苗的作用模式提出了新见解,也为未来mRNA疫苗的开发和优化提出了研究方向。
1、COVID-19推动了mRNA疫苗的发展
COVID-19 mRNA疫苗代表了一类新的疫苗产品,由编码SARS-CoV-2刺突糖蛋白的合成mRNA组成。脂质纳米颗粒(LNP)作为载体将mRNA包裹,并将其递送至细胞,表达出所编码抗原,从而刺激机体产生免疫应答。
mRNA疫苗之所以能抓住机遇,离不开以下几点:
1、mRNA核苷酸的修饰和纯化。随着我们对先天免疫的认识不断深入,KatalinKariko和Drew Weissman率先提出对IVT mRNA的核苷酸进行修饰,避免其被固有免疫系统识别,降低其固有免疫原性。同时,清除双链RNA的污染,也进一步削弱了IVT mRNA的免疫刺激活性,大大减少了促炎症I型 IFN的产生,有助于其在体内实现更高的蛋白表达。
2、成熟的递送载体——LNPs。LNPs通常由一种可电离脂质和其他辅助脂质组成,通过选择合适的脂质,可以改善LNPs的稳定性,并在胞内促进内吞体逃逸。其具体制备过程为,在较低的pH值下,可电离脂质带正电,通过微流控设备与带负电荷的mRNA混合,二者通过静电吸附作用结合。在pH 7.4的条件下透析或超滤,得到电中性且紧密包裹mRNA的LNPs。
3、坚实的早期研究基础。基于对严重急性呼吸道综合症(SARS)和中东呼吸系统综合征(MERS)冠状病毒的研究,科学家们已发现冠状病毒包含一个单一的RNA基因组,编码四种主要的病毒蛋白质(棘突、包膜、膜和核衣壳)及一些辅助蛋白质。大多数MERS-CoV和SARS-CoV-1中和抗体指向S蛋白,特别是其受体结合域(RBD)。对SARS-CoV-2病毒S蛋白的结构进行研究,发现其与SARS-CoV-1病毒的S蛋白由较高的同源性,这使得疫苗开发者立即将S蛋白作为疫苗的重点突破口。
2、COVID-19 mRNA疫苗的比较
具体到BNT162b2(BioNTech/Pfizer)、mRNA-1273(Moderna)和CVnCoV(CureVac)三家疫苗企业的COVID-19 mRNA疫苗,该综述从抗原选择、LNP设计和mRNA结构等方面比较了其异同点。

图1. COVID-19 mRNA疫苗的设计。a). COVID-19 mRNA疫苗包含编码全长S蛋白的mRNA序列,具有两个脯氨酸替代位点(K986P和V987P)。S蛋白基因序列的两侧是结构元件,以便生成成熟的mRNA。这些元素中的每一个都可以被优化,以调节mRNA的稳定性、翻译能力和先天免疫活性。b). CVnCoV候选疫苗使用未经修饰的尿苷,而BNT162b2和mRNA-1273使用N1-methylpseudouridine (1mψ)取代尿苷(U)进行核苷修饰。c). 分别用于BNT162b2和mRNA-1273 LNP配方中的可电离的阳离子脂类ALC-0315以及SM-102,用于CVnCoV配方中的可电离阳离子脂质尚未公开
目前所有mRNA疫苗都以相同的SARS-CoV-2抗原为靶点,并包含编码全长跨膜锚定S蛋白的mRNA。然而,其mRNA结构有所不同。BNT162b2和mRNA-1273在mRNA生产过程中利用1mΨ的替换和dsRNA片段的去除,减少了TLR信号和胞质RNA传感器的激活,显着降低了mRNA的先天免疫应答。相比之下,CureVac则未使用核苷酸修饰的mRNA,而是通过序列优化和选择非翻译区(UTRs)来增强mRNA的翻译。
为使mRNA到达胞质表达出编码抗原,上述三种mRNA疫苗都利用了LNP递送系统,其中CureVac处方中具体脂质成分未知,BioNTech和Moderna的COVID-19mRNA疫苗使用的可电离脂质分别为ALC-0315和SM-102,其所用的PEG脂质分别为PEG2000-DMA和PEG2000-DMG。二者共同的辅助脂质为DSPC、胆固醇。以上三种mRNA-LNPs的各脂质摩尔比为可电离脂质:磷脂:胆固醇:PEG-脂质=50:10:38.5:1.5,mRNA-脂质的质量比为0.05。
由于脂质尾部引入酯键,ALC-0315和SM-102的生物可降解性较好。研究表明在递送mRNA时,SM-102脂质的效果优于Onpattro的MC3 LNPs,原因在于SM-102有更好的耐受性和更高的内吞体逃逸效率。由此可见,脂质结构和组成的差异可能对mRNA的递送效率等造成巨大的影响。处方中的PEG脂质,可提高LNP在制备和储存中的稳定性,而这些PEG脂质一般含有短酰基链,有助于PEG脂质在注射后迅速从LNPs中分离,促进LNPs与细胞的相互作用。然而,关于LNPs如何使mRNA从内吞体逃逸至细胞质的胞内运输和机制仍不完全清楚。有假说认为,LNPs中可电离的脂质成分(pKa<7)由于内吞体的酸性环境发生质子化,并与其膜上的阴离子磷脂发生交换。这种脂质混合会诱导LNPs的非双层结构转化(即由层状转变为倒六方相),从而促进mRNA LNPs的释放。这些膜融合和LNPs结构变化被认为是导致内吞体膜失稳及mRNA逃逸的原因。
3、mRNA疫苗的作用模式
那么,递送至体内之后,mRNA疫苗是如何发挥作用的呢?
与经典疫苗的机制相似,当肌肉注射COVID-19 mRNA疫苗后,会引起局部和短暂的炎症,并将不同的免疫细胞招募至注射部位。其中,主要是单核细胞和DCs被mRNA转染,这些局部转染的抗原提呈细胞(APCs)随后迁移至引流淋巴结,将抗原呈递给B细胞和T细胞。
此外,由于其相对较小的尺寸(~100 nm)、中性的表面电荷和可扩散的PEG脂膜,mRNA LNPs也可能进入淋巴管直接靶向驻留在淋巴结中的APCs和B细胞。不容忽视的是,肌细胞、上皮细胞和成纤维细胞等细胞类型可能也促进了局部mRNA表达。同时,mRNA疫苗也需要参与先天免疫,以提高诱导和调节抗原特异性免疫反应的能力。
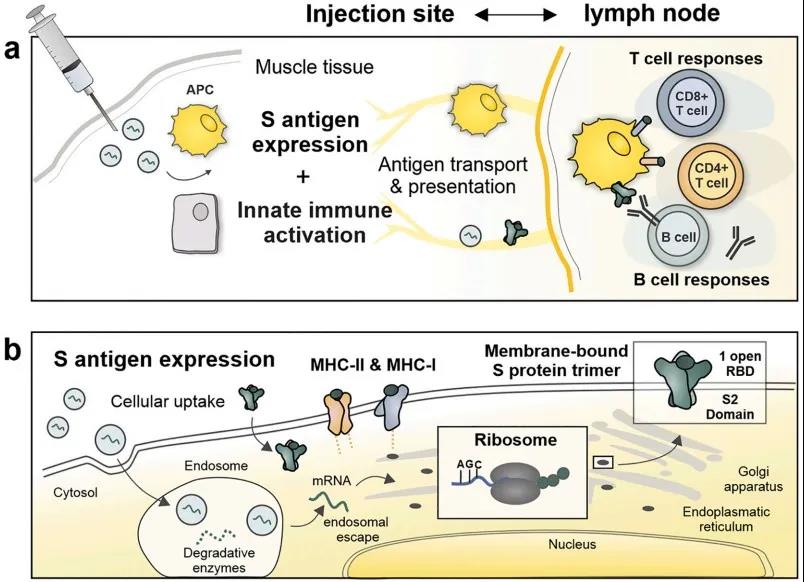
图2 mRNA疫苗的作用模式。(a在注射部位) mRNA LNPs触发短暂的炎症反应,招募中性粒细胞、单核细胞和树突状细胞到注射部位。(b在细胞水平)为了避免溶酶体降解,mRNA必须逃离核内体并与核糖体结合,这是一个复杂的速率限制过程,由可电离的LNP载体实现
4、COVID-19 mRNA疫苗诱导的免疫应答和保护作用
COVID-19 mRNA疫苗主要诱导B细胞产生中和抗体,而对COVID-19患者的观察中发现,CD4+ T细胞、CD8+ T细胞若能产生协调适应性免疫应答,引起的疾病症状较轻,反而亦之。这表明CD8+ T细胞和CD4+ T细胞应答也有助于预防SARS-CoV-2。
在体液免疫方面,研究显示两剂CVnCoV疫苗(12 μg mRNA剂量)诱导的SARS-CoV-2中和抗体滴度水平与从自然感染中恢复的个体相当。与此相比,核苷修饰的mRNA疫苗BNT162b2和mRNA-1273的抗体滴度则更高,这提示进行了核苷酸修饰的mRNA疫苗会引起更强的体液免疫应答。此外,BNT162b2和mRNA-1273由于进行了核苷酸修饰,使得机体对其耐受剂量增加,它们可能实现更持久的蛋白表达,从而延长抗原持久性,这对于增强生发中心(GC)反应来说是有利的。
目前,困扰COVID-19疫苗开发的一大因素就是病毒发生变异,而这些mRNA疫苗也对其对病毒变种有效性进行了评估,包括新出现的英国变种(B1.1.7)和南非变种(B.1.351)。结果显示,mRNA-1273和BNT162b2对变异株B1.1.7具有中和活性。Moderna的另一项研究指出,对于B.1.351,尽管中和滴度下降,仍高于预期的保护水平,所有个体的血清都能被完全中和。为应对变种病毒,相应的疫苗也在研发之中。
5、COVID-19疫苗的安全性
mRNA疫苗作为一类崭新的疫苗形式,与其他候选疫苗相比,似乎更易引发系统性不良反应,特别是发热。有报道称,接种mRNA-1273和BNT162b2疫苗后,发生了罕见的过敏反应,推测可能与PEG脂质和体内本身存在的PEG抗体有关。
不可否认的是,COVID-19 mRNA疫苗获得市场批准的速度是历史性的。SARS-CoV-2大流行推动COVID-19 mRNA疫苗发展的同时,也加快了用于其他传染病(如流感、狂犬病毒、寨卡病毒等)的mRNA疫苗的进展。然而,对其作用模式,仍存在一些未解谜团。LNPs mRNA的先天免疫应答如何影响疫苗的转染翻译能力、免疫原性和反应原性?预防效果能维持多久?还有进一步改进的空间吗……mRNA疫苗迎来了发展的黄金时期,我们也应该把握时机,去揭开它更多的秘密。
原始出处:
Rein Verbeke, et al. The dawn of mRNA vaccines: The COVID-19 case. Journal of Controlled Release, Volume 333, 10 May 2021, Pages 511-520.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#RNA疫苗#
41