Genome Biology :中国科学院赖良学/王可品合作利用基因编辑技术实现猪条件性体内基因敲除和激活
2023-01-25 iNature iNature 发表于陕西省
基于CRISPR的工具极大增加了基因组和表观基因组编辑的难度。SpCas9是目前应用最广泛的核酸酶。
基于CRISPR的工具极大增加了基因组和表观基因组编辑的难度。SpCas9是目前应用最广泛的核酸酶。然而,SpCas9递送困难且无法在体内调节其表达,这阻碍了其在大动物中的进一步应用。
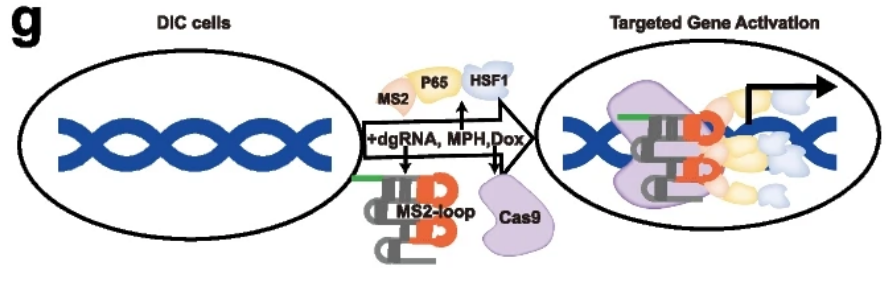
2023年1月17日,中国科学院广州生物医药与健康研究院赖良学及王可品共同通讯在Genome Biology上在线发表题为“Doxycycline-dependent Cas9-expressing pig resources for conditional in vivo gene nullification and activation”的研究论文,该研究通过在Rosa26和Hipp11位点分别精确敲入二元四环素可诱导敲除元件构建了强力霉素诱导SpCas9表达( DIC )猪模型。利用该猪模型,可以很容易地实现体内和/或体外基因组和表观基因组编辑。
在DIC系统的基础上,通过组织特异性启动子控制rtTA元件的表达,设计了一种便捷的基于Cas9的条件性敲除策略,该策略允许在简单的化学诱导下一步生成生殖系遗传猪,从而实现基因功能的体内时空控制。为了验证DIC猪体内基因突变的可行性,进一步将含有TP53 - sg RNA、LKB1 - sg RNA和突变型人KRAS基因的AAV6载体递送到成年胰腺中,建立了原发性和转移性胰腺导管腺癌。总之,这些结果表明DIC猪资源将为条件体内基因组和表观基因组修饰的基础和应用研究提供有力的工具。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言