新增15个品种拟被CDE纳入优先审评程序
2019-08-25 佚名 新浪医药新闻
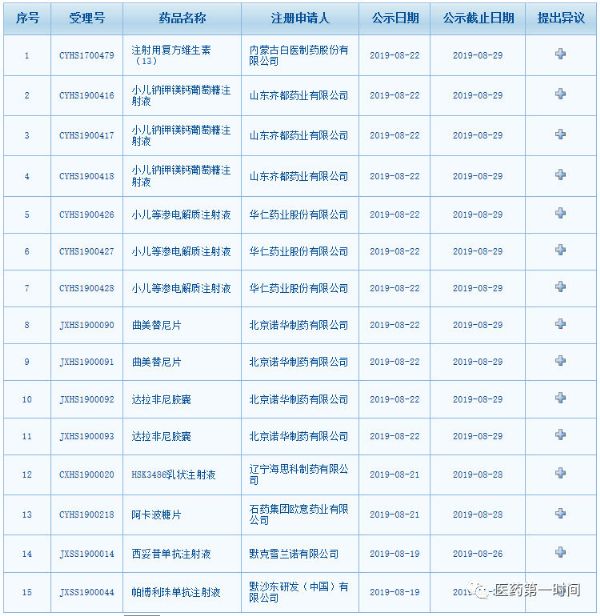
8月19日至22日,CDE网站拟优先审评公示栏新增15个品种。拟同意纳入优先审评的理由分别是:注射用复方维生素(13)为仿制药上市;小儿钠钾镁钙葡萄糖注射液、小儿等渗电解质注射液为儿童药;曲美替尼片、达拉非尼胶囊、HSK3486乳状注射液、西妥昔单抗注射液、帕博利珠单抗注射液为具有明显治疗优势药品;阿卡波糖片则为符合117公告品种、申请人主动撤回的优先条件。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#优先审评#
26