盘点:前列腺疾病与治疗盘点
2019-01-26 AlexYang MedSci原创
【1】Prostate Cancer P D:前列腺切除术后复发性前列腺癌中,早期挽救性放射治疗和SRT后PAS最低值影响研究https://www.nature.com/articles/s41391-018-0112-3对于那些根治性前列腺切除术(RP)后具有复发性前列腺癌的患者,挽救放射性治疗(SRT)为治疗提供了第二次机会。欧洲指南(EAU)推荐SRT在PSA<0.5ng/ml。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



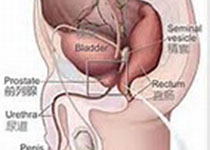




#前列腺疾病#
35