氯吡格雷致胰岛素自身免疫综合征1例
2022-10-26 强佳祺,穆丹妮 北京协和医院 “检验医学”公众号
氯吡格雷是广泛用于心梗等心血管疾病的经典抗血小板聚集药物,可在体内产生含巯基的代谢产物,诱发IAA产生并引起IAS。
前言
胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS),以低血糖、高胰岛素血症、高滴度胰岛素自身免疫抗体(insulin autoantibody,IAA)为特征[1]。研究发现,IAS的发病机制是在遗传免疫缺陷的基础上由一定的诱因所造成,服用含有巯基的药物是导致IAS发病的主要诱因之一[2]。氯吡格雷是广泛用于心梗等心血管疾病的经典抗血小板聚集药物,可在体内产生含巯基的代谢产物,诱发IAA产生并引起IAS。低血糖被认为是心血管疾病的危险因素之一,可以造成心梗病人不良预后[3]。因此,若心脑血管疾病患者出现不明原因低血糖,应该警惕氯吡格雷致IAS诱发低血糖的可能。本文报道一例氯吡格雷致IAS的急性冠脉综合征患者的诊断和治疗经过,其中IAA检测对心梗后低血糖患者有鉴别诊断价值,是评估病情和疗效的重要检验指标。
案例经过
患者男性,82岁,“间断大汗1月余”入院。2020年6月因胸闷伴大汗,ECG示V3–V5导联ST-T段压低,伴cTnI升高,外院考虑非ST段抬高型心肌梗死(NSTEMI),未行支架治疗,因冠脉病变重,持续阿司匹林、氯吡格雷双抗治疗。2020年10月16日起间断于下一餐前、长时间禁食、夜间12点左右出现大汗,无心悸、手抖、头晕、意识丧失,发作时测血糖最低2.18mmol/L,胰岛素>1000 μU/mL,IAA(+),进食后可好转。既往高血压、高脂血症10年;服用阿司匹林0.1g qd,氯吡格雷75mg qd,培哚普利 4mg qd,苯磺酸氨氯地平5mg qd,单硝酸异山梨酯 20mg bid,阿托伐他汀20mg qn,非那雄胺5mg qn;否认甲巯咪唑、还原性谷胱甘肽等巯基药物使用史;否认胰岛素促泌剂、外源性胰岛素应用史;否认自身免疫疾病史。家族中一姐房颤、一妹胰岛素瘤、一外甥1型糖尿病。2020年11月17日收入我院内分泌科病房诊治。
患者符合典型Whipple三联征,低血糖症诊断明确。患者未使用外源性胰岛素及降血糖药物,但反复发作低血糖,同步胰岛素和IAA滴度明显升高,符合IAS。含巯基药物是引起IAS的常见病因,患者用药史中仅氯吡格雷在体内代谢与巯基产生有关,考虑其低血糖是氯吡格雷致IAS所引起。
住院期间为患者规律监测血糖、胰岛素、IAA,嘱少食多餐、低碳水化合物饮食。11月20日停氯吡格雷,因顾虑IAA对血小板聚集的影响,未加用抗板药物,根据欧洲心脏病学会指南4改利伐沙班5 mg qd→5mg bid抗凝。因顾虑T-SPOT.TB与胸部CT表现不除外陈旧性结核病灶,未加用糖皮质激素。11月26日发作1次低血糖后出现不稳定性心绞痛,此后未再诉胸闷、心慌、大汗等不适。血糖稳定在正常水平,IAA浓度12日内由7280 RU/mL下降至326.03 RU/mL,加餐间隔q2.25h→q4h。12月17日出院后门诊随访,未诉不适。2021年4月8日因欲行经皮冠状动脉介入治疗停利伐沙班,改替格瑞洛90 mg qd。6月2日外院行冠状动脉支架治疗,术后予阿司匹林50 mg qd、替格瑞洛90 mg bid双联抗板,末次随访7月9日,血糖均正常,IAA 8.36 RU/mL(正常上限20 RU/mL)。
案例分析
检验案例分析:
对于低血糖的患者,检验医师协助检测和分析血糖、胰岛素、C-肽及相关抗体水平。本例患者在入院前低血糖发作时,同步测定胰岛素和C肽水平均升高,IAA(+);入院后测空腹低血糖未发作时,血糖4.7 mmol/L,胰岛素74.0 μIU/mL,C肽3.00 ng/mL,IAA>400 RU/mL。分析以上检验结果,患者多次胰岛素和C肽高于正常上限,IAA显着升高,符合IAS的特点。
回顾IAS引起的低血糖的主要机制,在进食刺激后,胰岛素分泌并与IAA结合,因而无法发挥降糖作用,血糖短暂性升高,进一步刺激了胰岛素分泌,一部分仍与IAA形成复合物,一部分呈游离状态发挥生理作用,血糖水平恢复正常。由于IAA亲和力低,胰岛素-IAA复合物逐渐解离,释放具有生物活性的胰岛素,触发低血糖[2]。为进一步确证IAS诊断,检验医师用PEG沉淀法和酸化处理测定了游离胰岛素、总胰岛素。结果提示游离胰岛素53 μIU/mL,总胰岛素831 μIU/mL,游离胰岛素比例6.38%,总胰岛素远高于游离胰岛素,提示存在大量胰岛素处于与IAA结合状态。
IAS发生与遗传背景相关,既往研究显示携带特定HLA等位基因的患者更易发病。据报道,亚洲患者因携带此类等位基因的频率更高,因而更易患IAS。检验医师建议患者完善HLA基因分型,结果患者的DRB1*0403、DQB1*0302位点均为曾报道与IAS发生相关的基因位点[5–8],再次印证患者IAS的诊断。
由于IAA与胰岛素的结合为低血糖产生的原因,而胰岛素分泌受到血糖波动影响,检验医师建议定期监测患者IAA水平。患者入院时IAA 7290.4 RU/mL(稀释20倍后测得),停用致病药物氯吡格雷12日后,IAA下降至326.03 RU/mL,复测游离胰岛素103 μIU/mL,总胰岛素616 μIU/mL,游离胰岛素比例上升至16.7%,临床观察到患者低血糖症状改善,说明氯吡格雷与IAA产生有关,停药是有效的治疗措施。此后为治疗原发病先后使用利伐沙班、替格瑞洛作为抗栓药物。结果如图1所示,患者IAA水平呈持续下降,至末次随访时已稳定在正常范围IAA 8.36 RU/mL(正常上限20 RU/mL)。因此,IAA是氯吡格雷致IAS患者病情变化和治疗效果的重要评价指标。
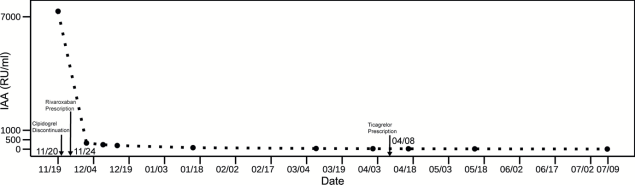
图1 患者入院至末次随访的IAA水平变化。箭头所示分别为:11月20日停用氯吡格雷,11月24日加用利伐沙班,4月8日加用替格瑞洛。
临床案例分析:
在检验医师协助患者被确诊为IAS后,临床医师对病因进行了分析。大约50%的IAS患者曾服用含有巯基药物,可能机制是巯基破坏了胰岛素的二硫键,改变了分子构象,使胰岛素具有免疫原性,触发免疫反应产生IAA[1]。排查患者用药史,氯吡格雷自身不含巯基,但可经过两步反应转变成含有巯基的活性代谢产物,是唯一与巯基产生有关的药物,且合并服用的药物均不影响氯吡格雷的代谢,考虑患者IAS为服用氯吡格雷引起。
治疗方面,根据既往治疗经验IAS停用诱因药物后通常呈自限性。传统治疗包括少食多餐、低碳饮食及糖皮质激素,也有二氮嗪、奥曲肽、阿卡波糖等药物被用于调节胰岛素分泌和葡萄糖代谢的案例[9,10],难治性低血糖的患者常用血浆置换或利妥昔单抗改善症状[9,11,12]。尽管糖皮质激素可显着改善临床症状,迅速降低IAA水平,但考虑到本例患者T-SPOT.TB和肺部影像病变考虑陈旧性肺结核不除外,糖皮质激素有诱发病灶活动性的风险,故未选用。
因此,临床医师对本例患者采取了停药和饮食调整的治疗方案。与其他含巯基药物不同的是,氯吡格雷是急性冠脉综合征双联抗板治疗的关键药物,故停药后还应至少加用一种抗栓药物。替格瑞洛、普拉格雷、利伐沙班均为欧洲心脏病学会指南[4]所推荐的NSTEMI抗栓药物。分析这三种药物的结构式和化学代谢过程(图2),普拉格雷含巯基而不能选用。因顾虑IAS自身免疫过程对血小板聚集的影响,暂时排除替格瑞洛,结合心内科医生会诊意见为患者首先换用利伐沙班抗凝。在患者出院随访监测IAA水平稳定下降后,将利伐沙班改为替格瑞洛抗板。替格瑞洛与患者本身服用的阿司匹林构成了双联抗板,为患者行经皮冠状动脉介入治疗形成顺利过渡。
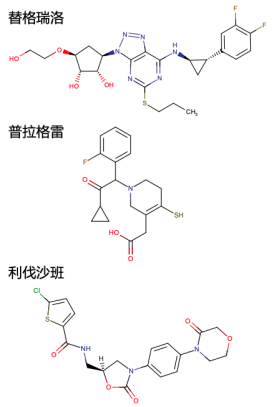
图2. 替格瑞洛、普拉格雷、利伐沙班化学结构式。其中普拉格雷含巯基。
知识拓展
本例患者既往诊断冠心病,NSTEMI病史,以大汗、交感神经兴奋症状来诊,发作时血糖小于2.8 mmol/L,胰岛素显着升高,进食后可缓解。最突出的临床特点为急性冠脉综合征发作后高胰岛素性低血糖,在临床中遇到类似症状时,鉴别诊断分析应分两步进行:
1、心梗后低血糖的鉴别:(1)误服超过推荐治疗剂量的阿司匹林,既往研究显示大剂量(>1.8 g/d)阿司匹林通过刺激胰岛素分泌、改善胰岛素抵抗发挥降糖作用[13–15],本例患者服用阿司匹林剂量0.1 qd,可除外;(2)心梗后存在脏器供血不足、营养缺乏,引起血糖降低,在合并严重的肝病、心衰、肾衰、恶性肿瘤等全身性疾病时更易出现低血糖,本例患者入室后评估肝肾功能良好,影像学及肿瘤指标筛查阴性,考虑可能性小;(3)因垂体、肾上腺或胰腺病变引起的升糖激素缺乏或胰岛素过多,如垂体前叶功能减退、肾上腺功能减退、胰岛素瘤等,本例患者低血糖发作时胰岛素和IAA滴度升高,考虑此类原因可能性大。
2、高胰岛素低血糖症的鉴别(1)外源性胰岛素:表现为高血浆胰岛素、低血浆C肽、低血浆胰岛素原,患者无糖尿病病史,未使用胰岛素促泌剂和外源性胰岛素,低血糖发作时同步胰岛素及C肽均升高,可除外;(2)反应性低血糖:多见于2型糖尿病早期,由于高胰岛素血症及胰岛素分泌高峰延迟导致,多表现为餐后低血糖,患者既往无糖尿病病史,发作时相不典型,考虑可能性小;(3)胰岛素瘤:表现为空腹低血糖,胰腺影像学常提示占位,IAA(–),可能为原发性或多发性内分泌腺瘤1型受累表现,患者胰腺增强CT、生长抑素受体显像未见明显异常,IAA(+),筛查垂体前叶激素未见异常,可除外;(4)胰岛细胞增生:表现为餐后低血糖,多发生在胃肠手术后,IAA(–),患者无相关临床表现和病史,可除外;(5)B型胰岛素抵抗:表现为顽固性高血糖、高雄激素血症、黑棘皮征或低血糖,可为自身免疫疾病的首发症状,患者无典型临床表现,查体未见黑棘皮征,筛查无自身免疫疾病相关证据,IAA(+),可除外;(6)IAS:表现为反复自发性低血糖、血液免疫活性胰岛素升高、IAA滴度明显升高,患者符合上述表现,并且排除了其他原因导致的低血糖,包括使用外源性胰岛素和降血糖药物、酒精性脂肪肝、浆细胞失调、系统性红斑狼疮、类风湿性关节炎或Graves病等,本病可能性大。
案例总结
本案例成功诊断一例氯吡格雷致IAS,目前类似报道不足10例,为罕见疾病;同时首次提出停氯吡格雷后可考虑换用利伐沙班、替格瑞洛的替代抗栓治疗方案,并获得良好效果。诊断过程中,临床医师首先接诊并梳理病史,明确心梗后反复发作的低血糖为主要特点,入院后完善了鉴别诊断所需检查。检验医师依据低血糖发作时同步胰岛素升高和IAA阳性,结合临床病历资料,考虑为IAS可能引起低血糖的原因,并加测游离胰岛素和总胰岛素水平,证实患者体内存在大量IAA与胰岛素结合,建议检测HLA基因分型也提示患者携带IAS高危位点。
IAS诊断明确后,临床医师再次筛查患者用药史,确定氯吡格雷为导致IAS的病因。治疗过程中,临床医师为患者停用氯吡格雷,先后换用利伐沙班和替格瑞洛替代抗栓,检验医师协助IAA水平的定期监测,该抗体的持续下降至正常范围提示治疗策略有效。
基于检验和临床的有效沟通和配合,本案例中患者健康有效改善;依赖于双方对疾病的扎实理论基础,取得了一定的诊疗成果。同时,本案例中所报道的IAA检测对心梗后低血糖患者有鉴别诊断价值,是评估病情和疗效的重要检验指标,这是检验为临床工作提供的价值和帮助。检验医学不仅在日常标本质控和数值测定中为临床保驾护航,还可分析异常偏移值的原因,全面解读检测结果,提供更合理及个性化的检测项目指导。当前,多学科诊疗(Multi-Disciplinary Treatment,MDT)已是综合、精准医疗的发展趋势,不同的专业角度将促使我们对疾病的认识更为深入,推动诊疗逐步优化、效率提升。
专家点评
陈适 教授,北京协和医院内分泌
本案例为一例心梗后低血糖患者,检验医师与临床医师在诊疗过程中紧密配合,共同明确氯吡格雷导致的IAS是诱发该患者反复低血糖的原因,IAA水平监测是重要的诊断线索和停药、换药后的疗效评估指标。近年来以心肌梗死为代表的心血管疾病发生率和病死率在我国逐年递增,已成为严重危害健康的慢病杀手之一。低血糖被认为是心血管疾病的危险因素之一,可以造成心梗病人不良预后。因此临床应用氯吡格雷过程中应密切关注低血糖症状,警惕氯吡格雷导致的IAS。必要时监测IAA水平,提高用药安全,避免不良反应发生。发病后首先停药,可选用利伐沙班或替格瑞洛替代抗栓,持续监测IAA直至症状好转、抗体水平正常。本案例充分体现了检验医学在疾病诊疗中的重要性,临床医师与检验医师应在此后进一步加强沟通和互相学习,发挥MDT的优势以提高诊疗效率并使更多患者获益。
【参考文献】
1. Jiang Y, Wang L, Shi F, et al. Insulin Autoimmune Syndrome After Exposure to Clopidogrel: A Case Report. Endocr Metab Immune Disord Drug Targets. 2020;20(8):1355-1362. doi:10.2174/1871530320666191220111615
2. D C, E M, A F, P M. Insulin Autoimmune Syndrome (Hirata Disease): A Comprehensive Review Fifty Years After Its First Description. Diabetes, metabolic syndrome and obesity?: targets and therapy. 2020;13. doi:10.2147/DMSO.S219438
3. Frier BM, Schernthaner G, Heller SR. Hypoglycemia and cardiovascular risks. Diabetes Care. 2011;34 Suppl 2:S132-137. doi:10.2337/dc11-s220
4. Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021;42(14):1289-1367. doi:10.1093/eurheartj/ehaa575
5. Eisenbarth GS. MEDICAL INTELLIGENCE UNIT 13: Molecular Mechanisms of Endocrine and Organ Specific Autoimmunity. R.G. Landes Company; 1999.
6. Uchigata Y, Hirata Y, Iwamoto Y. Drug-induced insulin autoimmune syndrome. Diabetes Res Clin Pract. 2009;83(1):e19-20. doi:10.1016/j.diabres.2008.10.015
7. Uchigata Y, Omori Y, Nieda M, Kuwata S, Tokunaga K, Juji T. HLA-DR4 genotype and insulin-processing in insulin autoimmune syndrome. Lancet. 1992;340(8833):1467. doi:10.1016/0140-6736(92)92654-x
8. Uchigata Y, Tokunaga K, Nepom G, et al. Differential immunogenetic determinants of polyclonal insulin autoimmune syndrome (Hirata’s disease) and monoclonal insulin autoimmune syndrome. Diabetes. 1995;44(10):1227-1232. doi:10.2337/diab.44.10.1227
9. Censi S, Mian C, Betterle C. Insulin autoimmune syndrome: from diagnosis to clinical management. Ann Transl Med. 2018;6(17):335. doi:10.21037/atm.2018.07.32
10. Yuan T, Li J, Li M, et al. Insulin Autoimmune Syndrome Diagnosis and Therapy in a Single Chinese Center. Clin Ther. 2019;41(5):920-928. doi:10.1016/j.clinthera.2019.03.009
11. Calder GL, Ward GM, Sachithanandan N, MacIsaac RJ. Insulin Autoimmune Syndrome: A Case of Clopidogrel-induced Autoimmune Hypoglycemia. J Clin Endocrinol Metab. 2020;105(4):dgz301. doi:10.1210/clinem/dgz301
12. Yaturu S, DePrisco C, Lurie A. Severe autoimmune hypoglycemia with insulin antibodies necessitating plasmapheresis. Endocr Pract. 2004;10(1):49-54. doi:10.4158/EP.10.1.49
13. Yuan M, Konstantopoulos N, Lee J, et al. Reversal of obesity- and diet-induced insulin resistance with salicylates or targeted disruption of Ikkbeta. Science. 2001;293(5535):1673-1677. doi:10.1126/science.1061620
14. Baron SH. Salicylates as hypoglycemic agents. Diabetes Care. 1982;5(1):64-71. doi:10.2337/diacare.5.1.64
15. Hundal RS, Petersen KF, Mayerson AB, et al. Mechanism by which high-dose aspirin improves glucose metabolism in type 2 diabetes. J Clin Invest. 2002;109(10):1321-1326. doi:10.1172/JCI14955
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言