David Liu再出手,背靠背两篇NBT论文,再次升级CRISPR基因编辑系统
2020-02-13 BioWorld iBioWorld
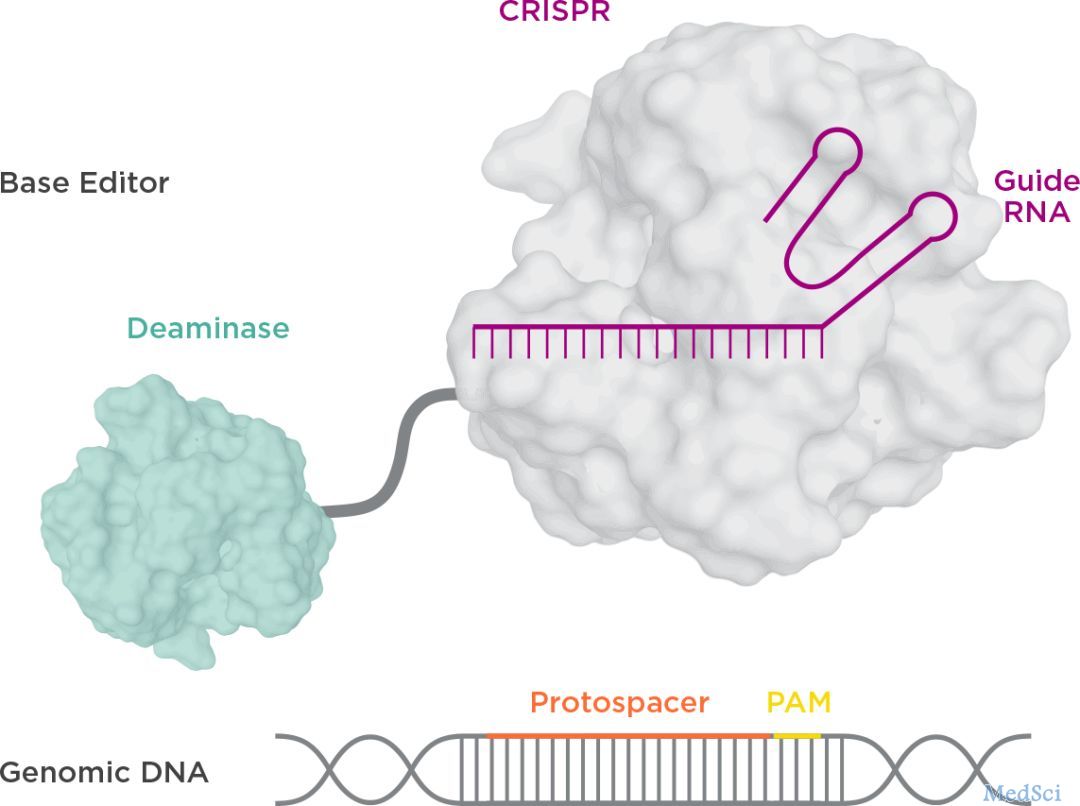
2017年10月25日,David Liu(刘如谦)等人在 Nature 发表论文,成功开发了腺嘌呤碱基编辑器 (ABE),可以将A?T碱基对转换成G?C碱基对。这些发现,在不依赖DNA双链断裂的情况下,实现对单个碱基的定向修改。胞嘧啶碱基编辑器(CBEs)能够在基因组DNA中实现C?G到T?A的转换。而在2019年,我国科学家杨辉和高彩霞各自独立发现,在小鼠胚胎和水稻中,早期版本的胞嘧啶剪辑
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#基因编辑系统#
38
#CRISPR基因编辑#
30
#CRISPR#
30