FDA:批准纳武利尤单抗获批食管鳞癌二线治疗
2020-06-12 MedSci MedSci
FDA于近日批准了nivolumab(纳武利尤单抗)新的适应症,用于先前接受氟嘧啶和铂类化疗后病情进展的不可切除、晚期,复发或转移性食管鳞状细胞癌(ESCC)患者的治疗。
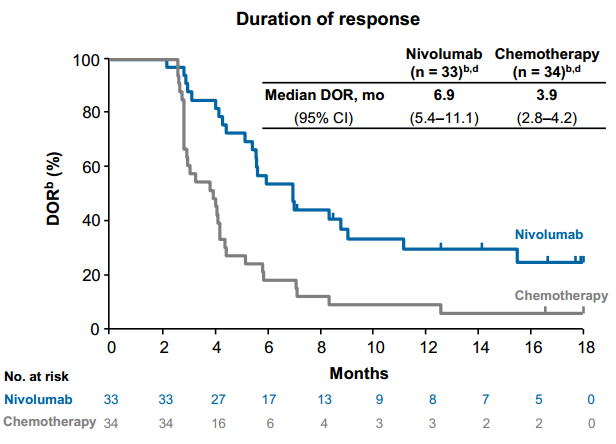
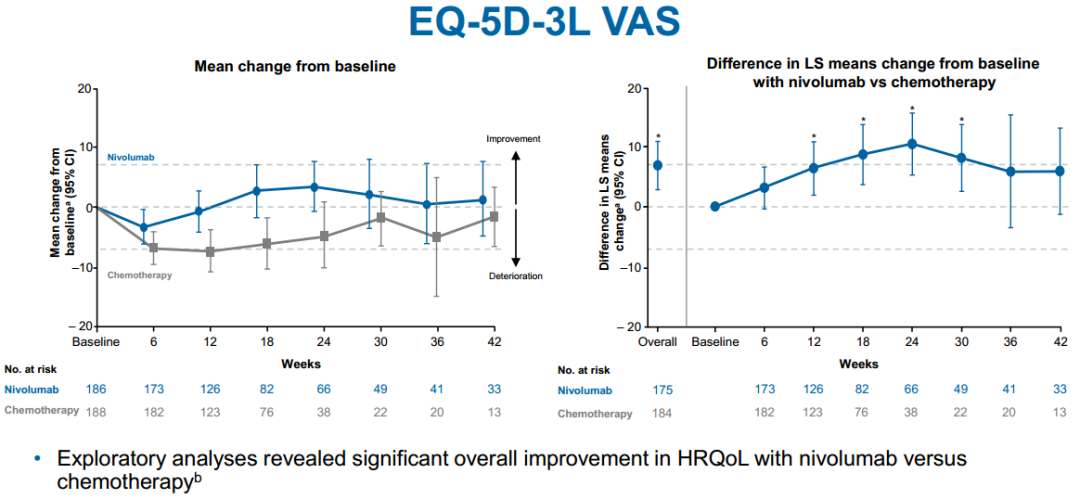
食管癌是常见的消化道肿瘤,相比于欧美国家,我国食管癌发病率更高,且具有一定的地域差异性。欧美国家主要为食管腺癌(占所有食管癌的70%~80%),而我国则主要为食管鳞癌(90%以上)。既往食管鳞癌的治疗以化疗为主,并且没有非常标准的治疗方案,患者的治疗选择十分有限,转移性食管癌预后较差。5年相对生存率≤8%。近几年来,免疫治疗的出现打破了现有的治疗瓶颈,使患者有了更多更好的选择,治疗有效率得以明显提高。 纳武利尤单抗也称O药(Opdivo),是一种PD-1免疫抑制剂, 也是国内率先入席的免疫疗法药物。FDA批准纳武利尤单抗获批食管鳞状癌二线治疗,这是首个获批用于治疗该类患者人群的免疫疗法,无论PD-L1状态如何。 此次批准是基于III期ATTRACTION-3研究结果。ATTRACTION-3研究是一项多中心、随机、开放标签、全球III期研究,共纳入419例既往接受过氟嘧啶和含铂药物联合疗法难治或不可耐受的不可切除性晚期或复发性ESCC患者,评估了纳武利尤单抗对比化疗(多西紫杉醇或紫杉醇)的疗效和安全性。入组患者(不考虑PD-L1表达情况)1:1随机接受武利尤单抗或化疗,主要研究终点为OS。 图:试验设计 01 无论PD-L1表达,均能获益 相比化疗组,纳武利尤单抗组的OS延长更有优势,包括不同的PD-L1表达亚组。ATT-3中PD-L1阳性和阴性的患者约各占一半: − 在PD-L1阳性(≥1%)的人群:纳武利尤单抗降低了死亡风险(HR=0.69,95% CI: 0.51-0.94); − 在PD-L1阴性(<1%)的人群:该优势仍然存在(HR=0.84,95% CI: 0.62-1.14)。 基于该结果,在不可切除性晚期或复发性食管鳞状细胞癌二线治疗方面,纳武利尤单抗成为全球首个被证实可改善PD-L1非选择人群OS的免疫检查点抑制剂。 02、一年生存率,数据亮眼 纳武利尤单抗组的中位生存期(mOS)为10.9个月(95% CI:9.2-13.3),化疗组为8.4个月(95% CI:7.2-9.9)。在整个研究群体中,纳武利尤单抗组mOS延长2.5个月,死亡风险降低23%。 纳武利尤单抗组和化疗组的1年OS率分别为47% vs. 34%,18个月OS率分别为31% vs. 21%。这意味着12个月和18个月时纳武利尤单抗组有更多的幸存者,治疗1年后,每两个患者中有一个仍存活。 图:总生存数据 03、一旦起效,可持续缓解 两组的客观缓解率(ORR)分别为19%和22%,尽管两组ORR接近,但是纳武利尤单抗带来了更持久的缓解。纳武利尤单抗的中位缓解持续时间(mDoR)达到6.9个月,对比化疗组的3.9个月,“惊人”地延长了3个月,翻了近2倍。数据统计截止时,纳武利尤单抗组有7名患者仍有持续缓解,而化疗组仅有2名,免疫治疗生存获益显著的“拖尾效应”再次显现。 图:中位缓解持续时间 04、大幅降低严重不良反应 该试验中纳武利尤单抗的安全性与既往食管癌及其他实体瘤临床试验报道一致。与化疗相比,纳武利尤单抗治疗相关不良事件(TRAEs)较少,总发生率为66%,而化疗组达95%;纳武利尤单抗的大部分TRAEs为1级和2级,3-4级TRAEs发生率相较于化疗组降低3倍 (18% vs. 63%),且总体可控可逆。 05、显著改善生活质量 一项患者报告结局(PRO)的探索性分析显示,与化疗相比,纳武利尤单抗组的健康相关生活质量(HRQoL)总体显著改善。 图:PRO探索性分析


ATTRACTION-3研究是全球首个针对食管鳞癌的III期临床研究,不仅样本量大,还以亚洲人群为主进行设计。因此,该研究成果对于中国食管鳞癌治疗具有“破冰”意义,甚至可能改变国内外权威指南的推荐。非常期待以纳武利尤单抗为代表的免疫肿瘤治疗能早日惠及更多中国食管癌患者。
参考文献:
1.U.S. Food and Drug Administration Approves Opdivo® (nivolumab) for the Treatment of Patients with Advanced Esophageal Squamous Cell Carcinoma (ESCC) After Prior Fluoropyrimidine- and Platinum-based Chemotherapy. Published June 10, 2020. https://bit.ly/3dRhSI1. Accessed June 10, 2020.
2.Cho BC, Kato K, Takahashi M, et al. Nivolumab versus chemotherapy in advanced esophageal squamous cell carcinoma (ESCC): the phase 3 ATTRACTION-3 study. Presented at ESMO 2019; September 27-October 1, 2019; Barcelona, Spain. Abstract LBA 11.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








好消息
69
#食管#
35
#鳞癌#
31
#二线治疗#
0
#食管癌#在国内要看看,是恒瑞,百济,还是信达君实,谁能够获得这个适应症。
189