Blood:采用自然选择的CD7 CAR T细胞治疗T-ALL/LBL
2022-09-22 MedSci原创 MedSci原创
对于T-ALL/LBL患者,NS7CAR-T细胞疗法是一种安全且高效的治疗方法。
急性T淋巴母细胞白血病 (T-ALL) 和T淋巴母细胞淋巴瘤 (T-LBL) 都是高度侵袭性的T系恶性肿瘤,以骨髓 (BM) 和外周血 (PB) 中未成熟T细胞浸润和/或髓外器官受累为特征,包括中枢神经系统(CNS)浸润。迄今为止,即使进行了异基因造血干细胞移植(allo-HSCT),难治性/复发性 (R/R) T-ALL/LBL患者的长期生存预后仍然很差。
CD7靶向嵌合抗原受体 (7CAR) T细胞的衍生通常需要遗传操作来消融CD7基因或阻断CD7细胞表面表达。研究人员开发了一种新方法,从体块T细胞中获得自然选择的7CAR (NS7CAR) T细胞,能够通过最小化可接近的CD7表位来克服主要的自相残杀。
用药方案
NS7CAR T细胞的CD7分子被靶向CD7的CAR掩盖或阻断。与分类的CD7-阴性7CAR-T细胞和CD7敲除的7CAR-T细胞相比,NS7CAR表现出类似或更好的治疗性能,包括较大比例的CAR+细胞和较高比例的CD8+中心记忆T细胞。
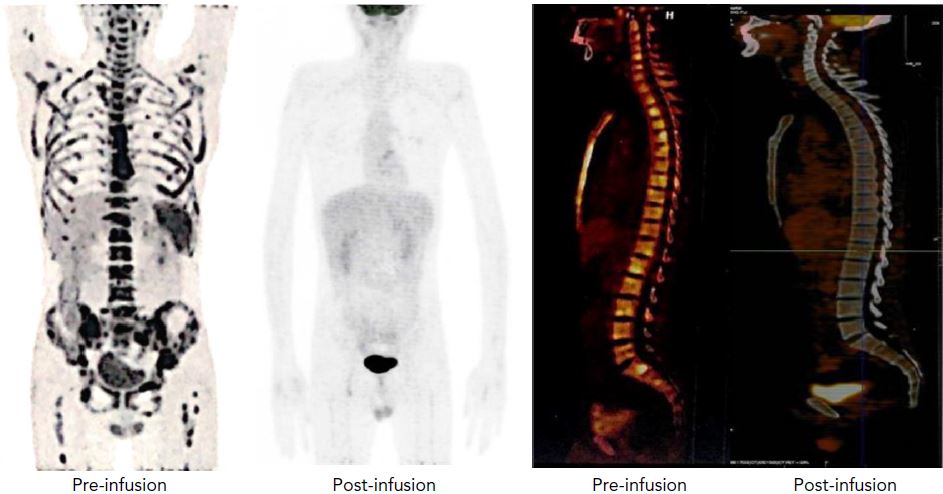
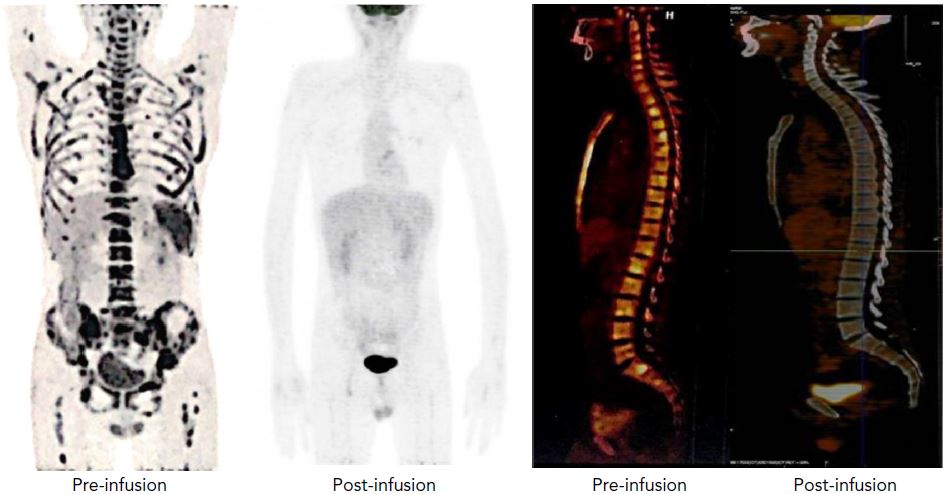
在其第一阶段人体试验中,20位复发性/难治性T-ALL患者(n=14)和T-LBL患者(n=6)接受了NS7CAR治疗。19位患者在第28天时获得了骨髓残余病灶阴性的完全缓解(CR),9位患者中有5位获得了髓外完全缓解。
受试患者治疗前后的影像
输注NS7CAR后中位随访了142.5天,14位患者随后进行了异基因造血干细胞移植(10位巩固治疗,4位挽救治疗),至今未复发。6位未进行移植的患者中有4位在中位随访了54天(32-180天)时仍处于完全缓解。
18位患者经历了轻度的细胞因子释放综合征(CRS,≤2级),一位患者发展成了3级CRS,两位患者经历了1级神经毒性。
综上,该研究结果提示,对于T-ALL/LBL患者,NS7CAR-T细胞疗法是一种安全且高效的治疗方法。需要更多的患者和更长的随访来进行验证。
原始出处:
Lu Peihua,Liu Ying,Yang Junfang et al. Naturally selected CD7 CAR-T therapy without genetic manipulations for T-ALL/LBL: first-in-human phase 1 clinical trial.[J] .Blood, 2022, 140: 321-334.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









学习
38