2020年度药品审评报告
2021-06-23 CDE CDE
2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,中国国家药品监督管理局药品审评中心(以下简称药审中心)在中国国家药品监督管理局(以下简称国家药监局)的坚强领导下,贯彻《药品管理法》《疫苗管理法
2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,中国国家药品监督管理局药品审评中心(以下简称药审中心)在中国国家药品监督管理局(以下简称国家药监局)的坚强领导下,贯彻《药品管理法》《疫苗管理法》《药品注册管理办法》、推动审评体系和审评能力现代化,统筹推进疫情防控和依法依规科学审评工作,不断提高审评质量和效率,不断加快新药研发上市步伐,为疫情防控和满足临床急需提供有效药物保障、为医药产业高质量发展提供有力促进作用。
一、药品注册申请审评审批情
(一)总体完成情况
1.全年审评审批完成情况
2020年,根据《药品注册管理办法》(国家市场监督管理总局令第27号)、《国家药监局关于实施<药品注册管理办法>有关事宜的公告》(2020年第46号,以下简称46号公告)及《药品注册管理办法》相关配套文件,药审中心完成中药(包括民族药,下同)、化学药、生物制品各类注册申请审评审批共11582件(含器械组合产品4件,以受理号计,下同),较2019年增长32.67%(如无说明,以注册申请件数计,下同)。其中,完成需技术审评的注册申请8606件(含5674件需药审中心技术审评和行政审批注册申请),较2019年增长26.24%;完成直接行政审批(无需技术审评,下同)的注册申请2972件。2020年底正在审评审批和等待审评审批的注册申请已由2015年9月高峰时的近22000件降至4882件(不含完成技术审评因申报资料缺陷等待申请人回复补充资料的注册申请)。
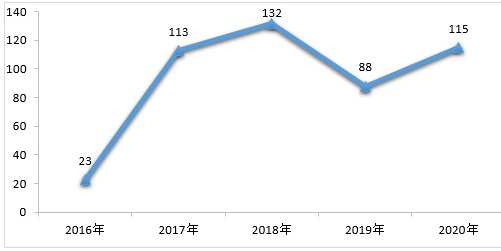
完成8606件需技术审评的药品注册申请中,化学药注册申请为6778件,较2019年增长25.22%;中药注册申请418件,较2019年增长39.33%;生物制品注册申请1410件,较2019年增长27.72%;化学药注册申请约占全部技术审评完成量的78.76%。2016-2020年中药、生物制品、化学药注册申请审评审批完成情况详见图1
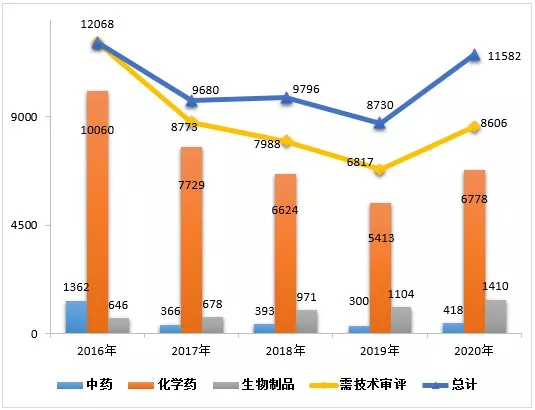
▲图1 2016-2020年中药、生物制品、化学药注册申请审评审批完成情况
注:1.完成总量中包含器械组合产品的注册申请,故注册申请完成总量大于中药、化学药、生物制品注册申请完成量之和。
2.药审中心的直接行政审批工作自2017年开始,故2016年无直接行政审批的注册申请,2016年的注册申请均需技术审评。
2.各类注册申请审评完成情况
药审中心完成需技术审评的8606件注册申请中,完成新药临床试验(IND)申请审评1561件,较2019年增长55.94%;完成新药上市申请(NDA)审评289件,完成仿制药上市申请(ANDA)审评1700件;完成仿制药质量和疗效一致性评价(以下简称一致性评价)申请(以补充申请途径申报)1136件,较2019年增长103.22%;完成补充申请技术审评3250件,较2019年增长24.19%。2016-2020年各类注册申请审评完成情况详见图2。

▲图2 2016-2020年各类注册申请审评完成情况
注:药审中心自2017年8月开始承担仿制药质量和疗效一致性评价工作。
3.审评通过情况
2020年,药审中心审评通过批准IND申请1435件,较2019年增长54.97%;审评通过NDA 208件,较2019年增长26.83%;审评通过ANDA 918件;审评通过批准一致性评价申请577件,较2019年增长121.92%。
药审中心审评通过创新药NDA 20个品种,审评通过境外生产原研药品NDA 72个品种(含新增适应症品种),具体品种详见附件1、2。
4.审结注册申请任务按时限完成情况
2020年,药审中心持续优化审评流程,严格审评时限管理,加强项目督导,加快审评速度,整体审评任务和重点序列审评任务按时限完成率均取得显著提升。全年审结注册申请任务整体按时限完成率为94.48%,其中临床急需境外已上市新药注册申请审结任务整体按时限完成率为100%,按默示许可受理注册申请的审结任务整体按时限完成率为99.87%,直接行政审批的注册申请100%在法定的20个工作日内完成,且审批平均用时11.8个工作日。各类注册申请任务按时限完成情况详见表1
表1 各类注册申请任务按时限完成情况

2020年的NDA年度整体按时限完成率已经有了很大的提升,例如:NDA按时限完成率在2020年12月突破80%,提升至87.5%;ANDA按时限完成率在2020年12月突破90%,达到93.85%;纳入优先审评程序的注册申请按时限完成率在2020年10-12月的月度按时限完成率连续达到90%以上,取得历史性突破。
(二)中药注册申请审评完成情况
1.总体情况
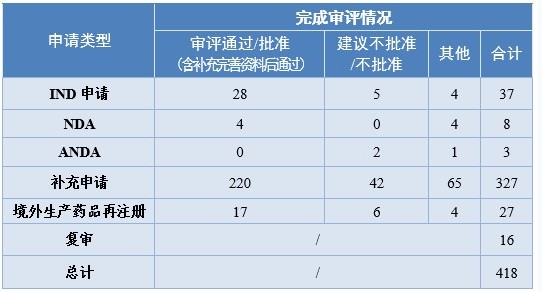
2020年,药审中心完成审评的中药注册申请418件。其中,完成IND申请37件,完成NDA 8件,完成ANDA 3件。2020年中药各类注册申请的审评完成情况详见图3。

▲ 图3 2020年中药各类注册申请的审评完成情况
2.审评通过情况
药审中心审评通过批准中药IND申请28件,审评通过中药NDA 4件(连花清咳片、筋骨止痛凝胶、桑枝总生物碱片及桑枝总生物碱)。2020年中药各类注册申请审评完成的具体情况详见表2,2016-2020年审评通过批准中药IND申请和审评通过中药NDA情况详见图4。
表2 2020年中药各类注册申请审评完成的具体情况
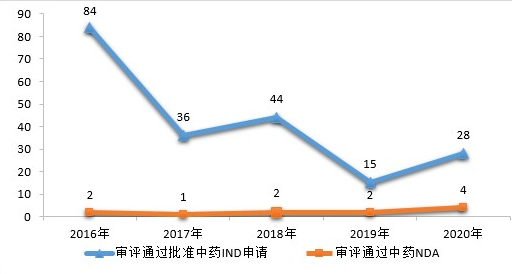
▲图4 2016-2020年审评通过批准中药IND申请和审评通过中药NDA情况
药审中心审评通过批准的中药IND申请28件,涉及10个适应症领域。其中,呼吸7件、骨科4件、消化4件,共占53.57%,2020年审评通过批准的中药IND申请适应症分布详见图5。
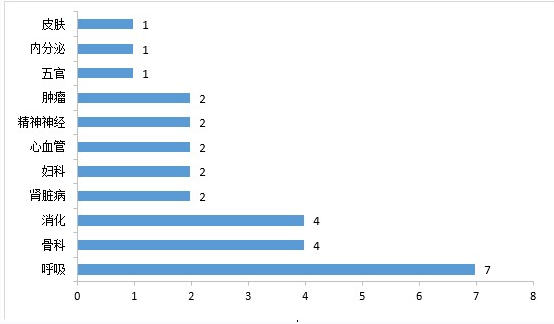
▲图5 2020年审评通过批准的中药IND申请适应症分布
(三)化学药注册申请审评完成情况
1.总体情况
2020年,药审中心完成审评的化学药注册申请6778件。其中,完成化学药临床申请(IND申请和验证性临床)共1086件,较2019年增长45.58%;完成化学药NDA 163件;完成化学药ANDA 1697件;完成一致性评价申请1136件,较2019年增长103.22%;完成化学药补充申请2248件,较2019年增长23.72%。2020年化学药各类注册申请的审评完成情况详见图6。
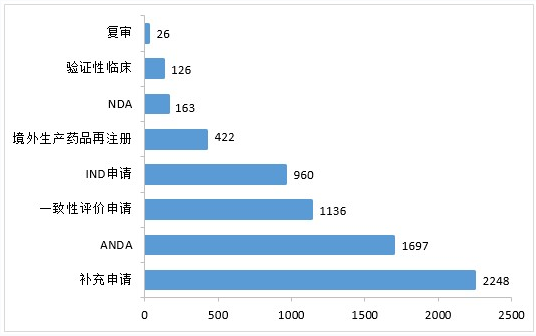
▲图6 2020年化学药各类注册申请的审评完成情况
2.审评通过情况
药审中心完成审评的化学药注册申请中,审评通过批准IND申请907件,较2019年增长51.42%;审评通过NDA 115件,较2019年增长30.68%;审评通过ANDA 918件,较2019年增长15.33%。2020年化学药各类注册申请审评完成的具体情况详见表3。
表3 2020年化学药各类注册申请审评完成的具体情况
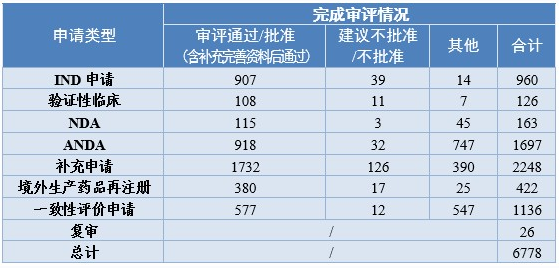
注:“其他”是指申请人主动申请撤回的注册申请、完成审评等待申请人补充完善申报资料的注册申请等,下同。
药审中心完成审评的化学药IND申请960件,审评通过批准IND申请907件。其中,1类创新化学药IND申请694件(298个品种),较2019年增长40.77%,品种数较2019年增长57.67%。2016-2020年审评通过批准化学药IND申请、1类创新化学药IND申请情况详见图7。
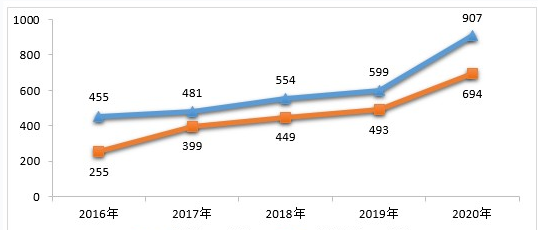
▲图7 2016-2020年审评通过批准化学药IND申请
1类创新化学药IND申请情况
药审中心审评通过批准IND申请的694件1类创新化学药中,抗肿瘤药物、抗感染药物、循环系统疾病药物、内分泌系统药物、消化系统疾病药物和风湿性疾病及免疫药物较多,占全部创新药临床试验批准数量的80.69%。2020年审评通过批准的1类创新化学药IND申请适应症分布详见图8。
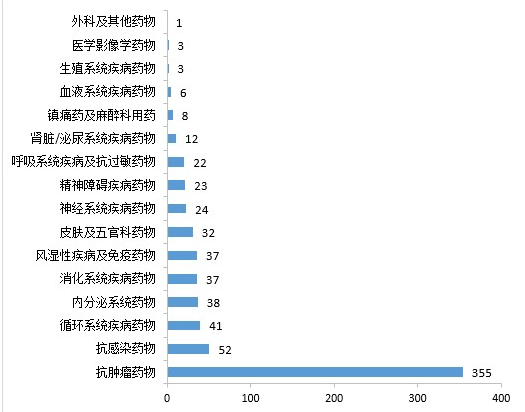
▲图8 2020年审评通过批准的1类创新化学药IND申请适应症分布
药审中心完成审评的化学药NDA共163件。其中,审评通过化药NDA 115件,审评通过1类创新化学药NDA 14个品种。2016-2020年审评通过化学药NDA情况详见图9。
▲图9 2016-2020年审评通过化学药NDA情况
药审中心完成审评的一致性评价申请共1136件,审评通过577件。其中,审评通过批准口服固体制剂一致性评价456件,审评通过批准注射剂一致性评价申请121件。2018-2020年审评通过批准的一致性评价申请情况详见图10。
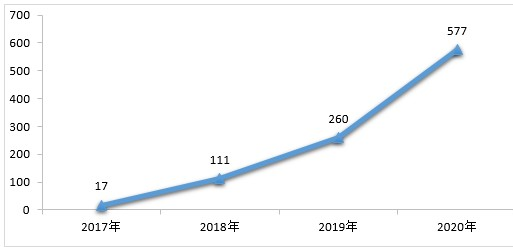
▲图10 2018-2020年审评通过批准的一致性评价申请情况
(四)生物制品注册申请审评完成情况
1.总体情况
2020年,药审中心完成审评的生物制品注册申请共1410件。其中,完成预防用生物制品IND申请(预防用IND申请)27件,完成治疗用生物制品IND申请(治疗用IND申请)537件,较2019年增长58.88%;完成预防用生物制品NDA(预防用NDA)9件,完成治疗用生物制品NDA(治疗用NDA)108件,完成体外诊断试剂NDA(体外诊断NDA)1件。2020年生物制品各类注册申请的审评完成情况详见图11。
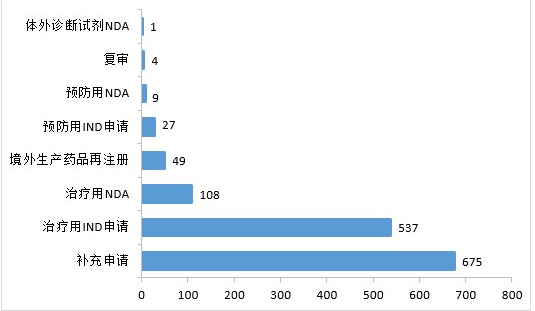
▲图11 2020年生物制品各类注册申请的审评完成情况
2.审评通过情况
药审中心审评通过批准生物制品IND申请500件,较2019年增长60.26%。其中,预防用IND申请19件;治疗用IND申请481件,较2019年增长63.61%。审评通过生物制品NDA 89件,较2019年增长20.27%。其中,预防用NDA 7件;治疗用NDA 81件(制剂77件),较2019年增长19.12%;体外诊断NDA 1件。2020年生物制品各类注册申请审评完成的具体情况详见表4,2016-2020年审评通过批准生物制品IND申请和审评通过NDA情况详见图12。
表4 2020年生物制品各类注册申请审评完成的具体情况


▲图12 2016-2020年审评通过批准生物制品IND申请和
审评通过生物制品NDA情况
药审中心审评通过批准生物制品IND申请500件,2020年审评通过批准的生物制品IND申请适应症分布详见图13。药审中心审评通过生物制品NDA 89件,2020年审评通过的生物制品NDA适应症分布详见图14。
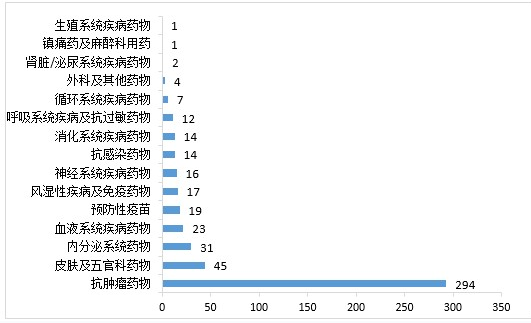
▲ 图13 2020年审评通过批准的生物制品IND申请适应症分布
注:预防性疫苗、体外诊断试剂作为大类进行统计,未细分适应症,下同。
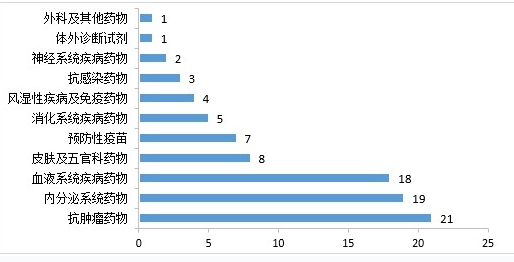
▲图14 2020年审评通过的生物制品NDA适应症分布
(五)行政审批注册申请完成情况
1.总体情况
2020年,药审中心完成中药、化学药、生物制品各类注册申请行政审批共8646件,较2019年增长44.51%。其中,完成审评审批的注册申请(临床试验申请、一致性评价申请、补充申请、境外生产药品再注册及复审)5674件,较2019年增长39.24%;完成直接行政审批的注册申请(无需技术审评的补充申请、临时进口申请)2972件,较2019年增长55.77%。2020年中药、化学药、生物制品各类注册申请行政审批完成情况见表5。2018-2020年行政审批注册申请完成情况详见图15。
表5 2020年中药、化学药、生物制品各类注册申请行政审批完成情况

注:1.根据《药品注册管理办法》,行政审批决定应当在二十日内作出,技术审评与行政审批在时间上有先后顺序。
2.行政审批注册中不包含因申请人主动撤回等情形的注册申请。
3.该表以受理号统计。
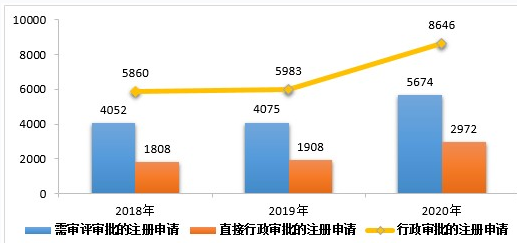
▲图15 2018-2020年行政审批注册申请完成情况
2.需审评审批的注册申请完成情况
药审中心完成的需审评审批的5674件注册申请中,临床试验申请1686件(含验证性临床),较2019年增长50.00%;一致性评价申请623件,较2019年增长80.58%;补充申请2860件,较2019年增长34.46%;境外生产药品再注册478件、复审27件。
3.直接行政审批的注册申请完成情况
药审中心完成直接行政审批的2972件注册申请中,按注册申请类型划分,补充申请2537件、临时进口申请435件。按药品类型划分,中药153件、化学药2411件、生物制品408件。
(六)注册申请不批准的主要原因及存在的问题
2020年,中药、化学药、生物制品各类药品注册申请因申报资料无法证明药品安全性、有效性或者质量可控性,以及未能按期提交补充资料等情形,导致审评结论为建议不批准的共367件。通过系统梳理上述注册申请不批准原因,从新药、仿制药等不同注册分类角度分析药品注册申请在研发和申报过程中存在的主要问题包括:
1.新药申请
IND申请和研发中存在的问题主要有:正式申报前未开展沟通交流;开发立题依据不足,成药性存在严重缺陷;申报资料不足以支持开展药物临床试验或者不能保障临床受试者安全。具体表现包括:未沟通交流致使申报后发现研究信息严重缺项,无法在时限内完成补充研究;已有的研究结果提示药效作用弱,毒性大,临床获益和风险比值不合理;临床开发定位违背临床诊疗、用药的基本原则;已有的药学、临床前研究不符合临床试验要求;临床试验方案整体设计严重缺陷,风险控制措施不足;联合用药的非临床研究数据不充分;联合疫苗中单苗的数据不充分和/或免疫程序不一致。
NDA研发和申报中存在的问题主要有:研究质量控制和管理存在缺陷,导致已有的研究结果不能证明药品安全性、有效性和质量可控性;违反合规性要求。具体表现包括:关键临床研究设计存在重大缺陷,无法得出客观、有力的有效性、安全性证据;药学研究存在严重缺陷,无法证明产品的质量可控性;各开发阶段的研究受试样品不一致;注册核查中发现临床试验数据存在真实性问题。
2.仿制药申请
仿制药一致性评价申请和上市申请中存在的问题主要有:仿制药研发立题不合理;申报资料无法证明仿制药与参比制剂(被仿制药品)的质量一致性。具体表现包括:仿制药的参比制剂已撤市,且已有更新换代安全性更好的产品满足临床需求;样品复核检验不符合规定或分析方法存在严重缺陷;人体生物等效性试验结果表明不等效;样品稳定性研究结果、原料药起始物料选择等不符合仿制药上市技术要求;仿制药未按规定使用具有合法来源的原料药。
3.补充申请
补充申请研究和申报中存在的问题主要有:申请资料未能充分说明变更的科学性和合理性,不足以支持变更事项;已有的研究结果不能保证变更后产品的安全性、有效性和质量可控性。具体表现包括:变更引起药用物质基础发生重大改变;药品说明书修改申请不符合说明书撰写的技术要求;用于支持变更的文献资料存在偏倚,或者临床安全性和有效性数据不充分。
4.其他
其他药品注册申请在研发和申报中存在的问题主要有:生物类似药开发缺少相似性比较数据,药学比对研究中参照药选择存在缺陷;生物类似药临床前研究结果不足以支持其开展临床试验;天然药物的研究资料不符合国际多中心临床试验或中国天然药物评价基本技术要求。
(七)药品加快上市注册程序情况
创新是推动药品高质量发展的力量源泉,《药品注册管理办法》结合中国医药产业发展和临床需求实际,参考国际经验,设立了特别审批、突破性治疗药物、附条件批准、优先审评审批四个药品加快上市程序。《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号),明确了加快通道的适用范围、适用条件、工作程序和政策支持等,既能显著提高相关程序执行过程中的可操作性,鼓励药物研制和创新,又能在全球抗击疫情的大背景下,依法依规对疫情防控所需药物实行特别审批,对于加快临床急需、临床价值突出、公共卫生急需等药物的上市具有重要推动作用。2020年已批准上市药品纳入加快上市程序情况详见附件4。
1.特别审批药物情况
在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,国家药监局可依法决定对突发公共卫生事件应急所需防治药品实行特别审批。纳入实施特别审批程序的药物,国家药监局按照统一指挥、早期介入、快速高效、科学审批的原则,组织加快并同步开展药品注册受理、审评、核查、检验工作,并根据疾病防控的特定需要,限定其在一定的期限和范围内使用。
2020年新冠肺炎疫情在全球范围内不断蔓延,人民群众的生命安全受到严重威胁,药审中心闻令而动,第一时间科学、高效推进特别审评工作,按程序将59件中药、化学药、生物制品注册申请纳入特别审批程序并完成技术审评。建议附条件批准上市1件,为新型冠状病毒灭活疫苗(Vero细胞);建议批准临床试验申请53件,其中5件已进入3期临床试验,批准化湿败毒颗粒、清肺排毒颗粒的临床试验申请;批准了连花清瘟胶囊/颗粒、金花清感颗粒及血必净注射液等5件增加适应症的补充申请,加速了新冠病毒疫苗和新冠肺炎治疗药物的上市进程,初步满足了新冠肺炎疫情防控的需要。
2.突破性治疗药物情况
突破性治疗药物指的是用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可在1、2期临床试验阶段申请适用突破性治疗药物程序。根据《突破性治疗药物审评工作程序(试行)》,纳入到“突破性治疗”审评通道的药物,药审中心一是会优先处理相关沟通交流,加强指导并促进药物研发进程;二是在申报上市环节,该药物可适用优先审评审批程序,审评时限进一步缩短;三是上市申请阶段,药审中心会滚动接收其申报资料,并优先安排核查、检验等,可大大缩减新药从研发到上市的时间。2020年药审中心收到147件突破性治疗药物申请。经综合评估、公示,已将24件突破性治疗药物申请(21个品种)纳入突破性治疗药物程序,详见附件5。
3.附条件批准药物情况
附条件批准上市,目的在于缩短药物临床试验的研发时间,使其尽早应用于无法继续等待的危重疾病或公共卫生方面急需的患者。药物有效性评价的指标为临床终点,符合附条件批准上市情形的药物,可使用替代终点、中间临床终点或早期临床试验数据来反映药物的有效性,当这些数据能够提示药品的获益大于风险时候,即可申请附条件批准上市。
对于若不尽早进行治疗则会在数月或者更短时间内导致死亡的疾病患者来说,附条件批准上市的药物,使得这些无法继续等待的患者能够延续生命、提高生存质量,消除重大突发公共卫生事件对于人民生命安全的威胁。2020年药审中心审评通过的新药上市申请中,共有15件注册申请经附条件批准后上市,覆盖了新型冠状病毒感染引起的疾病、非小细胞肺癌、卵巢癌等适应症。
4.优先审评药物情况
(1)优先审评品种纳入情况
《药品注册管理办法》对优先审评审批程序的调整,是在多年实践经验基础上的优化,一是适用范围更多地向具有明显临床价值、临床急需和临床优势的药物聚焦,致力于将更多的临床价值显著、临床急需的短缺药品、防治重大传染病、罕见病、儿童用药、纳入突破性治疗程序、符合附条件批准的药品等纳入优先审评程序;二是审评时限的加速,药品上市许可申请的审评时限一般为200个工作日,与完整的申报路径相比,优先审评审批程序的审评时限缩短至130个工作日,其中临床急需境外已上市罕见病用药优先审评审批程序的审评时限为70个工作日。药审中心通过优化审评资源配置率,在高标准完成技术审评的前提下,力争按时限完成审评,推动纳入优先审评审批程序中的品种尽快获批上市。
根据《药品注册管理办法》、46号公告、《国家食品药品监督管理总局关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号,以下简称126号文件),2020年药审中心将219件(按通用名计127个品种)注册申请纳入优先审评审批程序。其中,144件注册申请按照126号文件规定的范围纳入优先审评审批程序,75件按照《药品注册管理办法》规定的范围纳入优先审评审批程序,包括42件儿童用药和罕见病用药。2016-2020年纳入优先审评审批程序的各类注册申请情况详见表6和表7。
表6 2016-2019年纳入优先审评审批程序的各类注册申请情况

注:1.该表以受理号统计。
2.优先审评工作自2016年开始。
3.该表中注册申请纳入优先审评审批程序的依据为《国家食品药品监督管理总局关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管〔2016〕19号)、126号文件、46号公告。
4.比重=当年各类任务/任务总量,下同。
表7 2020年纳入优先审评审批程序的注册申请情况
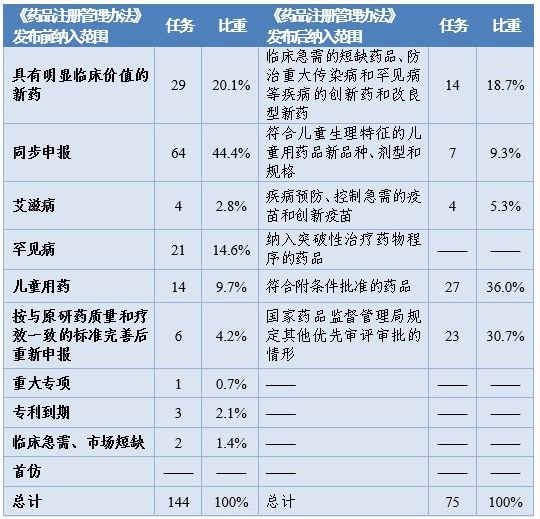
注:该表以受理号统计。
按此前优先审评范围纳入的注册申请中,同步申报占比多达44%(64/144),具有明显临床价值的新药占比为20%,按与原研药质量和疗效一致的标准完善后重新申报品种占比则由7.9%降至4.2%。
按照《药品注册管理办法》优先审评范围纳入的注册申请中,符合附条件批准的药品占比为36%(27/75),创新药和儿童用药占比28%(21/75),优先审评资源已向具有明显临床价值的创新、急需药物倾斜。
(2)优先审评品种完成情况
2020年有217件注册申请(按通用名计121个品种)通过优先审评程序建议批准上市(含已上市药品新增适应症),审评通过件数较2019年增长51.7%,例如:中国自主研发的1类创新药甲磺酸阿美替尼片、泽布替尼胶囊、奥布替尼片等,治疗罕见病法布雷病阿加糖酶α注射用浓溶液,用于配合饮食控制及运动治疗2型糖尿病的中药新药桑枝总生物碱片、间变性淋巴瘤激酶抑制剂盐酸恩沙替尼胶囊、成人复发型多发性硬化治疗药物西尼莫德片等。2016-2020年优先审评通过的品种情况详见表8。
表8 2016-2020年优先审评通过的品种情况
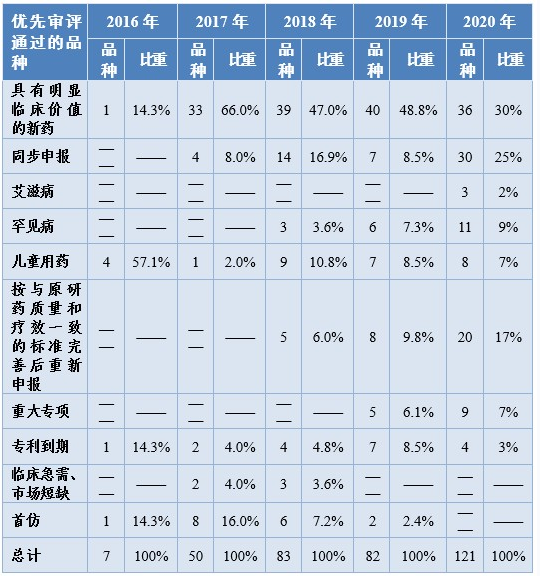
注:1.该表以品种数统计。
2.2016-2019年治疗艾滋病的药物均被纳入“具有明显临床价值的新药”的分类中进行统计。
(八)药品注册现场核查相关情况
1.总体情况
药审中心积极落实《药品注册管理办法》,转变药品注册核查理念,将注册现场核查启动工作模式由基于审评需要调整为基于风险启动,并联开展技术审评与注册现场核查工作;对于自2020年7月1日起受理的注册申请,在受理后40个工作日内决定是否启动相应注册现场核查任务。为便于申请人及时获知注册现场核查启动相关信息,完善药审中心网站申请人之窗栏目,开通递交注册现场核查用生产工艺与质量标准通道和查收注册现场核查电子通知函的功能。
2.注册现场核查具体情况
2020年,药审中心基于品种因素和研发生产主体合规因素风险启动注册现场核查任务1235个。其中,药学现场核查任务792个,临床试验数据核查任务439个,药理毒理研究核查任务4个。
药审中心接收核查报告818份。其中,药学现场核查报告449份,临床试验核查报告363份,药理毒理研究核查报告6份。
(九)沟通交流情况
1.总体情况
2020年,药审中心在落实疫情防控要求的同时,尽量满足申请人的需要,全力保障各类沟通交流畅通。在推动新冠病毒疫苗和新冠肺炎治疗药物的研发方面,为79个新冠病毒疫苗,中医药、中和抗体(27个)等新冠肺炎治疗药物,组织申请人与药审中心审评团队之间的沟通交流5600余次,并针对新冠病毒疫苗、中和抗体等重点品种,单独设立了台账,动态跟进;在维护与申请人沟通桥梁方面,药审中心发布了《药物研发与技术审评沟通交流管理办法》《药审中心关于业务咨询服务联络方式的通知》,优化了电话咨询服务,每天有专人接听解答申请人咨询电话,根据咨询问题类型的不同设立了8个联系邮箱,及时解答处理申请人问题,不断提高沟通交流的质量和效率。
药审中心接收沟通交流会议申请3229件,较2019年增长22.64%,办理沟通交流会议申请2451件,较2019年增长31.00%。在网络平台接收一般性技术问题咨询20285个,较2019年增长22.41%;接收电话咨询超过上万次,邮件咨询数千件,同时也面向社会提供现场咨询服务。2016-2020年接收沟通交流申请和一般性技术问题咨询具体情况详见图16。
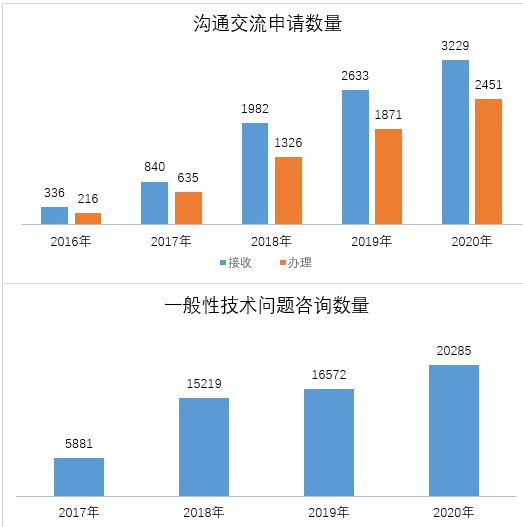
▲ 图16 2016-2020年接收沟通交流申请和一般性技术问题咨询具体情况
注:一般性技术咨询平台自2017年上线运行
2.沟通交流会议申请的完成情况
药审中心所接收的3229件沟通交流会议申请中,符合会议召开条件的,及时与申请人取得了联系,商议会议细节;无需召开会议的,以书面形式尽快回复了申请人。2020年共办理了2451件沟通交流会议申请。在药物研发关键阶段召开的Ⅱ类会议占比76.42%,其中临床前(Pre-IND)申请占比37.49%。2020年各类沟通交流会议申请及办理情况详见表9。
表9 2020年各类沟通交流会议申请及办理情况
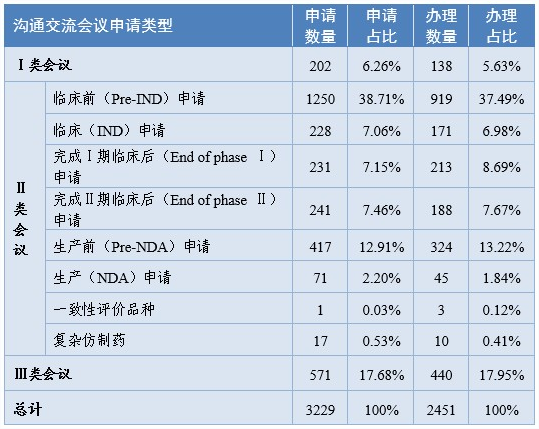
注:2020年办理的申请中,有部分为2019年提交的申请。
沟通交流会议的形式为电话会议、视频会议、面对面会议,共召开沟通交流会议268次,以书面形式回复两千余件。2018-2020年各类沟通交流会议的召开情况详见表10。
表10 2018-2020年各类沟通交流会议召开情况

3.一般性技术问题答复情况
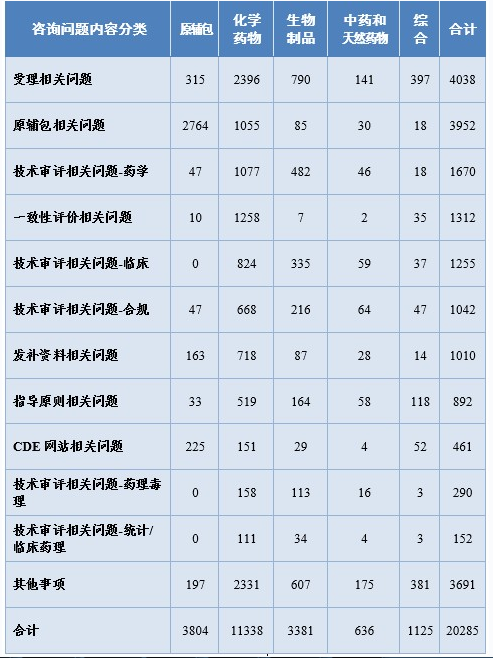
药审中心通过网上咨询平台共接收了20285个一般性技术问题的咨询。按照内容分类,问题主要集中于受理(4038个)、原辅包(3952个)等方面;按照药品分类,问题主要集中于化学药(11338个)方面,其中化学药受理(2396个)、化学药一致性评价(1258个)。一般性技术问题答复具体情况详见表11。
表11 一般性技术问题答复具体情况
二、药品注册申请受理情况
(一)总体情况
2020年,根据46号公告、《国家药监局关于发布生物制品注册分类及申报资料要求的通告》(2020年第43号)、《国家药监局关于发布化学药品注册分类及申报资料要求的通告》(2020年第44号)、《国家药监局关于发布<中药注册分类及申报资料要求>的通告》(2020年第68号)等,药审中心受理中药、化学药、生物制品各类注册申请共10245件(含药械组合产品6件),较2019年增长26.76%。其中,需技术审评的注册申请7147件(含5695件需药审中心技术审评和行政审批的注册申请),较2019年增长15.29%;直接行政审批的注册申请3092件,较2019年增长64.64%。
受理的10239件药品注册申请中,化学药注册申请受理量为7901件,较2019年增长22.02%,占2020年全部注册申请受理量的77.17%,2016-2020年各类药品注册申请受理情况详见图17。

▲ 图17 2016-2020年各类药品注册申请受理情况
注:1.2019-2020年受理量中含药械组合产品的注册申请,故上图中2019-2020年受理注册申请总量大于中药、化学药、生物制品受理注册申请之和;
2.药审中心的直接行政审批工作自2017年开始,故2016年无直接行政审批注册申请,所有受理注册申请均需技术审评。
2020年受理的需技术审评的注册申请7147件中,化学药注册申请为5402件,较2019年增长9.42%,占全部需技术审评的注册申请受理量的75.58%;中药注册申请315件,较2019年增长22.57%;生物制品注册申请1430件,较2019年增长42.29%。2016-2020年需技术审评的中药、化学药、生物制品各类注册申请受理情况详见图18。
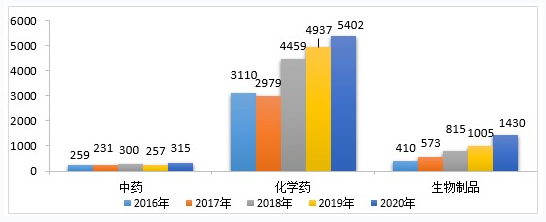
▲ 图18 2016-2020年需技术审评的中药、化学药、生物制品各类药品注册申请受理情况
(二)1类创新药受理情况
2020年,药审中心受理1类创新药注册申请共1062件(597个品种),较2019年增长51.71%。其中,受理IND申请1008件(559个品种),较2019年增长49.78%;受理NDA 54件(38个品种),较2019年增长100.00%。以药品类别统计,中药、化学药、生物制品1类创新药受理量分别为14、752、296件。以生产场地统计,境内生产药品843件,境外生产药品219件。详见表12和13。
表12 中药、化学药、生物制品1类创新药的受理情况
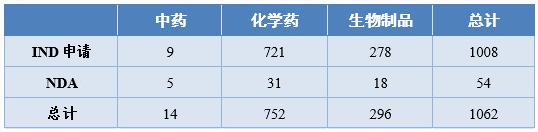
表13 境内、外生产的1类创新药受理情况

(三)各类注册申请受理情况
1.中药注册申请受理情况
2020年,药审中心受理中药注册申请471件。其中,受理中药IND申请22件,受理中药NDA 6件,受理中药ANDA 1件。2020年中药各类注册申请受理情况详见图19。
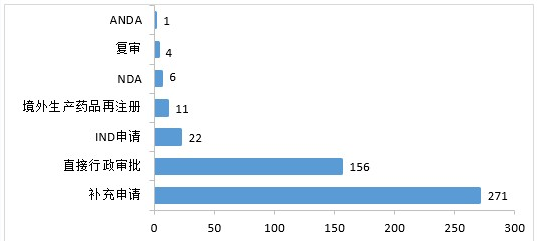
▲ 图19 2020年中药各类注册申请受理情况
受理1类中药创新药注册申请14件。其中,受理IND 申请9件(9个品种),受理NDA 5件(5个品种)。
2.化学药注册申请受理情况
2020年,药审中心受理化学药注册申请7901。其中,受理化学药IND申请946件,较2019年增长36.31%;受理化学药NDA 191件,较2019年增长46.92%;受理ANDA 1125件,较2019年增长7.45%;受理一致性评价申请914件,较2019年减少11.95%。2020年化学药各类注册申请受理情况详见图20。2016-2020年化学药各类注册申请受理情况详见图21。

▲图20 2020年化学药各类注册申请受理情况
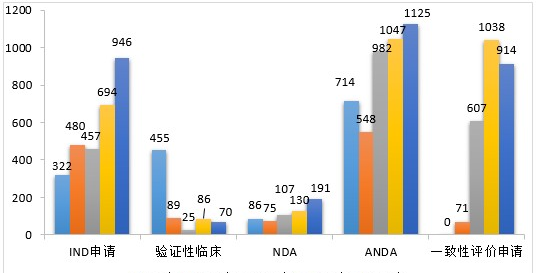
▲图21 2016-2020年化学药各类注册申请受理情况
药审中心受理1类创新化学药注册申请752件(360个品种),较2019年增长31.24%。其中,受理IND申请721件(339个品种),较2019年增长30.62%;受理NDA 31件(21个品种),较2019年增长47.62%。
药审中心受理化学药5.1类注册申请160件,较2019年增长1.91%。其中受理临床试验申请(验证性临床)53件,受理NDA 107件。
360个品种的1类创新化学药注册申请中,境内生产化学药注册申请为258个品种,境外生产化学药注册申请为102个品种。2016-2020年1类创新化学药注册申请受理情况详见图22。

▲ 图22 2016-2020年1类创新化学药注册申请受理情况(以品种计)
3.生物制品注册申请受理情况
2020年,药审中心受理生物制品注册申请1867件。其中,受理生物制品IND申请580件(预防用IND申请25件,治疗用IND申请555件),较2019年增长87.10%;受理生物制品NDA 126件(预防用NDA 7件,治疗用NDA 117件,体外诊断试剂2件),较2019年增长1.62%。2020年生物制品各类注册申请受理情况详见图23。2016-2020年生物制品IND申请和NDA受理情况详见图24。
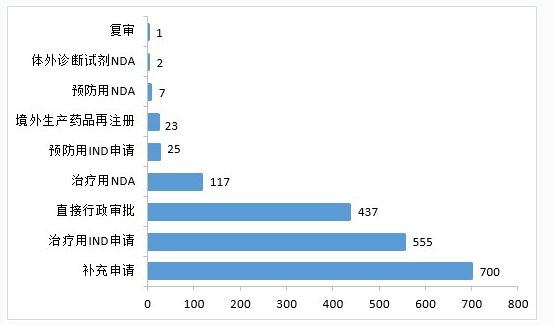
▲图23 2020年生物制品各类注册申请受理情况

▲ 图24 2016-2020年生物制品IND申请和NDA受理情况
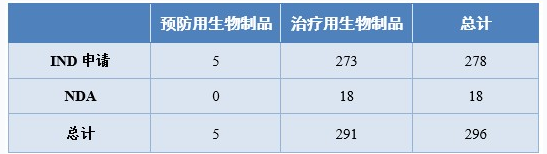
药审中心受理1类创新生物制品注册申请296件(223个品种),较2019年增长133.07%。其中,受理预防用生物制品5件,受理治疗用生物制品291件;受理生物制品IND申请278件(211个品种),较2019年增长129.75%;受理生物制品NDA 18件(12个品种),较2019年增长200.00%,具体情况详见表14。
表14 1类创新生物制品创新药注册申请受理具体情况
4.行政审批注册申请受理情况
(1)总体情况
2020年,药审中心受理需中心行政审批的中药、化学药、生物制品各类注册申请8787件,较2019年增长29.51%。其中,受理需审评审批的注册申请(临床试验申请、一致性评价申请、补充申请、境外生产药品再注册及复审)5695件,较2019年增长16.06%;受理直接行政审批的注册申请(无需技术审评的补充申请、临时进口申请)3092件,较2019年增长64.64%。2020年行政审批注册申请受理的具体情况详见表15。2016-2020年行政审批注册申请受理情况详见图25。
表15 2020年行政审批注册申请受理的具体情况

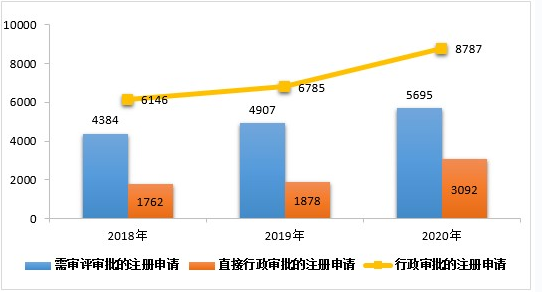
▲ 图25 2018-2020年行政审批注册申请受理情况
(2)需审评审批的注册申请受理情况
药审中心受理5695件需审评审批的注册申请中,临床试验申请1618件(含验证性临床)、一致性评价申请914件、补充申请2827件、境外生产药品再注册328件、复审8件。
(3)直接行政审批的注册申请受理情况
药审中心受理3092件直接行政审批的注册申请中,按申请类型划分,补充申请2644件、临时进口申请448件。按药品类型划分,中药156件、化学药2499件、生物制品437件。
三、重点治疗领域品种
新冠病毒疫苗和新冠肺炎治疗药物:
1.新型冠状病毒灭活疫苗(Vero细胞),为中国首个附条件批准的新冠病毒疫苗,也是全球首个新冠病毒灭活疫苗。适用于18岁及以上人群预防由新型冠状病毒(SARS-CoV-2)感染引起的疾病。
2.“三药”品种,为《新型冠状病毒肺炎诊疗方案(试行)》推荐药物,即连花清瘟颗粒/胶囊、金花清感颗粒和血必净注射液。连花清瘟颗粒/胶囊和金花清感颗粒新增适应症用于在新型冠状病毒肺炎的常规治疗中的轻型、普通型引起的发热、咳嗽、乏力,血必净注射液新增适应症用于新型冠状病毒肺炎重型、危重型的全身炎症反应综合征或/和多脏器功能衰竭,其获批上市充分发挥了中医药在疫情防控中的作用。
3.注射用西维来司他钠,为中性粒细胞弹性蛋白酶选择性抑制剂,适用于改善伴有全身性炎症反应综合征的急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS),是全球唯一用于ALI/ARDS的药物,其获批上市填补了中国ALI/ARDS药物治疗领域的空白,为中国呼吸系统危重症患者提供用药选择。
抗肿瘤药物:
4.甲磺酸阿美替尼片,为中国首个具有自主知识产权的第三代靶向表皮生长因子受体(EGFR)小分子酪氨酸激酶抑制剂(TKI)创新药物,适用于治疗既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌。本品疗效突出,脑转移病灶控制良好,其获批上市将显著改善该疾病治疗药物的可及性。
5.索凡替尼胶囊,为多靶点、抗血管生成口服小分子酪氨酸激酶抑制剂,是中国首个用于治疗无法手术切除的局部晚期或转移性、进展期非功能性、分化良好(G1、G2)的非胰腺来源的神经内分泌瘤的创新药物。本品疗效突出,显著降低了此类患者的疾病进展和死亡风险,其获批上市填补了该疾病治疗领域的空白。
6.注射用维布妥昔单抗,为全球首个CD30靶点抗体偶联药物(ADC),也是中国首个用于恶性淋巴瘤患者的ADC药物,适用于治疗复发或难治性的系统性间变性大细胞淋巴瘤和经典型霍奇金淋巴瘤,本品获批上市为改善中国此类患者的长期生存提供了有效的治疗手段。
7.注射用贝林妥欧单抗,为全球首个双特异性抗体(CD3和CD19靶点)药物,也是中国首个用于肿瘤适应症的双特异性抗体药物,适用于治疗成人复发或难治性前体B细胞急性淋巴细胞白血病。对于化疗失败的复发或难治性急性淋巴细胞白血病患者,与标准化疗相比,本品可显著延长患者生存期,其获批上市为中国此类患者提供了更好的治疗手段。
8.甲磺酸仑伐替尼胶囊,为多靶点、口服酪氨酸激酶抑制剂,是中国首个用于治疗进展性、局部晚期或转移性放射性碘难治性分化型甲状腺癌的小分子药物。本品疗效突出,其获批上市为中国此类患者提供了有效的治疗方案,填补了该治疗领域的空白。
抗感染药物:
9.盐酸可洛派韦胶囊,为非结构蛋白5A(NS5A)抑制剂,是中国具有自主知识产权的广谱、直接抗丙肝病毒创新药物,适用于与索磷布韦联用治疗初治或干扰素经治的基因1、2、3、6型成人慢性丙型肝炎病毒感染,可合并或不合并代偿性肝硬化,本品获批上市为中国慢性丙肝患者提供了一种新的治疗选择。
10.恩曲他滨替诺福韦片,增加适应症用于降低成人和青少年(体重至少在35 kg以上)通过高风险性行为获得HIV-1的风险,是中国首个用于暴露前预防HIV的药物。HIV感染是重大公共卫生问题,本品获批上市对于控制HIV传播具有重大意义。
循环系统药物:
11.拉那利尤单抗注射液,为全人源化单克隆抗体(IgG1/K-轻链),是中国首个用于12岁及以上患者预防遗传性血管性水肿(HAE)发作的药物。HAE疾病反复发作,近半数患者可出现上呼吸道黏膜水肿引发窒息而危及生命,本品获批上市为中国HAE患者预防发作提供了安全有效的治疗手段。
12.氯苯唑酸软胶囊,为转甲状腺素蛋白(TTR)稳定剂,适用于治疗转甲状腺素蛋白淀粉样变性心肌病,以减少心血管死亡及心血管相关住院。该疾病是一种致命性疾病,属罕见病,本品为中国首个针对该病病因治疗的药物,其获批上市为中国此类患者提供了新的治疗手段。
呼吸系统药物:
13.苯环喹溴铵鼻喷雾剂,为胆碱能受体拮抗剂,为中国首个具有自主知识产权用于变应性鼻炎的鼻用抗胆碱创新药物,适用于改善变应性鼻炎引起的流涕、鼻塞、鼻痒和喷嚏症状,本品其获批上市可为中国此类患者提供新的治疗选择。
14.乙磺酸尼达尼布软胶囊,为小分子酪氨酸激酶抑制剂,具有抗纤维化作用,增加适应症用于治疗系统性硬化病相关间质性肺疾病(SSc-ILD)和具有进行性表型的慢性纤维化性间质性肺疾病(PF-ILD)。目前可用于SSc-ILD和PF-ILD的有效治疗方式有限,临床用药需求迫切,本品获批新增适应症可以填补该治疗领域空白,为中国此类患者提供药物选择。
神经系统药物:
15.氘丁苯那嗪片,为囊泡单胺转运蛋白2(VMAT2)抑制剂,是中国首个用于治疗与罕见病亨廷顿病有关的舞蹈病、迟发性运动障碍的药物,属临床急需境外新药名单品种,本品获批上市满足了中国此类患者迫切的临床需求。
16.氯苯唑酸葡胺软胶囊,为转甲状腺素蛋白(TTR)稳定剂,是中国首个用于治疗成人转甲状腺素蛋白淀粉样变性多发性神经病I期症状患者、延缓周围神经功能损害的药物,属临床急需境外新药名单品种,其获批上市改变了该病无药可治的局面。
镇痛药及麻醉科药物:
17.环泊酚注射液,为GABAA受体激动剂,是用于消化道内镜检查中镇静的创新药物。本品与临床常用麻醉镇静药物丙泊酚具有相似的药理机制,但具有起效快,注射痛少,呼吸抑制轻,恢复速度快等优势特征,其获批上市可为中国消化内镜检查操作用药提供新的选择。
皮肤五官药物:
18.塞奈吉明滴眼液,为中国首个用于治疗神经营养性角膜炎(NK)的重组人神经生长因子(rhNGF)药物,属临床急需境外新药名单品种。NK为罕见的退行性角膜疾病,可致盲,中重度NK手术治疗为侵入性操作,费用高且不能永久治愈,本品获批上市为中国此类患者提供了有效的治疗药物,预计将成为中重度NK患者的首选治疗。
19.度普利尤单抗注射液,为重组人免疫球蛋白-G4单克隆抗体,适用于治疗外用处方药控制不佳或不建议使用外用处方药的成人中重度特应性皮炎,属临床急需境外新药名单品种。与现有治疗方式相比,本品有明显临床优势,其获批上市为此类难治性严重疾病患者提供了治疗选择。
消化系统药物:
20.注射用维得利珠单抗,为作用于人淋巴细胞整合素α4β7的人源化单克隆抗体,适用于治疗对传统治疗或肿瘤坏死因子α(TNF-α)抑制剂应答不充分、失应答或不耐受的中度至重度活动性溃疡性结肠炎、克罗恩病,属临床急需境外新药名单品种。此类疾病存在迫切的临床治疗需求,特别是对于TNF-α拮抗剂治疗失败的患者,本品获批上市可为临床提供新的治疗选择。
外科药物:
21.注射用丹曲林钠,适用于预防及治疗恶性高热(MH),是目前唯一短时间内给药可改变该疾病转归的药物。MH临床结局危重,死亡率高,其获批上市可改变目前中国MH无安全有效治疗手段的现状,满足迫切临床需求。
22.他克莫司颗粒,适用于预防儿童肝脏或肾脏移植术后的移植物排斥反应,治疗儿童肝脏或肾脏移植术后应用其他免疫抑制药物无法控制的移植物排斥反应,属儿童用药,本品获批上市可极大解决中国儿科肝肾移植患者未满足的临床需求。
罕见病药物:
23.注射用拉罗尼酶浓溶液,为中国首个用于罕见病黏多糖贮积症I型(MPS I,α-L-艾杜糖苷酶缺乏症)的酶替代治疗药物,属临床急需境外新药名单品种。黏多糖贮积症I型是一种严重危及生命且中国尚无有效治疗手段的遗传性罕见病,已列入中国第一批罕见病目录,本品获批上市填补了中国此类患者的用药空白。
24.艾度硫酸酯酶β注射液,为中国首个用于罕见病黏多糖贮积症Ⅱ型(MPS Ⅱ,亨特综合征)的酶替代治疗药物。黏多糖贮积症Ⅱ型是一种严重危及生命且中国尚无有效治疗手段的遗传性罕见病,已列入中国第一批罕见病目录,本品获批上市填补了中国此类患者的用药空白。
体内诊断试剂:
25.重组结核杆菌融合蛋白(EC),适用于6月龄及以上婴儿、儿童及65周岁以下成人结核杆菌感染诊断,并可用于辅助结核病的临床诊断,为全球首个用于鉴别卡介苗接种与结核杆菌感染的体内诊断产品,其获批上市为临床鉴别诊断提供了新的手段。
预防用生物制品(疫苗):
26.鼻喷冻干流感减毒活疫苗:为中国首家以鼻喷途径接种的疫苗,适用于3(36月龄)~17岁人群用于预防由疫苗相关型别的流感病毒引起的流行性感冒,接种后可刺激机体产生抗流感病毒的免疫力。
中药新药:
27.桑枝总生物碱片,其主要成分为桑枝中提取得到的桑枝总生物碱,是近10年来首个获批上市的抗糖尿病中药新药,适用于配合饮食控制及运动、治疗2型糖尿病。本品可有效降低2型糖尿病受试者糖化血红蛋白水平,其获批上市为2型糖尿病患者提供新的治疗选择。
28.筋骨止痛凝胶,为醋延胡索、川芎等12种药味组成的中药复方新药,适用于膝骨关节炎肾虚筋脉瘀滞证的症状改善,具有“活血理气,祛风除湿,通络止痛”的功效。本品为外用凝胶制剂,药物中各成分通过透皮吸收而发挥作用,可避免肠胃吸收和肝脏首过代谢,其获批上市可为膝关节骨性关节炎患者提供新的治疗选择。
29.连花清咳片,为麻黄、桑白皮等15种药味组成的中药新药,适用于治疗急性气管-支气管炎痰热壅肺证引起的咳嗽、咳痰等,具有“宣肺泄热,化痰止咳”的功效,其获批上市可为急性气管-支气管炎患者提供新的治疗选择。
四、全力做好应急审评工作
(一)加强统一领导,制定工作程序
按照国家药监局党组关于疫情防控应急审评审批工作部署,药审中心闻令而动,一是充分发挥集体决策作用,迅速成立抗新型冠状病毒药物特别审评领导小组,抽调16个部门148名骨干力量为工作小组成员,先后召开特别审评领导小组会议6次和领导小组专题会18次,明晰工作原则,优化工作流程,及时研究解决应急审评过程中遇到的问题,保证工作顺利推进、有序开展。二是制定工作程序,形成1个方案、2个程序、1个规范,即《药审中心抗新型冠状病毒药物特别审评工作方案》《关于新型冠状病毒(2019-nCoV)药物立项申请评议工作程序》《关于新型冠状病毒(2019-nCoV)药物特别专家组评估和审核工作程序》《国家药监局抗新型冠状病毒药物专家会议管理规范》。三是严格落实“安全守底线、疗效有证据、质量能保证、审评超常规”的工作要求,按照工作程序,依法依规、科学规范审评,标准不降,加速审批。
(二)发挥专家作用,解决技术难题
一是组建特别专家组。按照《国家食品药品监督管理局药品特别审批程序》(原国家食品药品监督管理局令第21号)规定和国家药监局新型冠状病毒感染肺炎疫情应对工作组药品组的决定,药审中心先后遴选出多位院士和知名专家组成了特别专家组,经国家药监局批准后开展工作。遇到新的技术难点问题时,听取专家意见建议后,由专家投票表决。二是注重发挥专家技术支撑作用。通过专家研讨会和专家咨询会解决特定技术问题,例如针对mRNA新冠病毒疫苗在研发上存在的难点和潜在的风险,药审中心组织专家形成技术指导原则,以指导相关企业的研发。
(三)实时高效沟通,提高研发进度
一是遵循“早期介入、持续跟进、主动服务”的工作要求,第一时间组织审评力量对咨询品种或注册申请立项的科学性和可行性进行评议,并在24小时内与申请人进行沟通交流,保证申请人尽快提交特别审批注册申请。二是加强国际合作。积极参加世界卫生组织(WHO)、国际药品监管机构联盟(ICMRA)等组织召开的视频电话会议,共同探讨研发审评标准,了解新冠病毒疫苗研发信息,指导推动研发企业赴国外开展3期临床试验。
(四)探索研审联动,坚持科学审评
一是探索建立研发审评联动工作机制。边研发、边提交、边审评,为新冠病毒疫苗研发争取到了宝贵时间,确保新冠病毒疫苗等研发走在世界前列。通过这种工作机制,大大缩短了审评时间。二是建立技术标准体系。针对新冠病毒的特点,及时制定新冠病毒疫苗、新冠肺炎治疗药物研发技术指导原则等28个技术文件,指导企业高标准研发,少走弯路,科学开展审评。
五、鼓励中药传承创新发展
贯彻落实习近平总书记关于中医药的重要指示精神、《中共中央 国务院关于促进中医药传承创新发展的意见》及国家药监局要求,药审中心从改革中药注册分类、健全中药技术指导原则等各方面积极鼓励中药守正创新。一是推动中药的传承发展。起草并由国家药监局发布《中药注册分类及申报资料要求》,丰富古代经典名方复方制剂的范围,促进古代经典名方中药复方制剂研发,推动其向新药转化。二是建立完善符合中药特点的质量控制体系。遵循中药特点和研发规律,将中药独特的理论体系和实践特点、中药制剂质量控制特点与药品质量控制的一般要求有机结合,研究构建完善符合中药制剂特点的质量控制方法和策略,制定《中药新药用饮片炮制研究指导原则(试行)》《中药新药质量标准研究技术指导原则(试行)》《中药复方制剂生产工艺研究技术指导原则(试行)》《中药生物效应检测研究技术指导原则(试行)》等8个技术指导原则。三是健全符合中药特点的审评体系。引入新工具、新方法、新标准用于中药疗效评价,细化申报资料要求,制定《中药新药用于慢性便秘临床研究技术指导原则》《中药新药用于糖尿病肾病临床研究技术指导原则》等技术指导原则,探索构建中医药理论、人用经验和临床试验相结合的审评证据体系。四是全力做好中药特别审评工作。充分发扬抗疫精神,制定了《用于新冠肺炎中药注册申请特别审批申报资料要求(试行)》《用于新冠肺炎中药注册申请特别审批技术指导原则(试行)》等,指导应急状态下的中药审评。截至2020年12月31日,“三方”中的清肺排毒颗粒、化湿败毒颗粒的IND申请已获批准,“三药”连花清瘟颗粒/胶囊、金花清感颗粒、血必净注射液获批增加用于治疗新冠肺炎的适应症。五是赴武汉开展实地调研和座谈,持续推进中药监管科学“以临床价值为导向的中药安全性评价研究”课题研究。六是开展援疆援藏工作,赴西藏开展实地调研、与新疆维吾尔自治区药品监督管理局召开线上座谈交流会,支持民族药发展。
六、加强《药品注册管理办法》配套文件制修订
新修订的《药品注册管理办法》是贯彻党中央、国务院审评审批制度改革精神和落实新修订《药品管理法》的重要规章,考虑到药品注册管理中的具体技术要求,需要跟随技术发展的脚步不断调整完善,在规章中不适宜作出具体的规定,因此这些具体技术要求在《药品注册管理办法》发布后,以配套文件、技术指导原则等形式发布,既能更好地顺应药品研发的科学规律,也能确保新旧《药品注册管理办法办法》的平稳过渡和新《药品注册管理办法》的顺利实施。
根据国家局部署,药审中心统筹协调,加大配套文件的制修订力度,成立课题组,对重点难点问题开展调研攻关,充分听取专家、业界意见,力求达成共识,共参与了48个配套文件制修订工作,其中牵头起草配套文件30个。自开展工作以来,已基本完成配套文件公开征求意见工作,部分文件已经国家局审核同意后发布实施,有效确保了各项审评任务不断、不散、不乱,新旧注册相关规定的顺利过渡和实施。
七、加快审评技术标准体系建设
在药品审评和研发过程中,指导原则兼具监管依据和技术要求的双重职能。《药品注册管理办法》明确从事药物研制和药品注册活动,应当遵守有关法律、法规、规章、标准和规范;药审中心等专业技术机构,应当根据科学进展、行业发展实际和药品监督管理工作需要制定技术指导原则和程序,并向社会公布。
药品技术指导原则体系的建立与完善,是落实“四个最严”要求的最好实践,是药审中心推进审评体系和审评能力现代化的重要举措。药审中心通过“定标准、定程序、定计划”三步走的方式,统筹规划以指导原则为核心的审评标准体系建设,围绕药品研发需求和鼓励创新的原则,对标国际先进监管机构技术标准,加大指导原则制定和公开力度。2020年共开展了119个技术指导原则制修订工作,根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,截至2020年12月31日,药审中心已经国家药监局审查同意发布了71个指导原则,详见附件6。
在应对新型冠状病毒肺炎、促进新冠病毒疫苗和新冠肺炎治疗药物的研发和审评质量、速度方面,药审中心发布了《新型冠状病毒预防用疫苗研发技术指导原则(试行)》等7个指导原则;在着力提升中药材质量研究,鼓励中药研发与创新方面,发布了《中药新药用药材质量控制研究技术指导原则(试行)》《中药复方制剂生产工艺研究技术指导原则(试行)》《中药新药用于慢性便秘临床研究技术指导原则》等10个指导原则;在鼓励儿童药物研发方面,发布了《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》等3个指导原则;在支持抗肿瘤药物研发,进一步满足申请人对具体抗肿瘤药物的个药指导原则需求方面,发布了《抗肿瘤药联合治疗临床试验技术指导原则》《注射用曲妥珠单抗生物类似药临床试验指导原则》等22个指导原则;在提高仿制药质量,推进仿制药一致性评价方面,规范审评标准和尺度,发布了《化学药品注射剂仿制药质量和疗效一致性评价技术要求》《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》等9个指导原则。这些指导原则覆盖新冠应急审评标准、儿童用药、中药民族药技术标准体系、抗肿瘤药物研发及仿制药研发等热点难点问题,持续完善药品技术指导原则体系,有效推动药物研发创新,不断优化统一审评尺度,大力提升审评质量和效率,显著减少审评自由裁量权。
八、持续深化药品审评审批制度改革
(一)加快境外已上市临床急需新药审评
深入贯彻国务院常务会议精神,落实加快境外已上市临床急需新药审评要求,在确定了第一二批74个品种名单的基础上,国家药监局、国家卫生健康委组织有关专家研究论证,遴选临床急需新药品种,药审中心发布了第三批7个品种名单。对于符合《国家药品监督管理局 国家卫生健康委员会关于临床急需境外新药审评审批相关事宜的公告》(2018年第79号)规定情形的品种,国家药监局会同国家卫生健康委已组织进行了充分遴选,基本解决了临床急需境外已上市新药在中国上市速度较慢的问题,进一步提高了公众用药的可及性。
2020年,药审中心完成了13个用于治疗罕见病的、临床急需的药品的技术审评,均在规定时限内完成,罕见病药品在3个月之内完成审评,其他临床急需药品在6个月之内完成审评,大大缩短了临床急需境外新药在中国上市的时间差距。截至2020年12月31日,已发布的三批81个品种临床急需境外已上市新药中,已有38家企业的48个品种提出注册申请,其中39个品种已获批上市或完成审评,100%在时限内完成审评工作,详见附件7。
(二)加速推动仿制药一致性评价工作
2020年,药审中心采取切实有效措施加速推进仿制药一致性评价工作。
一是在口服固体制剂一致性评价工作的基础上,积极推进注射剂一致性评价工作。国家药监局于5月12日发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》(2020年第62号),正式启动注射剂一致性评价工作。药审中心发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》和《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》等技术要求。针对正式启动前已有620件待审评的注射剂一致性评价申请,药审中心成立专项审评工作组,采取细化分类处理措施,严格执行一次性发补,明确注射剂一致性评价注册检查的随机原则,加快审评速度,在不到5个月的时间内完成了620件品种的审评,一致性评价按时限审评已进入常态化。
二是继续规范参比制剂遴选工作,强化服务与指导。药审中心发布《化学仿制药参比制剂遴选申请资料要求》(药审中心通告2020年第32号),进一步强调申请人的自查环节,提高参比制剂遴选工作效率。通过进一步规范内部审核、专家委员会审核等流程,2020年优化了参比制剂遴选工作。自2017年8月开展一致性评价工作以来共发布参比制剂目录35批,涉及3963个品规(1703个品种),其中包括注射剂参比制剂975个品规(405个品种)。
三是加强信息公开和培训。2020年7月举办线上化学仿制药注射剂一致性评价技术研讨会,对注射剂一致性评价技术要求、特殊注射剂技术要求、参比制剂申请资料要求等进行宣讲。
四是持续推进生物等效性试验备案工作。2020年化学药生物等效性试验备案平台共收集了672条记录,仿制药一致性评价生物等效性试验备案平台共收集了292条记录。
(三)全面落实临床试验期间风险管理
为落实《药品管理法》《药品注册管理办法》中有关临床试验期间安全风险管理工作,药审中心在国家药监局指导下,发布了《药物临床试验期间安全信息评估与管理规范(试行)》、《研发期间安全性更新报告管理规范(试行)》和《药物临床试验登记及信息公示管理规范(试行)》3个配套文件。为进一步加强临床试验过程的安全信息监测、识别、评估和风险控制,制定了《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》,上线运行“临床试验期间安全风险管理系统”,对临床试验期间的安全信息,如可疑且非预期严重不良反应(SUSAR)和研发期间安全性更新报告(DSUR)等开展全过程信息系统化的风险评估。
2020年药审中心接收来自全球SUSAR个例报告164403份(涉及病例为57995例)。其中,来自中国的SUSAR个例报告17243份(涉及病例为4647例);接收DSUR共计1775份;完成临床试验登记2610项(含新冠病毒疫苗和新冠肺炎治疗药物)。对18个药物临床试验中存在的安全性风险,提出了进一步的风险控制处理意见,包括一般风险控制(如修改临床试验方案、修改知情同意书、修改研究者手册、补充完善风险控制措施)和建议申请人主动暂停临床试验等。
面对突如其来的严重新冠肺炎疫情,药审中心探索建立了申请人进行临床试验进展信息报告机制与通道,规范了相关工作程序与技术要求,发布了《新冠肺炎疫情期间药物临床试验管理指导原则(试行)》,制定了规范统一的《应急审批品种临床试验进展和安全监测工作文件》。通过每日和每周的动态风险沟通交流,实施有效的风险监测与风险控制。对2020年2月2日至2020年12月31日经特别审批程序批准15个疫苗、16个生物制品、6个化学药、2个中药的临床试验共39个品种实施动态安全监测,完成了应急审批新冠病毒疫苗及新冠肺炎治疗药物临床试验进展及安全性监测报告共195份。
药审中心参加《药物警戒质量管理规范》(GVP)的起草工作,撰写临床试验期间药物警戒相关内容和要求。完成《临床试验期间安全信息管理:国际医学科学组织理事会(CIOMS)VI工作组报告》的翻译与出版工作,召开“疫情期间临床试验管理及远程智能技术应用学术交流视频会议”,探索开展远程智能化临床试验的安全管理工作,稳步提升临床试验期间安全信息评估和风险管理能力。
(四)继续夯实审评科学基础建设
1.审评质量管理体系建设
发挥审评质量管理体系对药品审评工作持续有效运行的保障作用。一方面是应对新法律规章实施对审评业务工作带来的风险和挑战,结合《药品注册管理办法》及其配套文件要求,及时组织对《质量手册》等体系文件进行全面修订,加强药品审评业务与质量体系的结合;另一方面是应对新冠肺炎疫情对审评工作带来的影响,通过开展药审中心专项内部监督检查,充分锻炼药审中心内审员队伍,及时发现存在的风险并组织改进;同时持续开展年度满意度调查工作,收集国家药监局和申请人对药审中心在落实新注册相关要求、应对新冠肺炎疫情风险防控时的意见和建议,为提高审评质量和效率提供思路,发挥质量体系对各项工作的支持作用。
2.强化审评信息化建设
为确保各项审评改革工作执行过程中的规范化、标准化、数字化,药审中心大力推进信息化建设,依据《药品注册管理办法》和流程为导向的科学管理体系,以药品审评业务流程为基础,立足工作实际,对药品技术审评系统升级完善。新增发补前的专业审评问询和发补后的补充资料问询平台,优化沟通交流系统,加强审评期间与申请人的主动沟通交流,促进审评业务工作开展;新增异议处理审核和注册检验网络通道,调整优先审评审批系统,强化审核流程可操作性,保障审评审批工作顺利实施。开通受理网上预约通道,减少人员流动聚集,有效保障新冠肺炎疫情期间申请人受理业务的有序办理;增加突破性治疗药物程序,为鼓励创新和加快临床急需品种上市拓宽审评通道。通过信息化手段助力药品审评审批业务管理,强化网络信息安全保障,不断提升药品审评审批工作质量和效率。目前药审中心网站申请人之窗实名注册申请企业10674家,基本实现了药品、原料药、辅料、包材注册申请人网上业务办理的全覆盖。
(五)积极推进流程导向科学管理体系建设
以流程导向科学管理体系建设为抓手,不断推进药品审评体系和审评能力的现代化。按照前期工作计划,药审中心已全面铺开任务受理、任务分配、专业审评、综合审评、沟通交流、专家咨询、书面发补、核查检验共8个子课题的科学管理体系试点建设,并印发《药审中心关于运行药品专业审评流程导向科学管理体系有关问题的通知》等8个文件,制定科学管理体系制度制修订计划(含28项制度),截至2020年12月31日已完成14项。注重试点建设成果的信息化,将各项措施纳入审评信息系统,增强措施执行的刚性约束,提高了科学监管和智慧审评能力。
形成按季度汇报机制,定期组织汇报试点运行情况。建立了改革措施管理台账,纳入了58项需要监督的改革措施,按月度对每项改革措施实施的责任落实、进展情况、新问题和解决建议予以一体化动态管理。召开了试点推进座谈会、子课题结题座谈会,对各子课题试点进度、成效、问题等进行总结分析。建立了促进试点建设的长效运行机制,常态化、一体化推进科学审评、高效审评和廉洁审评。
(六)持续开展ICH工作
切实推进中国药品审评审批体系与国际接轨,参与ICH指导原则的国际协调。一是积极参与ICH议题协调工作,自原国家食品药品监督管理总局2017年加入ICH以来,已向36个ICH工作组派出了69名专家,2020年参与ICH工作组电话会437场。二是进一步推进ICH三级指导原则实施工作,国家药监局共发布了3个ICH指导原则适用及推荐适用公告。三是组织开展ICH指导原则培训工作,药审中心开展ICH指导原则线上培训共15场,主要围绕29个ICH指导原则的技术要点、实施现状、实施过程中可能存在的问题等内容进行宣贯。培训对象主要包括国家药监局相关司局、各直属单位、各省级药监局和省级药检机构的相关工作人员,共计2723人观看培训直播,4244人观看直播回放。四是召开ICH指导原则和协调议题研讨会,为广泛听取行业及学界专家意见,2020年药审中心共召开ICH中国专家研讨会15场,共计312人参会。
(七)加强审评队伍建设和管理
加强审评队伍建设,畅通审评员职业发展通道,开展主审审评员认定工作;完善聘期考核评价体系,加强员工聘期考核工作;开展补充性招聘,引进临床、统计等紧缺专业人才;加强员工培训,组织开展《药品注册管理办法》及配套文件系列讲座、实训、英语口语等培训。
九、加强服务指导、改进工作效率和作风
2020年,药审中心驰而不息强化作风建设,积极服务药品高质量发展新要求。
一是紧密围绕新冠肺炎疫情防控大局,超常规创新开展应急审评审批,加强审评服务保障,全力做好新冠病毒疫苗审评过程中的各项工作。面对新冠肺炎疫情对新冠病毒疫苗药物的急迫需求,药审中心坚持尊重科学规律,建立早期介入,持续跟踪,主动服务、研审联动的工作机制,始终保持24小时与企业畅通沟通的状态,无论多晚,即使是凌晨3-4点钟,都会第一时间反馈研发企业诉求,在推动境外临床试验上强化担当,在创新审评审批中挖潜增效,成功高效推动国药集团新冠病毒疫苗附条件批准上市和5个疫苗品种进入Ⅲ期临床试验,确保中国新冠病毒疫苗走在世界前列,及时有力支撑了疫情防控大局。同时贯彻落实习近平总书记坚持中西医结合、中西药并用的重要指示精神,主动对接临床救治中应用的“三药三方”生产企业和研发单位,积极做好有效中药方剂转化产品注册和临床试验申请技术指导,确保中药第一时间用于新冠肺炎患者救治。这些成果不仅确保了防疫的应急所需,还为常态化疫情防控准备了重要的战略资源,不仅提振了国人战胜疫情的信心,还为全球疫情防控贡献了中国力量。
二是强化服务申请人沟通交流。在新冠肺炎疫情防控常态化的情况下,全面落实新冠肺炎疫情联防联控措施,最大限度减少人员流动聚集,阻断疫情传播扩散渠道,切实保障申请人的生命安全和身体健康,暂停现场咨询业务的同时开通了电话咨询业务。增设立了8个联系邮箱,申请人可以邮件咨询问题并提供在审品种受理号等信息,项目管理人员将在3个工作日内与该受理号相关的申请人进行联系。通过不断丰富和拓展沟通交流的渠道和方式,服务和便利申请人;为鼓励创新,更好地体现沟通交流的服务属性,结合《药品注册管理办法》,从药物研制规律和注册要求出发,秉持为药品注册申请人服务的原则,修订后发布了《药物研发与技术审评沟通交流管理办法》。在保证受试者安全性的基础上,将Ⅱ类会议划分为依法应沟通交流、原则上应当沟通交流、可以沟通交流三类情形,并明确和细化了三类沟通交流的情形和要求;为提高沟通交流申请办理的可预见性和效率,药审中心通过持续优化沟通交流管理,细化环节时限控制,确保了申请人能够尽快享受到优质的沟通交流服务,努力满足申请人逐年增加的沟通交流需求,将2020年沟通交流申请办理量提升至2019年办理量的1.31倍,这也是2016年办理量的11.35倍。
三是持续改善内部工作作风,提高工作效率。这一年药审中心继续深化审评审批制度改革,持续优化审评流程,严格时限管理,实施审评任务分析会制度,加强项目督导,鼓励药品创新,推动仿制药高质量发展,审评质量和效率有了极大地提升,2020年全年审结任务整体按时完成率创历史新高。药品审评审批的可预期性进一步提高,顺利完成《十三五药品安全规划》涉及药品审评审批改革目标。通过5年来深化药品审评审批制度改革的不懈努力,药审中心实现了量变到质变的飞跃,药品平均审评时限大幅压缩,审评能力大幅提升,一大批创新药、临床急需药获批上市,累计通过和视同通过一致性评价审评的品种已达445个,为十四五药品审评事业的发展奠定了坚实的基础。
药审中心将深入梳理在提高审评效率、创新审评方式等方面的经验做法,使应急状态下的临时性措施,有序地上升为常态化审评工作长效机制,将被动选择但被实践证明长期有效的方法转化为常态化条件下提高审评能力的主动选择。
十、加大药品审评审批信息公开力度
药审中心持续推进技术审评的信息公开工作,提高药品审评审批工作透明度。一是完善信息公开制度,发布了《药品审评审批信息公开管理办法》,明确信息公开的范围、种类、时限等要求,为做好信息公开工作提供了制度依据。二是大力推动新药技术审评报告的公开,自开展工作以来已完成公开新药技术审评报告316个,指导行业研发,更好的服务药品注册申请人和公众。三是加大技术审评过程信息公开力度,通过药审中心网站向申请人进一步公开了审评排队信息、优先审评的状态信息、沟通交流申请及办理信息等信息,新增了“突破性治疗公示”的栏目,公开了“拟突破性治疗品种、异议论证结果”等信息。方便申请人查询信息,进一步拓宽了申请人的沟通渠道,及时回应社会关切,提高了审评审批工作的透明度。
附件1
2020年药审中心审评通过的创新药
|
序号 |
药品名称 |
获批时的适应症小结 |
|
1 |
苯环喹溴铵鼻喷雾剂 |
变应性鼻炎 |
|
2 |
甲磺酸阿美替尼片 |
既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKIs)治疗后EGFR T790M阳性的晚期非小细胞肺癌 |
|
3 |
泽布替尼胶囊 |
复发或难治性套细胞淋巴瘤,复发或难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 |
|
4 |
注射用苯磺酸瑞马唑仑 |
结肠镜检查的镇静 |
|
5 |
盐酸恩沙替尼胶囊 |
克唑替尼治疗后进展的或不耐受的间变性淋巴瘤激酶(ALK)阳性的晚期非小细胞肺癌 |
|
6 |
环泊酚注射液 |
消化道内镜检查的镇静 |
|
7 |
氟唑帕利胶囊 |
二线及以上化疗后伴BRCA1/2突变的复发性卵巢癌 |
|
8 |
奥布替尼片 |
复发或难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤,复发或难治性套细胞淋巴瘤 |
|
9 |
索凡替尼胶囊 |
无法手术切除的局部晚期或转移性、进展期非功能性、分化良好(G1、G2)的非胰腺来源的神经内分泌瘤 |
|
10 |
盐酸可洛派韦胶囊 |
与索磷布韦联合用于基因1、2、3、6型成人慢性丙型肝炎病毒感染,可合并或不合并代偿性肝硬化 |
|
11 |
西尼莫德片 |
复发型多发性硬化 |
|
12 |
依达拉奉右莰醇注射用浓溶液 |
急性缺血性脑卒中所致的神经症状、日常生活活动能力和功能障碍 |
|
13 |
盐酸拉维达韦片 |
与利托那韦强化的达诺瑞韦钠片和利巴韦林联合用于初治的基因1b型慢性丙型肝炎病毒感染的非肝硬化成人患者 |
|
14 |
磷酸依米他韦胶囊 |
与索磷布韦片联合用于成人基因1型非肝硬化慢性丙肝 |
|
15 |
新型冠状病毒灭活疫苗(Vero)病毒 |
预防由新型冠状病毒(SARS-CoV-2)感染引起的疾病 |
|
16 |
重组结核杆菌融合蛋白(EC) |
结核杆菌感染诊断、辅助结核病的临床诊断 |
|
17 |
桑枝总生物碱 |
—— |
|
18 |
桑枝总生物碱片 |
2型糖尿病 |
|
19 |
筋骨止痛凝胶 |
活血理气、祛风除湿、通络止痛。用于膝骨关节炎肾虚筋脉瘀滞证的症状改善。 |
|
20 |
连花清咳片 |
宣肺泄热,化痰止咳。用于急性气管—支气管炎痰热壅肺证引起的咳嗽、咳痰等。 |
附件2
2020年药审中心审评通过的境外生产原研药
|
序号 |
药品名称 |
获批时的适应症小结 |
|
1 |
阿巴西普注射液 |
类风湿关节炎 |
|
2 |
阿贝西利片 |
激素受体(HR)阳性、人表皮生长因子受体(HER2)阴性的局部晚期或转移性乳腺癌 |
|
3 |
马来酸阿伐曲泊帕片 |
择期行诊断性操作或手术的慢性肝病相关血小板减少症 |
|
4 |
阿加糖酶α注射用浓溶液 |
法布雷病 |
|
5 |
阿替利珠单抗注射液 |
联合含铂化疗用于初治广泛期小细胞肺癌 |
|
6 |
艾地骨化醇软胶囊 |
绝经后女性骨质疏松症 |
|
7 |
艾度硫酸酯酶β注射液 |
黏多糖贮积症Ⅱ型 |
|
8 |
艾托格列净片 |
配合饮食和运动改善成人2型糖尿病患者的血糖控制。 |
|
9 |
达依泊汀α注射液 |
需血液透析的慢性肾病患者的贫血 |
|
10 |
地舒单抗注射液 |
骨折风险增高的绝经后妇女的骨质疏松症 |
|
11 |
甘精胰岛素注射液 |
需胰岛素治疗的成人2型糖尿病 |
|
12 |
格隆溴铵福莫特罗吸入气雾剂 |
慢性阻塞性肺疾病 |
|
13 |
氯化镭[223Ra]注射液 |
伴骨转移且无已知内脏转移的去势抵抗性前列腺癌 |
|
14 |
马来酸奈拉替尼片 |
HER2阳性早期乳腺癌的强化辅助治疗。 |
|
15 |
普拉曲沙注射液 |
复发或难治性外周T细胞淋巴瘤 |
|
16 |
维奈克拉片 |
联合阿扎胞苷用于不耐受强诱导化疗的急性髓系白血病 |
|
17 |
盐酸安非他酮缓释片(Ⅱ) |
抑郁症 |
|
18 |
盐酸帕洛诺司琼软胶囊 |
预防中度致吐性化疗引起的恶心和呕吐。 |
|
19 |
盐酸曲唑酮缓释片 |
抑郁症 |
|
20 |
注射用贝林妥欧单抗 |
复发或难治性前体B细胞急性淋巴细胞白血病 |
|
21 |
注射用恩美曲妥珠单抗 |
HER2阳性高复发风险早期乳腺癌的辅助治疗 |
|
22 |
注射用拉罗尼酶浓溶液 |
黏多糖贮积症I型 |
|
23 |
注射用维布妥昔单抗 |
CD30阳性淋巴瘤:复发或难治性系统性间变性大细胞淋巴瘤和经典型霍奇金淋巴瘤 |
|
24 |
布罗利尤单抗注射液 |
中度至重度斑块状银屑病 |
|
25 |
氘丁苯那嗪片 |
与亨廷顿病有关的舞蹈病;成人迟发性运动障碍 |
|
26 |
度普利尤单抗注射液 |
中重度特应性皮炎 |
|
27 |
多拉米替片 |
用于无NNRTI类药物、拉米夫定或替诺福韦病毒耐药的成年人免疫缺陷病毒(HIV-1)感染患者 |
|
28 |
多拉韦林片 |
与其他抗反转录病毒药物联合用于无NNRTI类耐药的HIV-1感染成年患者 |
|
29 |
枸橼酸西地那非片 |
成人肺动脉高压 |
|
30 |
克立硼罗软膏 |
2岁及以上轻中度特应性皮炎患者的局部外用治疗 |
|
31 |
拉考沙胺口服溶液 |
用于4岁及以上癫痫部分性发作患者 |
|
32 |
拉那利尤单抗注射液 |
预防遗传性血管性水肿的发作 |
|
33 |
拉替拉韦钾咀嚼片 |
与其它抗反转录病毒药物联合用于体重大于11公斤儿童的HIV-1感染 |
|
34 |
利伐沙班片 |
与阿司匹林联合用于降低主要心血管事件风险 |
|
35 |
氯苯唑酸葡胺软胶囊 |
转甲状腺素蛋白淀粉样变性多发性神经病I期症状 |
|
36 |
氯苯唑酸软胶囊 |
成人野生型或遗传型转甲状腺素蛋白淀粉样变性心肌病 |
|
37 |
咪康唑口腔贴片 |
成人口咽念珠菌病的局部治疗 |
|
38 |
萘哌地尔片 |
前列腺增生症引起的排尿障碍 |
|
39 |
普卢利沙星片 |
敏感菌引起的急性单纯性及复杂性下尿路感染、慢性支气管炎急性发作、急性细菌性鼻窦炎 |
|
40 |
塞奈吉明滴眼液 |
成人中度(持续性角膜上皮缺损)至重度(角膜溃疡)神经营养性角膜炎 |
|
41 |
他克莫司颗粒 |
预防和治疗儿童肝肾脏移植术后的移植物排斥反应 |
|
42 |
替格瑞洛分散片 |
降低心血管死亡、心肌梗死和卒中的发生率 |
|
43 |
盐酸奥洛他定滴眼液 |
过敏性结膜炎相关的眼痒 |
|
44 |
注射用头孢比罗酯钠 |
医院获得性肺炎、社区获得性肺炎 |
|
45 |
注射用维得利珠单抗 |
成人中重度溃疡性结肠炎和中重度克罗恩病 |
|
46 |
左西孟旦注射液 |
传统治疗疗效不佳且需增加心肌收缩力急性失代偿心力衰竭 |
|
47 |
布罗利尤单抗注射液 |
A型血友病常规预防、出血事件的按需治疗和控制,以及围手术期出血的管理 |
|
48 |
注射用A型肉毒毒素 |
暂时性改善中重度皱眉纹 |
|
49 |
阿帕他胺片# |
转移性内分泌治疗敏感性前列腺癌 |
|
50 |
阿替利珠单抗注射液# |
与贝伐珠单抗联合用于既往未接受过全身系统性治疗的不可切除肝细胞癌 |
|
51 |
贝伐珠单抗注射液# |
复发性胶质母细胞瘤 |
|
52 |
布地奈德福莫特罗吸入粉雾剂(Ⅱ)# |
哮喘 |
|
53 |
地舒单抗注射液# |
多发性骨髓瘤和实体肿瘤的骨转移 |
|
54 |
恩扎卢胺软胶囊# |
非转移性去势抵抗性前列腺癌 |
|
55 |
甲磺酸达拉非尼胶囊# |
与曲美替尼联用于BRAF V600突变的黑色素瘤的辅助治疗 |
|
56 |
甲磺酸仑伐替尼胶囊# |
进展性、放射性碘难治性、晚期分化型甲状腺癌 |
|
57 |
来那度胺胶囊# |
联合利妥昔单抗用于经治的滤泡性淋巴瘤 |
|
58 |
利拉鲁肽注射液# |
用于伴有心血管疾病的2型糖尿病成人患者 |
|
59 |
纳武利尤单抗注射液# |
既往接受过两种或两种以上全身性治疗的晚期胃或胃食管连接部腺癌 |
|
60 |
帕博利珠单抗注射液# |
局部晚期或转移性食管鳞状细胞癌的二线治疗;既往未接受过全身系统性治疗的转移性或不可切除的复发性头颈部鳞状细胞癌 |
|
61 |
普乐沙福注射液# |
与粒细胞集落刺激因子联合用于多发性骨髓瘤患者自体移植前的造血干细胞动员 |
|
62 |
曲美替尼片# |
与甲磺酸达拉非尼联用于BRAF V600突变的黑色素瘤的辅助治疗 |
|
63 |
塞瑞替尼胶囊# |
间变性淋巴瘤激酶阳性的晚期非小细胞肺癌 |
|
64 |
司库奇尤单抗注射液# |
用于活动性强直性脊柱炎的成人患者 |
|
65 |
西妥昔单抗注射液# |
既往未接受过全身系统性治疗的复发和/或转移性头颈部鳞状细胞癌 |
|
66 |
盐酸帕洛诺司琼注射液# |
预防术后恶心呕吐 |
|
67 |
乙磺酸尼达尼布软胶囊# |
系统性硬化病相关间质性肺疾病;具有进行性表型的其他慢性纤维化性间质性肺疾病 |
|
68 |
注射用贝利尤单抗# |
与常规治疗联合用于活动性系统性红斑狼疮5岁及以上患者 |
|
69 |
阿达木单抗注射液# |
4岁及以上儿童与青少年重度慢性斑块状银屑病;非感染性葡萄膜炎 |
|
70 |
恩曲他滨替诺福韦片# |
HIV-1暴露前预防 |
|
71 |
乌司奴单抗注射液/ |
成人中重度活动性克罗恩病患者 |
|
乌司奴单抗注射液(静脉输注)# |
||
|
72 |
左乙拉西坦注射用浓溶液# |
4岁以上儿童及成人癫痫患者部分性发作 |
|
73 |
富马酸卢帕他定片* |
过敏性鼻炎和荨麻疹 |
|
74 |
盐酸二甲双胍片* |
2型糖尿病 |
注:1.“#”为新增适应症品种。
2.“*”是中国已有仿制品种上市的境外生产原研药,不纳入2020年统计范围内。
附件4
2020年已批准上市药品纳入加快上市程序情况
|
序号 |
受理号 |
药品名称 |
附条件 |
优先审评审批程序 |
特别审批程序 |
|
1 |
CXHS1700022 |
苯环喹溴铵鼻喷雾剂 |
|
√ |
|
|
2 |
CXHS1800007 |
盐酸可洛派韦胶囊 |
|
√ |
|
|
3 |
CXHS1800020 |
盐酸拉维达韦片 |
|
√ |
|
|
4 |
CXHS1800024 |
泽布替尼胶囊 |
√ |
√ |
|
|
5 |
CXHS1800030 |
泽布替尼胶囊 |
√ |
√ |
|
|
6 |
CXHS1800032 |
依达拉奉右莰醇注射用浓溶液 |
|
√ |
|
|
7 |
CXHS1800035 |
注射用苯磺酸瑞马唑仑 |
|
√ |
|
|
8 |
CXHS1800045 |
盐酸恩沙替尼胶囊 |
√ |
√ |
|
|
9 |
CXHS1800046 |
盐酸恩沙替尼胶囊 |
√ |
√ |
|
|
10 |
CXHS1900011 |
甲磺酸阿美替尼片 |
√ |
√ |
|
|
11 |
CXHS1900013 |
注射用甲苯磺酸瑞马唑仑 |
|
√ |
|
|
12 |
CXHS1900020 |
环泊酚注射液 |
|
√ |
|
|
13 |
CXHS1900030 |
磷酸依米他韦胶囊 |
|
√ |
|
|
14 |
CXHS1900033 |
氟唑帕利胶囊 |
√ |
√ |
|
|
15 |
CXHS1900034 |
索凡替尼胶囊 |
|
√ |
|
|
16 |
CXHS1900035 |
奥布替尼片 |
√ |
√ |
|
|
17 |
CXHS1900036 |
注射用利培酮微球(Ⅱ) |
|
√ |
|
|
18 |
CXHS1900037 |
注射用利培酮微球(Ⅱ) |
|
√ |
|
|
19 |
CXHS1900038 |
注射用利培酮微球(Ⅱ) |
|
√ |
|
|
20 |
CXHS2000008 |
奥布替尼片 |
√ |
√ |
|
|
21 |
CXHS2000009 |
甲苯磺酸尼拉帕利胶囊 |
|
√ |
|
|
22 |
CXSS1700033 |
人凝血因子Ⅷ |
|
√ |
|
|
23 |
CXSS1700034 |
A群C群脑膜炎球菌多糖结合疫苗 |
|
√ |
|
|
24 |
CXSS1700035 |
冻干鼻喷流感减毒活疫苗 |
|
√ |
|
|
25 |
CXSS1800007 |
人凝血因子Ⅸ |
|
√ |
|
|
26 |
CXSS1800012 |
人凝血因子Ⅷ |
|
√ |
|
|
27 |
CXSS1800020 |
重组结核杆菌融合蛋白(EC) |
|
√ |
|
|
28 |
CXSS1800021 |
重组结核杆菌融合蛋白(EC) |
|
√ |
|
|
29 |
CXSS1800022 |
重组结核杆菌融合蛋白(EC) |
|
√ |
|
|
30 |
CXSS1800023 |
注射用伊尼妥单抗 |
|
√ |
|
|
31 |
CXSS1800027 |
阿达木单抗注射液 |
|
√ |
|
|
32 |
CXSS1900001 |
阿达木单抗注射液 |
|
√ |
|
|
33 |
CXSS1900004 |
贝伐珠单抗注射液 |
|
√ |
|
|
34 |
CXSS1900021 |
注射用曲妥珠单抗 |
|
√ |
|
|
35 |
CXSS1900022 |
人凝血酶原复合物 |
|
√ |
|
|
36 |
CXSS1900023 |
注射用卡瑞利珠单抗 |
√ |
√ |
|
|
37 |
CXSS1900025 |
替雷利珠单抗注射液 |
√ |
√ |
|
|
38 |
CXSS1900026 |
人凝血酶原复合物 |
|
√ |
|
|
39 |
CXSS1900029 |
人凝血酶原复合物 |
|
√ |
|
|
40 |
CXSS1900030 |
利妥昔单抗注射液 |
|
√ |
|
|
41 |
CXSS1900034 |
注射用卡瑞利珠单抗 |
|
√ |
|
|
42 |
CXSS1900035 |
注射用卡瑞利珠单抗 |
|
√ |
|
|
43 |
CXSS1900037 |
人凝血酶原复合物 |
|
√ |
|
|
44 |
CXZS1700007 |
桑枝总生物碱 |
|
√ |
|
|
45 |
CXZS1700008 |
桑枝总生物碱片 |
|
√ |
|
|
46 |
JXHS1800068 |
拉考沙胺口服溶液 |
|
√ |
|
|
47 |
JXHS1800080 |
普拉曲沙注射液 |
√ |
√ |
|
|
48 |
JXHS1900028 |
西尼莫德片 |
|
√ |
|
|
49 |
JXHS1900029 |
西尼莫德片 |
|
√ |
|
|
50 |
JXHS1900045 |
马来酸阿伐曲泊帕片 |
|
√ |
|
|
51 |
JXHS1900086 |
乙磺酸尼达尼布软胶囊 |
|
√ |
|
|
52 |
JXHS1900088 |
乙磺酸尼达尼布软胶囊 |
|
√ |
|
|
53 |
JXHS1900090 |
曲美替尼片 |
|
√ |
|
|
54 |
JXHS1900091 |
曲美替尼片 |
|
√ |
|
|
55 |
JXHS1900092 |
甲磺酸达拉非尼胶囊 |
|
√ |
|
|
56 |
JXHS1900093 |
甲磺酸达拉非尼胶囊 |
|
√ |
|
|
57 |
JXHS1900109 |
氯化镭[223Ra]注射液 |
|
√ |
|
|
58 |
JXHS1900111 |
他克莫司颗粒 |
|
√ |
|
|
59 |
JXHS1900112 |
他克莫司颗粒 |
|
√ |
|
|
60 |
JXHS1900114 |
多拉韦林片 |
|
√ |
|
|
61 |
JXHS1900115 |
多拉米替片 |
|
√ |
|
|
62 |
JXHS1900117 |
氯苯唑酸软胶囊 |
|
√ |
|
|
63 |
JXHS1900118 |
枸橼酸西地那非片 |
|
√ |
|
|
64 |
JXHS1900144 |
阿贝西利片 |
|
√ |
|
|
65 |
JXHS1900145 |
阿贝西利片 |
|
√ |
|
|
66 |
JXHS1900146 |
阿贝西利片 |
|
√ |
|
|
67 |
JXHS1900151 |
来那度胺胶囊 |
|
√ |
|
|
68 |
JXHS1900152 |
来那度胺胶囊 |
|
√ |
|
|
69 |
JXHS1900153 |
来那度胺胶囊 |
|
√ |
|
|
70 |
JXHS1900156 |
阿帕他胺片 |
|
√ |
|
|
71 |
JXHS1900163 |
恩扎卢胺软胶囊 |
|
√ |
|
|
72 |
JXHS1900168 |
恩曲他滨替诺福韦片 |
|
√ |
|
|
73 |
JXHS1900175 |
氘丁苯那嗪片 |
|
√ |
|
|
74 |
JXHS1900176 |
氘丁苯那嗪片 |
|
√ |
|
|
75 |
JXHS1900177 |
氘丁苯那嗪片 |
|
√ |
|
|
76 |
JXHS1900178 |
氘丁苯那嗪片 |
|
√ |
|
|
77 |
JXHS1900179 |
氘丁苯那嗪片 |
|
√ |
|
|
78 |
JXHS1900180 |
氘丁苯那嗪片 |
|
√ |
|
|
79 |
JXHS2000002 |
维奈克拉片 |
√ |
√ |
|
|
80 |
JXHS2000003 |
维奈克拉片 |
|
√ |
|
|
81 |
JXHS2000004 |
维奈克拉片 |
|
√ |
|
|
82 |
JXHS2000020 |
普乐沙福注射液 |
√ |
|
|
|
83 |
JXHS2000032 |
左乙拉西坦注射用浓溶液 |
|
√ |
|
|
84 |
JXSS1800016 |
阿加糖酶α注射用浓溶液 |
|
√ |
|
|
85 |
JXSS1800043 |
阿达木单抗注射液 |
|
√ |
|
|
86 |
JXSS1900012 |
注射用恩美曲妥珠单抗 |
|
√ |
|
|
87 |
JXSS1900013 |
注射用恩美曲妥珠单抗 |
|
√ |
|
|
88 |
JXSS1900014 |
西妥昔单抗注射液 |
|
√ |
|
|
89 |
JXSS1900015 |
注射用维布妥昔单抗 |
|
√ |
|
|
90 |
JXSS1900025 |
司库奇尤单抗注射液 |
|
√ |
|
|
91 |
JXSS1900037 |
纳武利尤单抗注射液 |
|
√ |
|
|
92 |
JXSS1900038 |
纳武利尤单抗注射液 |
|
√ |
|
|
93 |
JXSS1900039 |
注射用重组人凝血因子Ⅷ |
|
√ |
|
|
94 |
JXSS1900040 |
注射用重组人凝血因子Ⅷ |
|
√ |
|
|
95 |
JXSS1900041 |
注射用重组人凝血因子Ⅷ |
|
√ |
|
|
96 |
JXSS1900042 |
注射用重组人凝血因子Ⅷ |
|
√ |
|
|
97 |
JXSS1900044 |
帕博利珠单抗注射液 |
|
√ |
|
|
98 |
JXSS1900046 |
艾度硫酸酯酶β注射液 |
|
√ |
|
|
99 |
JXSS1900060 |
注射用贝林妥欧单抗 |
√ |
√ |
|
|
100 |
JXSS2000002 |
阿替利珠单抗注射液 |
|
√ |
|
|
101 |
JXSS2000003 |
注射用贝利尤单抗 |
|
√ |
|
|
102 |
JXSS2000004 |
注射用贝利尤单抗 |
|
√ |
|
|
103 |
JXSS2000010 |
帕博利珠单抗注射液 |
|
√ |
|
|
104 |
CYHS1700012 |
注射用甲磺酸萘莫司他 |
|
√ |
|
|
105 |
CYHS1700013 |
注射用甲磺酸萘莫司他 |
|
√ |
|
|
106 |
CYHS1700282 |
艾司奥美拉唑镁肠溶胶囊 |
|
√ |
|
|
107 |
CYHS1700283 |
艾司奥美拉唑镁肠溶胶囊 |
|
√ |
|
|
108 |
CYHS1700408 |
盐酸阿芬太尼注射液 |
|
√ |
|
|
109 |
CYHS1700409 |
盐酸阿芬太尼注射液 |
|
√ |
|
|
110 |
CYHS1700410 |
盐酸阿芬太尼注射液 |
|
√ |
|
|
111 |
CYHS1700417 |
枸橼酸舒芬太尼注射液 |
|
√ |
|
|
112 |
CYHS1700451 |
拉莫三嗪片 |
|
√ |
|
|
113 |
CYHS1700452 |
拉莫三嗪片 |
|
√ |
|
|
114 |
CYHS1700453 |
左乙拉西坦片 |
|
√ |
|
|
115 |
CYHS1700454 |
左乙拉西坦片 |
|
√ |
|
|
116 |
CYHS1700548 |
阿仑膦酸钠片 |
|
√ |
|
|
117 |
CYHS1700687 |
盐酸西那卡塞片 |
|
√ |
|
|
118 |
CYHS1800006 |
环孢素滴眼液(Ⅱ) |
|
√ |
|
|
119 |
CYHS1800050 |
恩替卡韦片 |
|
√ |
|
|
120 |
CYHS1800051 |
恩替卡韦片 |
|
√ |
|
|
121 |
CYHS1800071 |
阿立哌唑片 |
|
√ |
|
|
122 |
CYHS1800072 |
阿立哌唑片 |
|
√ |
|
|
123 |
CYHS1800073 |
阿立哌唑片 |
|
√ |
|
|
124 |
CYHS1800093 |
格隆溴铵注射液 |
|
√ |
|
|
125 |
CYHS1800096 |
塞来昔布胶囊 |
|
√ |
|
|
126 |
CYHS1800097 |
塞来昔布胶囊 |
|
√ |
|
|
127 |
CYHS1800104 |
恩替卡韦片 |
|
√ |
|
|
128 |
CYHS1800105 |
恩替卡韦片 |
|
√ |
|
|
129 |
CYHS1800108 |
孟鲁司特钠片 |
|
√ |
|
|
130 |
CYHS1800109 |
孟鲁司特钠咀嚼片 |
|
√ |
|
|
131 |
CYHS1800110 |
孟鲁司特钠咀嚼片 |
|
√ |
|
|
132 |
CYHS1800123 |
盐酸伐地那非片 |
|
√ |
|
|
133 |
CYHS1800124 |
盐酸伐地那非片 |
|
√ |
|
|
134 |
CYHS1800133 |
左乙拉西坦缓释片 |
|
√ |
|
|
135 |
CYHS1800134 |
左乙拉西坦缓释片 |
|
√ |
|
|
136 |
CYHS1800136 |
利格列汀二甲双胍片(Ⅰ) |
|
√ |
|
|
137 |
CYHS1800137 |
利格列汀二甲双胍片(Ⅱ) |
|
√ |
|
|
138 |
CYHS1800138 |
利格列汀二甲双胍片(Ⅲ) |
|
√ |
|
|
139 |
CYHS1800142 |
奥美沙坦酯氢氯噻嗪片 |
|
√ |
|
|
140 |
CYHS1800143 |
奥美沙坦酯氢氯噻嗪片 |
|
√ |
|
|
141 |
CYHS1800144 |
奥美沙坦酯氢氯噻嗪片 |
|
√ |
|
|
142 |
CYHS1800148 |
奥氮平片 |
|
√ |
|
|
143 |
CYHS1800161 |
奥氮平口崩片 |
|
√ |
|
|
144 |
CYHS1800162 |
利格列汀片 |
|
√ |
|
|
145 |
CYHS1800170 |
头孢地尼胶囊 |
|
√ |
|
|
146 |
CYHS1800171 |
瑞舒伐他汀钙片 |
|
√ |
|
|
147 |
CYHS1800187 |
泊马度胺胶囊 |
|
√ |
|
|
148 |
CYHS1800188 |
泊马度胺胶囊 |
|
√ |
|
|
149 |
CYHS1800189 |
西格列汀二甲双胍片(Ⅱ) |
|
√ |
|
|
150 |
CYHS1800190 |
西格列汀二甲双胍片(Ⅲ) |
|
√ |
|
|
151 |
CYHS1800199 |
匹伐他汀钙片 |
|
√ |
|
|
152 |
CYHS1800215 |
盐酸美金刚片 |
|
√ |
|
|
153 |
CYHS1800216 |
达比加群酯胶囊 |
|
√ |
|
|
154 |
CYHS1800217 |
达比加群酯胶囊 |
|
√ |
|
|
155 |
CYHS1800223 |
奥氮平片 |
|
√ |
|
|
156 |
CYHS1800224 |
奥氮平片 |
|
√ |
|
|
157 |
CYHS1800226 |
塞来昔布胶囊 |
|
√ |
|
|
158 |
CYHS1800227 |
塞来昔布胶囊 |
|
√ |
|
|
159 |
CYHS1800268 |
阿托伐他汀钙片 |
|
√ |
|
|
160 |
CYHS1800269 |
阿托伐他汀钙片 |
|
√ |
|
|
161 |
CYHS1800273 |
硫酸氢氯吡格雷片 |
|
√ |
|
|
162 |
CYHS1800296 |
盐酸曲美他嗪缓释片 |
|
√ |
|
|
163 |
CYHS1800303 |
替格瑞洛片 |
|
√ |
|
|
164 |
CYHS1800359 |
苯甲酸阿格列汀片 |
|
√ |
|
|
165 |
CYHS1800360 |
苯甲酸阿格列汀片 |
|
√ |
|
|
166 |
CYHS1800361 |
苯甲酸阿格列汀片 |
|
√ |
|
|
167 |
CYHS1800369 |
厄贝沙坦氢氯噻嗪片 |
|
√ |
|
|
168 |
CYHS1800456 |
盐酸美金刚片 |
|
√ |
|
|
169 |
CYHS1800457 |
盐酸美金刚片 |
|
√ |
|
|
170 |
CYHS1800473 |
阿那曲唑片 |
|
√ |
|
|
171 |
CYHS1800489 |
恩替卡韦口服溶液 |
|
√ |
|
|
172 |
CYHS1800496 |
曲前列尼尔注射液 |
|
√ |
|
|
173 |
CYHS1900010 |
盐酸乐卡地平片 |
|
√ |
|
|
174 |
CYHS1900032 |
布洛芬缓释胶囊 |
|
√ |
|
|
175 |
CYHS1900054 |
瑞舒伐他汀钙片 |
|
√ |
|
|
176 |
CYHS1900055 |
瑞舒伐他汀钙片 |
|
√ |
|
|
177 |
CYHS1900056 |
盐酸二甲双胍片 |
|
√ |
|
|
178 |
CYHS1900057 |
盐酸二甲双胍片 |
|
√ |
|
|
179 |
CYHS1900059 |
苯磺顺阿曲库铵注射液 |
|
√ |
|
|
180 |
CYHS1900063 |
盐酸二甲双胍片 |
|
√ |
|
|
181 |
CYHS1900083 |
氟维司群注射液 |
|
√ |
|
|
182 |
CYHS1900084 |
泼尼松片 |
|
√ |
|
|
183 |
CYHS1900085 |
泼尼松片 |
|
√ |
|
|
184 |
CYHS1900086 |
泼尼松片 |
|
√ |
|
|
185 |
CYHS1900100 |
普瑞巴林胶囊 |
|
√ |
|
|
186 |
CYHS1900101 |
普瑞巴林胶囊 |
|
√ |
|
|
187 |
CYHS1900113 |
富马酸喹硫平缓释片 |
|
√ |
|
|
188 |
CYHS1900114 |
富马酸喹硫平缓释片 |
|
√ |
|
|
189 |
CYHS1900124 |
阿卡波糖片 |
|
√ |
|
|
190 |
CYHS1900129 |
左乙拉西坦注射用浓溶液 |
|
√ |
|
|
191 |
CYHS1900135 |
注射用丹曲林钠 |
|
√ |
|
|
192 |
CYHS1900139 |
拉考沙胺注射液 |
|
√ |
|
|
193 |
CYHS1900193 |
盐酸二甲双胍缓释片 |
|
√ |
|
|
194 |
CYHS1900194 |
盐酸二甲双胍缓释片 |
|
√ |
|
|
195 |
CYHS1900203 |
盐酸安非他酮缓释片 |
|
√ |
|
|
196 |
CYHS1900204 |
盐酸安非他酮缓释片 |
|
√ |
|
|
197 |
CYHS1900205 |
盐酸安非他酮缓释片 |
|
√ |
|
|
198 |
CYHS1900218 |
阿卡波糖片 |
|
√ |
|
|
199 |
CYHS1900227 |
头孢地尼颗粒 |
|
√ |
|
|
200 |
CYHS1900283 |
孟鲁司特钠咀嚼片 |
|
√ |
|
|
201 |
CYHS1900295 |
注射用培美曲塞二钠 |
|
√ |
|
|
202 |
CYHS1900296 |
注射用培美曲塞二钠 |
|
√ |
|
|
203 |
CYHS1900318 |
孟鲁司特钠咀嚼片 |
|
√ |
|
|
204 |
CYHS1900454 |
硫酸氢氯吡格雷片 |
|
√ |
|
|
205 |
CYHS1900477 |
注射用比伐芦定 |
|
√ |
|
|
206 |
CYHS1900485 |
盐酸度洛西汀肠溶胶囊 |
|
√ |
|
|
207 |
CYHS1900486 |
盐酸度洛西汀肠溶胶囊 |
|
√ |
|
|
208 |
CYHS1900487 |
盐酸度洛西汀肠溶胶囊 |
|
√ |
|
|
209 |
CYHS1900525 |
瑞舒伐他汀钙片 |
|
√ |
|
|
210 |
CYHS1900526 |
瑞舒伐他汀钙片 |
|
√ |
|
|
211 |
CYHS1900557 |
注射用盐酸苯达莫司汀 |
|
√ |
|
|
212 |
CYHS1900558 |
注射用盐酸苯达莫司汀 |
|
√ |
|
|
213 |
CYHS1900666 |
磷酸西格列汀片 |
|
√ |
|
|
214 |
CYHS1900667 |
磷酸西格列汀片 |
|
√ |
|
|
215 |
CYHS1900668 |
磷酸西格列汀片 |
|
√ |
|
|
216 |
CYHS1900682 |
紫杉醇注射液 |
|
√ |
|
|
217 |
CYHS1900683 |
紫杉醇注射液 |
|
√ |
|
|
218 |
JXHS1900037 |
硫酸氢氯吡格雷片 |
|
√ |
|
|
219 |
—— |
新型冠状病毒灭活疫苗(Vero细胞) |
√ |
|
√ |
|
220 |
—— |
连花清瘟胶囊 |
|
|
√ |
|
221 |
—— |
连花清瘟颗粒 |
|
|
√ |
|
222 |
—— |
金花清感颗粒 |
|
|
√ |
|
223 |
—— |
血必净注射液 |
|
|
√ |
注:1.该附件按照受理号进行统计。
2.突破性治疗药物程序内暂无通过技术审评的注册申请,因此表中不列示。
3.新冠病毒疫苗药物受理号不对外公开。
附件5
2020年临床试验阶段纳入突破性治疗通道的药物情况
|
序号 |
药品名称 |
纳入突破性治疗药物程序的原因 |
拟定适应症 |
|
1 |
YY-20394片 |
1.中国目前尚没有针对该适应症的产品获批上市,也没有PI3K抑制剂上市。 |
用于既往接受至少二线治疗后复发难治的FL患者。 |
|
2 |
注射用普那布林浓溶液 |
1.本品为治疗拟申报适应症的全新机制产品。 |
与粒细胞集落刺激因子(G-CSF)联用,用于非髓性恶性肿瘤患者中骨髓抑制性抗癌药物引起的重度中性粒细胞减少症(CIN)。 |
|
3 |
TAK-788胶囊 |
1.本品拟定适应症为EGFR第20外显子插入突变的晚期非小细胞肺癌,无有效治疗药物获批。 |
用于治疗既往至少接受过一次全身化疗的携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。 |
|
4 |
JNJ-61186372注射液 |
1.本品拟定适应症为EGFR第20外显子插入突变的晚期非小细胞肺癌,无有效治疗药物获批。 |
用于治疗含铂双药化疗期间或之后进展,或对含铂化疗不耐受的EGFR 20号外显子插入突变的转移性或手术不可切除的NSCLC患者。 |
|
5 |
AK104注射液 |
用于治疗末线宫颈癌,本品现有有效性数据体现出突出的治疗效果。 |
用于既往含铂治疗期间或治疗后疾病进展的复发或转移性宫颈鳞癌(含腺鳞癌)。 |
|
6 |
苹果酸法米替尼胶囊 |
用于治疗末线宫颈癌,本品联合治疗现有有效性数据体现出突出的治疗效果。 |
用于注射用卡瑞利珠单抗联合苹果酸法米替尼胶囊治疗经过一线级以上治疗失败的复发转移性宫颈癌。 |
|
7 |
注射用卡瑞利珠单抗 |
用于治疗末线宫颈癌,本品联合治疗现有有效性数据体现出突出的治疗效果。 |
用于注射用卡瑞利珠单抗联合苹果酸法米替尼胶囊治疗经过一线级以上治疗失败的复发转移性宫颈癌。 |
|
8 |
注射用重组人源化抗HER2单抗-MMAE偶联剂 |
本品拟定适应症HER-2阳性复发难治尿路上皮癌,本品单药较历史数据具有显著提高的客观缓解率。 |
用于HER2过表达局部晚期或转移性尿路上皮癌患者(包括膀胱、输尿管、肾盂及尿道来源),且为既往经过化疗失败后进展的患者。HER2过表达定义为经IHC检测原发灶或转移灶肿瘤组织HER2表达为IHC 2+或IHC 3+。 |
|
9 |
DZD9008片 |
1.本品拟定适应症为EGFR第20外显子插入突变的晚期非小细胞肺癌,无有效治疗药物获批。 |
用于既往至少接受过一次全身化疗的携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)。 |
|
10 |
西奥罗尼胶囊 |
1.本品拟定适应症复发难治的广泛期小细胞肺癌属于难治疾病背景。 |
用于西奥罗尼胶囊单药治疗经过2线系统化疗方案治疗后疾病进展或复发的小细胞肺癌。 |
|
11 |
BLU-667胶囊 |
1.本品拟定的RET融合阳性甲状腺髓样癌属于难治疾病背景。 |
用于转染重排(RET)突变阳性的晚期或转移性甲状腺髓样癌(MTC)患者的系统性治疗。 |
|
12 |
DS-8201a |
1.本品目标适应症为既往接受过一种或一种以上治疗方案的HER2阳性局部晚期或转移性胃或食管胃结合部(GEJ)腺癌,疾病符合当前BTD程序的情形。 |
用于既往接受过一种或一种以上治疗方案的HER2阳性局部晚期或转移性胃或食管胃结合部(GEJ)腺癌成人患者。 |
|
13 |
AK0529肠溶胶囊 |
呼吸道合胞病毒引起的重症支气管肺炎可危及生命。目前中国尚无有效治疗手段,该药物已有临床试验数据显示,与安慰剂相比,显著提高了疗效。 |
用于呼吸道合胞病毒感染引起的上呼吸道感染和下呼吸道感染,包括病毒性支气管炎和肺炎。 |
|
14 |
Nefecon缓释胶囊 |
原发性IgA肾病(IgAN)严重影响生存质量,尚无有效治疗手段。本品已有的临床试验数据显示,与安慰剂相比,在重要临床结局上具有显著临床意义的疗效。 |
用于原发性IgA肾病(IgAN)。 |
|
15 |
TQJ230注射液 |
心血管疾病严重危及生命。脂蛋白(a)水平由遗传因素决定,是心血管疾病的独立危险因素之一。目前,尚无针对该指标的药物获准上市。本品已有临床试验数据显示,与安慰剂相比,显著降低脂蛋白(a)水平。 |
通过降低脂蛋白(a)水平减少心血管疾病的风险。 |
|
16 |
PF-06651600片 |
斑秃(包括全秃)是严重影响生存质量的疾病,目前缺乏有效治疗手段,本品境外2a期数据初步显示其可显著提高此类患者生存质量。 |
用于≥12岁斑秃患者(包括全秃[AT]和普秃[AU])的治疗。 |
|
17 |
BN101片 |
慢性移植物抗宿主病属于严重影响生存质量的疾病,且尚无有效防治手段。本品已完成的Ⅱ期临床试验结果提示其用于治疗经过≥2线系统性治疗失败后的慢性移植物抗宿主病的总体缓解率为65%。 |
用于至少经过一线系统治疗的慢性移植物抗宿主病(Chronic Graft Versus Host Disease,cGVHD)患者的治疗。 |
|
18 |
LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂) |
符合以下条件:1.拟申请适应症为经过至少3线且至少包括一种PI和一种IMiD治疗后疾病进展的多发性骨髓瘤,为病情严重危及患者生命的疾病。2.目前该疾病在临床无有效治疗手段,本品现有临床试验数据显示,本品能提供有效治疗手段,显著提高临床疗效。 |
用于单药治疗复发或难治性多发性骨髓瘤成人患者,患者既往接受过至少三线治疗,其中包括至少一种蛋白酶体抑制剂和至少一种免疫调节剂。 |
|
19 |
JWCAR029(CD19靶向嵌合抗原受体T细胞) |
用于防治严重危及生命或者严重影响生存质量的疾病;与现有治疗手段相比,该药物具有明显临床优势。 |
用于复发或难治性滤泡淋巴瘤。 |
|
20 |
CT053全人抗BCMA自体CAR T细胞注射液 |
1.拟申请适应症为经过至少3线且至少包括一种PI和一种IMiD治疗后疾病进展的多发性骨髓瘤,为病情严重危及患者生命的疾病。 |
用于复发难治多发性骨髓瘤。 |
|
21 |
抗CD19嵌合抗原受体T细胞注射液 |
1.该品种所针对的适应症属于严重危及生命的疾病。 |
用于复发或难治性急性淋巴细胞白血病。 |
|
22 |
Copanlisib注射用冻干制剂* |
1.中国目前尚没有针对该适应症的产品获批上市。 |
用于治疗既往接受过至少两线治疗的复发性边缘区淋巴瘤(MZL)成人患者。 |
|
23 |
Uproleselan注射液* |
1.本品为治疗拟申报适应症的全新机制产品。 |
用于成人复发或难治性急性髓系白血病(AML)。 |
注:“*”为公示日期截止为2020年12月31日的品种,根据程序在2021年纳入突破性治疗程序,因此不纳入到2020年的统计范围。
附件6
2020年发布的技术指导原则
|
序号 |
名称 |
内容简介 |
|
1 |
真实世界证据支持药物研发与审评的指导原则(试行)(国家药监局通告2020年第1号) |
旨在厘清药物研发和监管决策中真实世界证据的相关定义,指导真实世界数据收集以及适用性评估,明确真实世界证据在药物监管决策中的地位和适用范围,探究真实世界证据的评价原则,为工业界和监管部门利用真实世界证据支持药物监管决策提供参考意见。 |
|
2 |
化学药物中亚硝胺类杂质研究技术指导原则(试行)(国家药监局药审中心通告2020年第1号) |
为了保证药品的安全和质量可控,实现有效的风险控制,特制定本技术指导原则,旨在为注册申请上市以及已上市化学药品中亚硝胺类杂质的研究和控制提供指导。 |
|
3 |
化学药品注射剂仿制药质量和疗效一致性评价技术要求(国家药监局药审中心通告2020年第2号) |
旨在加强对化学药品注射剂仿制药质量和疗效一致性评价工作的指导。 |
|
4 |
化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求(国家药监局药审中心通告2020年第2号) |
旨在加强对化学药品注射剂仿制药质量和疗效一致性评价工作的指导。 |
|
5 |
化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(国家药监局药审中心通告2020年第2号) |
旨在加强对化学药品注射剂仿制药质量和疗效一致性评价工作的指导。 |
|
6 |
利拉鲁肽注射液生物类似药临床试验设计指导原则(国家药监局药审中心通告2020年第3号) |
在生物类似药指导原则基础上,结合药物研究进展、相关的技术指导原则及目前沟通交流经验,形成的对利拉鲁肽生物类似药临床研究策略和临床试验设计的建议,供药物研发的申办者和研究者参考。 |
|
7 |
新冠肺炎疫情期间药物临床试验管理指导原则(试行)(国家药监局药审中心通告2020年第13号) |
旨在对疫情期间应急批准的新冠肺炎药物(包括疫苗)临床试验和其他在研药物临床试验提出建议,供申办者和研究者参考。 |
|
8 |
利妥昔单抗注射液生物类似药临床试验指导原则(国家药监局药审中心通告2020年第14号) |
为进一步明确技术审评标准,提高企业研发效率,在原国家食品药品监督管理总局已发布的《生物类似药研发与评价技术指导原则(试行)》基础上,结合利妥昔单抗的特点,重点探讨当前普遍关注的临床研究策略和临床试验设计问题,以期为利妥昔单抗生物类似药的临床研发提供参考。 |
|
9 |
注射用曲妥珠单抗生物类似药临床试验指导原则(国家药监局药审中心通告2020年第15号) |
在原国家食品药品监督管理总局已发布的《生物类似药研发与评价技术指导原则(试行)》基础上,结合该品种的特点,对曲妥珠单抗生物类似药的临床试验策略和方案设计要点进行探讨,以期为研发相关人员提供参考。 |
|
10 |
药物临床试验数据递交指导原则(试行)(国家药监局药审中心通告2020年第16号) |
旨在对临床试验数据递交的内容及格式提出了具体要求,旨在指导申办方规范递交临床试验数据及相关资料,同时有助于数据管理、统计分析等相关从业人员更好的开展临床试验中的相关工作。 |
|
11 |
药物临床试验非劣效设计指导原则(国家药监局药审中心通告2020年第17号) |
旨在阐述非劣效试验的应用条件、设计要点、非劣效界值设定、统计推断以及其他监管考虑等方面内容,以指导临床试验各相关方能够正确地认识、实施和评价非劣效试验。 |
|
12 |
阿达木单抗注射液生物类似药临床试验指导原则(国家药监局药审中心通告2020年第18号) |
在原国家食品药品监督管理总局已发布的《生物类似药研发与评价技术指导原则(试行)》基础上,结合阿达木单抗的特点,重点探讨当前普遍关注的临床研究策略和临床试验设计问题,以期为阿达木单抗生物类似药的临床研发提供参考。 |
|
13 |
贝伐珠单抗注射液生物类似药临床试验指导原则(国家药监局药审中心通告2020年第19号) |
结合安维汀特点,撰写了本技术指导原则,将以审评视角,讨论贝伐珠单抗生物类似药的临床试验方案设计及审评考虑,以期规范和促进贝伐珠单抗生物类似药的研发。 |
|
14 |
新型冠状病毒预防用疫苗研发技术指导原则(试行)(国家药监局药审中心通告2020年第21号) |
结合近期疫苗研发中出现的新问题、疫苗研发工作的新需求,指导申请人开展相关研究工作。 |
|
15 |
新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)(国家药监局药审中心通告2020年第21号) |
用于指导应急状态下mRNA疫苗研制,明确现阶段对mRNA疫苗研发技术的基本要求。 |
|
16 |
新型冠状病毒预防用疫苗非临床有效性研究与评价技术要点(试行)(国家药监局药审中心通告2020年第21号) |
用于指导应急状态下新冠疫苗研制,明确现阶段对新冠疫苗药效学评价的基本要求。 |
|
17 |
新型冠状病毒预防用疫苗临床研究技术指导原则(试行)(国家药监局药审中心通告2020年第21号) |
用于指导应急状态下新冠疫苗研制,指导现阶段对新冠疫苗临床研究的基本要求。 |
|
18 |
新型冠状病毒预防用疫苗临床评价指导原则(试行)(国家药监局药审中心通告2020年第21号) |
用于指导应急状态下新冠疫苗研制,明确现阶段对新冠疫苗临床评价的基本要求。 |
|
19 |
真实世界研究支持儿童药物研发与审评的技术指导原则(试行)(国家药监局药审中心通告2020年第22号) |
着重介绍现阶段真实世界研究支持儿童药物研发时的常见情形及关注点,有关真实世界研究的基础概念、基本原则、研究设计及统计方法学等内容 |
|
20 |
急性淋巴细胞白血病药物临床试验中检测微小残留病的技术指导原则(国家药监局药审中心通告2020年第23号) |
针对在研发的急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)新药,对临床研究尤其关键性注册临床研究中进行微小残留病(Minimal residual disease,MRD)检测提出观点和建议,适用于在成人和儿童ALL人群中开展的临床研究,供药物研发的申请人和研究者参考。 |
|
21 |
新型冠状病毒中和抗体类药物申报临床药学研究与技术资料要求指导原则(试行)(国家药监局药审中心通告2020年第24号) |
适用于新冠中和抗体类药物申报临床阶段的药学研究。新冠中和抗体类药物以基因重组技术制备的单克隆抗体为主,也包括抗体片段、Fc融合蛋白、双特异性抗体等。此类抗体药物有可能单独或联合用于新冠肺炎的治疗与预防。 |
|
22 |
年龄相关性黄斑变性治疗药物临床研究技术指导原则(国家药监局药审中心通告2020年第25号) |
旨在为治疗年龄相关性黄斑变性的化学药物和生物制品的开发提供有关临床试验设计、实施和评价的方法学指导。 |
|
23 |
药物临床试验数据监查委员会指导原则(试行)(国家药监局药审中心通告2020年第27号) |
主要阐述临床试验数据监查委员会(Data Monitoring Committee, DMC)在临床试验中的职责、任务和组成,以及 DMC运行过程中的操作规范和统计学考虑,并强调DMC的独立性以及对利益冲突的规避原则,旨在为申办者提供DMC建立与实施的指导性建议,以确保DMC的规范运作和顺利实施。 |
|
24 |
急性细菌性皮肤及皮肤结构感染抗菌药物临床试验技术指导原则(国家药监局药审中心通告2020年第28号) |
为针对拟用于急性细菌性皮肤及皮肤结构感染药物临床试验提供更加精准的技术指导,解决临床试验中的重点问题,规范其临床试验,保证数据完整性,为注册申请人、临床试验研究者在规划、设计、实施临床试验中提供技术指导。 |
|
25 |
社区获得性细菌性肺炎抗菌药物临床试验技术指导原则(国家药监局药审中心通告2020年第28号) |
为针对拟用于社区获得性细菌性肺炎抗菌药物临床试验提供更加精准的技术指导,解决临床试验中的重点问题,规范其临床试验,保证数据完整性,为注册申请人、临床试验研究者在规划、设计、实施临床试验中提供技术指导。 |
|
26 |
境外已上市境内未上市药品临床技术要求(国家药监局药审中心通告2020年第29号) |
为加快境外已上市境内未上市原研药品及仿制药品研发上市进程,依据《药品注册管理办法》及其配套文件,结合《国家药监局关于发布接受药品境外临床试验数据的技术指导原则的通告》(2018年第52号),制定对此类药品临床研究和评价的技术要求。 |
|
27 |
放射性体内诊断药物临床评价技术指导原则(国家药监局药审中心通告2020年第30号) |
用于在单光子发射计算机断层扫描(SPECT)、正电子发射断层扫描(PET) 等核医学检查中使用的放诊药物,主要针对放诊药物与非放射性治疗药物在临床研发中不同的关注点进行说明。 |
|
28 |
中药新药用药材质量控制研究技术指导原则(试行)(国家药监局药审中心通告2020年第31号) |
包括药材基原与药用部位、产地、种植养殖、采收与产地加工、包装与贮藏及质量标准等内容,旨在为中药新药用药材的质量控制研究提供参考。 |
|
29 |
中药新药用饮片炮制研究指导原则(国家药监局药审中心通告2020年第31号) |
包括炮制工艺、炮制用辅料、饮片标准、包装与贮藏等内容,旨在为中药新药用饮片炮制的研究提供参考。 |
|
30 |
中药新药质量标准研究技术指导原则(国家药监局药审中心通告2020年第31号) |
旨在为中药新药质量标准研究提供技术指导,重点阐述中药新药质量标准研究及质量标准制定的基本要求,天然药物的质量标准研究也可参照本指导原则。 |
|
31 |
化学药品注射剂包装系统密封性研究技术指南(试行)(国家药监局药审中心通告2020年第33号) |
参考相关技术指导原则和标准起草制订,重点对注射剂包装系统密封性检查方法的选择和验证进行阐述,旨在促进现阶段化学药品注射剂的研究和评价工作的开展。 |
|
32 |
化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(国家药监局药审中心通告2020年第33号) |
旨在阐述一种基于科学和风险的研究思路来开展注射剂生产过程中使用的塑料组件系统的相容性研究。制剂申请人作为第一责任主体,对确保生产使用的塑料组件系统符合预期用途负有最终责任。 |
|
33 |
化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(国家药监局药审中心通告2020年第35号) |
为进一步完善化学仿制药研究和申报的技术要求,现参考各国监管机构相关的技术要求并结合中国药典及中国仿制药研发与生产现状而制定。 |
|
34 |
盐酸多柔比星脂质体注射液仿制药研究技术指导原则(试行)(国家药监局药审中心通告2020年第36号) |
根据采用硫酸铵梯度法制备的盐酸多柔比星脂质体注射液的制剂特点,提出仿制药开发过程中药学研究、非临床研究和生物等效性研究的技术要求,旨在为该仿制药的研发提供技术指导。 |
|
35 |
注射用紫杉醇(白蛋白结合型)仿制药研究技术指导原则(国家药监局药审中心通告2020年第36号) |
结合注射用紫杉醇(白蛋白结合型)的制剂特点,提出仿制药开发过程中药学研究、非临床研究和生物等效性研究的技术要求,旨在为该仿制药的研发提供技术指导。 |
|
36 |
中药新药研究各阶段药学研究技术指导原则(试行)(国家药监局药审中心通告2020年第37号) |
主要针对中药新药申请临床试验、3期临床试验前、申请上市许可及上市后研究各阶段需要完成的药学主要研究内容提出基本要求,为中药新药研究提供参考。 |
|
37 |
中药均一化研究技术指导原则(试行)(国家药监局药审中心通告2020年第38号) |
旨在减少中药材的质量差异导致的中药制剂质量波动,提高中药制剂批间质量一致性。 |
|
38 |
中药新药研究过程中沟通交流会的药学资料要求(试行)(国家药监局药审中心通告2020年第39号) |
旨在为申请人准备中药新药研究过程中沟通交流会的药学资料提供指导。 |
|
39 |
化学药品创新药1期临床试验申请药学共性问题相关技术要求》和《化学药品1期临床试验申请药学研究信息汇总表(修订版)》(国家药监局药审中心通告2020年第40号) |
结合审评中发现部分创新药1期临床试验申请仍然存在一些安全性内容相关的药学问题。为了更好地实施《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》(2018年第50号),促进创新药的研究和开发,本技术要求对创新药1期临床试验申请药学共性问题进行总结,以供申请人参考。 |
|
40 |
药品附条件批准上市技术指导原则(试行)(国家药监局药审中心通告2020年第41号) |
旨在鼓励以临床价值为导向的药物创新,加快具有突出临床价值的临床急需药品上市,规范药品附条件批准相关技术要求。 |
|
41 |
中药复方制剂生产工艺研究技术指导原则(试行)(国家药监局药审中心通告2020年第43号) |
主要用于指导申请人开展以中药饮片为原料的中药复方制剂生产工艺研究。主要内容包括前处理研究、提取纯化与浓缩干燥研究、成型研究、包装选择研究、中试研究、商业规模生产研究、工艺验证等。 |
|
42 |
晚期肝细胞癌临床试验终点技术指导原则(国家药监局药审中心通告2020年第44号) |
旨在阐述当前晚期肝细胞癌临床试验终点的一般性设计与审评考虑,期望为抗肿瘤药物研发人员在晚期肝细胞癌(hepatocellular carcinoma, HCC)临床试验设计和终点选择方面提供参考,提高研发效率,使患者早日获益。 |
|
43 |
GnRH激动剂用于晚期前列腺癌临床试验设计指导原则(国家药监局药审中心通告2020年第45号) |
针对中国在研的GnRH激动剂晚期前列腺癌适应症的临床研究设计提出建议,供申请人和研究者参考。本技术指导原则不涵盖GnRH抑制剂的临床研究设计。 |
|
44 |
单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则(国家药监局药审中心通告2020年第46号) |
旨在保障抗肿瘤药以充分科学依据开展关键单臂试验,帮助申请人提高研发效率并与中心更高效地沟通,以期为计划以单臂试验支持上市的抗肿瘤药进入上市许可申请前临床方面沟通交流提供资料准备建议和技术指导。 |
|
45 |
单臂试验支持上市的抗肿瘤药进入关键试验前临床方面沟通交流技术指导原则(国家药监局药审中心通告2020年第47号) |
旨在保障抗肿瘤药以充分科学依据开展关键单臂试验,帮助申请人提高研发效率并与中心更高效地沟通,以期为计划以单臂试验支持上市的抗肿瘤药进入关键试验(即支持药品上市许可申请的临床试验)前临床方面沟通交流提供资料准备建议和技术指导。 |
|
46 |
经口吸入制剂仿制药生物等效性研究指导原则(国家药监局药审中心通告2020年第49号) |
根据经口吸入制剂的特殊性,提出在仿制药开发时进行药学和人体生物等效性研究的方法,旨在为经口吸入制剂仿制药的研发提供技术指导。 |
|
47 |
中药生物效应检测研究技术指导原则(试行)(国家药监局药审中心通告2020年第50号) |
旨在鼓励探索研究中药生物效应检测方法,完善中药质量控制体系。主要包括检测方法的选择、供试品的选择和制备、参照物的选择和标定、试验系的选择、检测指标的选择、判定标准、方法学验证、结果统计与分析评价等。 |
|
48 |
控制近视进展药物临床研究技术指导原则(国家药监局药审中心通告2020年第51号) |
旨在为控制近视进展的新化学药物和生物制品的开发提供有关临床试验设计、实施和评价的方法学指导。 |
|
49 |
化学仿制药透皮贴剂药学研究技术指导原则(试行)(国家药监局药审中心通告2020年第52号) |
为化学仿制药透皮贴剂的药学方面相关研发研究工作提供参考,重点讨论透皮贴剂在药学方面的特殊性问题,对其他药学一般性问题可参照已发布的相关指导原则执行。 |
|
50 |
化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)(国家药监局药审中心通告2020年第53号) |
主要适用于注射剂申请上市以及上市后变更等注册申报过程中对灭菌/无菌工艺进行的研究和验证工作,相关仪器设备等的验证及常规再验证不包括在本指导原则的范围内。 |
|
51 |
化学药品改良型新药临床试验技术指导原则(国家药监局药审中心通告2020年第54号) |
阐述化药改良新药的临床优势,以及不同优势的化药改良新药的临床试验设计与评价原则,以期为化药改良新药临床研发提供技术指导和参考。 |
|
52 |
抗肿瘤药联合治疗临床试验技术指导原则(国家药监局药审中心通告2020年第55号) |
适用于两个或两个以上抗肿瘤新药之间的联合治疗,以及新药与标准治疗或已上市药品的联合治疗。将依据不同的联合治疗临床试验阶段阐述抗肿瘤药联合治疗的试验设计原则和获益评价,以期为抗肿瘤药联合治疗提供参考,科学有序研发。 |
|
53 |
抗肿瘤创新药上市申请安全性总结资料准备技术指导原则(国家药监局药审中心通告2020年第56号) |
从抗肿瘤创新药的安全性数据来源、标准化和具体撰写建议方面,针对首次递交上市申请的抗肿瘤创新药产品,在安全性资料的整理、分析和汇总方面提供建议,为申请人后续参照ICH相关技术指导原则准备申报资料的安全性部分内容提供参考。 |
|
54 |
中药新药用于糖尿病肾脏疾病临床研究技术指导原则(国家药监局药审中心通告2020年第57号) |
适用于针对异常蛋白尿伴或不伴有eGFR下降的糖尿病肾脏疾病的中药新药临床试验设计。研究者应根据其药物组方依据的中医药理论和既往人用经验,明确目标药物的治疗作用及临床试验目的,设计科学、规范且可行的临床试验方案,以评价中药新药用于糖尿病肾脏疾病的有效性和安全性。 |
|
55 |
中药新药用于慢性便秘临床研究技术指导原则(国家药监局药审中心通告2020年第57号) |
旨在为针对慢性便秘开发的中药新药的临床试验提供建议和指导。慢性便秘治疗的主要目的是缓解临床症状,提高患者生存质量。中医药治疗慢性便秘有一定的临床特色和优势。 |
|
56 |
模型引导的药物研发技术指导原则(国家药监局药审中心通告2020年第59号) |
旨在提出模型引导药物研发的一般考虑。建模与模拟技术已应用于药物研发的多个阶段,可在药物研发的多个关键决策点发挥重要作用。为引导和规范模型、引导的药物研发相关方法的合理使用。 |
|
57 |
药物临床试验富集策略与设计指导原则(试行)(国家药监局药审中心通告2020年第60号) |
阐述了常用的富集策略与设计的原理与方法、各自的优缺点,并从实际应用和监管角度说明需要考虑的关键问题。 |
|
58 |
抗肿瘤药物临床试验统计学设计指导原则(试行)(国家药监局药审中心通告2020年第61号) |
旨在针对抗肿瘤药物临床试验设计中的关键统计学技术问题,提供科学建议,为申办者开展抗肿瘤药物的临床研发提供参考。 |
|
59 |
窄治疗指数药物生物等效性研究技术指导原则(国家药监局药审中心通告2020年第62号) |
旨在为窄治疗指数药物开展以药动学参数为主要终点指标的生物等效性研究提供研究设计、统计分析、结果报告等方面的技术指导。 |
|
60 |
群体药代动力学研究技术指导原则(国家药监局药审中心通告2020年第63号) |
基于当前对群体PK研究的理解和认识,提供相关考虑要点和一般的科学性指导,以帮助合理开展和应用群体PK研究。未来随着学科的不断发展,需基于科学判断开展研究和分析。 |
|
61 |
药物临床试验亚组分析指导原则(试行)(国家药监局药审中心通告2020年第64号) |
主要阐述了亚组的识别和定义、亚组分析的类型、一般考虑以及确证性临床试验中的亚组分析等方面的内容,旨在为申办者能够在临床试验中对亚组分析进行正确地设计、实施和评价提供指导性建议。 |
|
62 |
药物临床试验协变量校正指导原则(国家药监局药审中心通告2020年第65号) |
旨在阐明确证性随机对照临床试验中协变量的处理原则,并为试验设计、统计分析、临床试验报告中如何处理和解读重要的协变量提供建议。 |
|
63 |
药物临床试验多重性问题指导原则(试行)(国家药监局药审中心通告2020年第66号) |
阐述常见的多重性问题和相应的决策策略,介绍常用的多重性调整方法和多重性分析方法,旨在为确证性药物临床试验中如何控制FWER提供指导意见,所讨论的一般原则也适用于其它类型的临床研究。 |
|
64 |
儿童用药(化学药品)药学开发指导原则(试行)(国家药监局药审中心通告2020年第67号) |
从给药途径和剂型的选择、原料药、辅料、包装系统和给药装置、患者可接受性等方面阐述儿童用药药学开发的特点,旨在为儿童用药的药学开发提供研发思路和技术指导。 |
|
65 |
治疗脂代谢紊乱药物临床试验技术指导原则(国家药监局药审中心通告2020年第68号) |
旨在为治疗脂代谢紊乱药物的临床试验提供技术建议,适用于化学药品和治疗用生物制品的药物研发。 |
|
66 |
复杂性尿路感染抗菌药物临床试验技术指导原则(国家药监局药审中心通告2020年第69号) |
用于复杂性尿路感染抗菌药物临床试验提供更加精准的技术指导,解决临床试验中的重点问题,规范其临床试验,保证数据完整性。 |
|
67 |
单纯性尿路感染抗菌药物临床试验技术指导原则(国家药监局药审中心通告2020年第69号) |
用于单纯性尿路感染抗菌药物临床试验提供更加精准的技术指导,解决临床试验中的重点问题,规范其临床试验,保证数据完整性。 |
|
68 |
抗菌药物临床试验微生物学实验技术指导原则(国家药监局药审中心通告2020年第69号) |
阐述与抗菌药物临床试验相匹配的微生物学实验的基本技术要求和管理要求,主要对药品注册申请人和临床试验研究者有关的抗菌药物临床试验微生物学实验研究提出原则性技术要求。 |
|
69 |
抗肺结核药物临床试验技术指导原则(国家药监局药审中心通告2020年第69号) |
适用于在肺结核患者人群中开展的治疗用抗肺结核药物临床试验,包括由敏感和各种类型耐药的结核分枝杆菌所致的肺结核(除外结核性胸膜炎),不包括肺外结核、潜伏性结核感染、密切接触者预防、由疫苗接种引起的卡介菌病等。 |
|
70 |
医院获得性细菌性肺炎/呼吸机相关性肺炎抗菌药物临床试验技术指导原则(国家药监局药审中心通告2020年第69号) |
适用于在医院获得性细菌性肺炎/呼吸机相关细菌性肺炎患者人群中开展的治疗用抗菌药物临床试验,包括由肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和金黄色葡萄球菌等所致的医院获得性细菌性肺炎/呼吸机相关细菌性肺炎。 |
|
71 |
儿科用药临床药理学研究技术指导原则(国家药监局药审中心通告2020年第70号) |
旨在为儿科人群的临床药理学研究提供指导,通常需收集不同年龄段的药代动力学(PK)、药效动力学(PD)及其影响因素数据,支持最优剂量的探索与确定,支持儿科人群临床治疗方案的制定,以及安全性、有效性评估。 |
附件7
2020年境外已上市临床急需新药审评审批情况
|
序号 |
药品名称 |
企业名称 |
首次 |
欧美日首次 |
适应症 |
状态 |
通用名 |
|
1 |
Elosulfase Alfa |
Biomarin Pharmaceutical Inc. |
美国 |
2014/2/14 |
IVA型黏多糖贮积症 |
已批准 |
依洛硫酸酯酶a注射液 |
|
2 |
Selexipag |
Actelion Pharmaceuticals Ltd |
美国 |
2015/12/21 |
肺动脉高压 |
已批准 |
司来帕格片 |
|
3 |
Denosumab |
Amgen Europe B.V. |
欧盟 |
2010/5/26 |
骨转移性实体瘤,骨癌,实体瘤,巨骨细胞瘤,多发性骨髓瘤,高钙血症,类风湿性关节炎,骨质疏松症 |
已批准 |
地舒单抗注射液 |
|
4 |
Fingolimod HCl Oral Capsules |
Novartis Pharmaceuticals Corp |
美国 |
2010/9/21 |
多发性硬化症 |
已批准 |
盐酸芬戈莫德胶囊 |
|
5 |
Secukinumab |
Novartis Pharma K.K. |
日本 |
2014/12/26 |
银屑病,银屑病关节炎,强直性脊柱炎 |
已批准 |
司库奇尤单抗注射液 |
|
6 |
Ixekizumab |
ELILILLYANDCOMPANY |
美国 |
2016/3/22 |
斑块状银屑病,银屑病关节炎,红皮病型银屑病,脓疱型银屑病,寻常型银屑病 |
已批准 |
依奇珠单抗注射液 |
|
7 |
Nusinersen |
BIOGENIDECINC |
美国 |
2016/12/23 |
脊髓性肌萎缩 |
已批准 |
诺西那生钠注射液 |
|
8 |
Guselkumab |
JANSSENBIOTECH |
美国 |
2017/7/13 |
红皮病型银屑病,斑块状银屑病,脓疱型银屑病,银屑病关节炎,寻常型银屑病 |
已批准 |
古塞奇尤单抗注射液 |
|
9 |
Shingrix Zoster Vaccine Recombinant, Adjuvanted |
GlaxoSmithKline Biologicals Rue de |
美国 |
2017/10/20 |
用于50岁及以上成人预防带状疱疹 |
已批准 |
重组带状疱疹疫苗(CHO细胞) |
|
10 |
Ledipasvir And Sofosbuvir |
Gilead Sciences Inc |
美国 |
2014/10/10 |
丙肝 |
已批准 |
来迪派韦索磷布韦片 |
|
11 |
Sofosbuvir; Velpatasvir; Voxilaprevir |
Gilead Sciences Inc |
美国 |
2017/7/18 |
丙肝 |
已批准 |
索磷布韦韦帕他韦伏西瑞韦片 |
|
12 |
Alectinib Hydrochloride |
Chugai Pharmaceutical Co., Ltd. |
日本 |
2014/7/4 |
间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌,非小细胞肺癌 |
已批准 |
盐酸阿来替尼胶囊 |
|
13 |
Pembrolizumab |
Merck Sharp & Dohme Corp. |
美国 |
2014/9/4 |
晚期黑色素瘤,转移性黑色素瘤,非小细胞肺癌,头颈癌,黑色素瘤 |
已批准 |
帕博利珠单抗注射液 |
|
14 |
Olaparib |
AstraZeneca AB |
欧盟 |
2014/12/16 |
晚期卵巢癌,原发性腹膜癌,输卵管癌,上皮性卵巢癌,BRCA突变的晚期卵巢癌 |
已批准 |
奥拉帕利片 |
|
15 |
Evolocumab |
Amgen Europe B.V. |
欧盟 |
2015/7/15 |
高胆固醇血症 |
已批准 |
依洛尤单抗注射液 |
|
16 |
Eculizumab |
欧盟:Alexion Europe SAS; |
欧盟 |
2007/6/20 |
阵发性睡眠性血红蛋白尿症,非典型溶血尿毒综合征 |
已批准 |
依库珠单抗注射液 |
|
17 |
Teriflunomide |
sanofi-aventis recherche & developpement |
美国 |
2012/9/12 |
多发性硬化症 |
已批准 |
特立氟胺片 |
|
18 |
Palbociclib |
PfizerInc |
美国 |
2015/2/3 |
乳腺癌 |
已批准 |
哌柏西利胶囊 |
|
19 |
Elvitegravir, Cobicistat, Emtricitabine, And Tenofovir Alafenamide |
Gilead Sciences Inc |
美国 |
2015/11/5 |
艾滋病 |
已批准 |
艾考恩丙替片 |
|
20 |
Fabrazyme(Agalsidase Beta) |
Genzyme Europe B.V. |
欧盟 |
2001/3/8 |
法布雷病 |
已批准 |
注射用阿加糖酶β |
|
21 |
Erleada (apalutamide) |
Janssen Biotech, Inc. |
美国 |
2018/2/14 |
非转移性去势抵抗性前列腺癌 |
已批准 |
阿帕他胺片 |
|
22 |
Maviret(Glecaprevir/Pibrentasvir) |
AbbVie Deutschland GmbH Co. KG |
欧盟 |
2017/7/26 |
丙肝 |
已批准 |
格卡瑞韦哌仑他韦片 |
|
23 |
BIKTARVY(bictegravir, emtricitabine, and tenofovir alafenamide)Tablets |
Gilead Sciences,Inc |
美国 |
2018/2/7 |
艾滋病 |
已批准 |
比克恩丙诺片 |
|
24 |
Tracleer 32 mg dispersible tablets |
Janssen-Cilag International N V |
欧盟 |
2009/6/3 |
肺动脉高压 |
已批准 |
波生坦分散片 |
|
25 |
Radicava(Edaravone) |
Mitsubishi Tanabe Pharma Corporation |
日本 |
2015/6/1 |
肌萎缩侧索硬化 |
已批准 |
依达拉奉注射液 |
|
26 |
STELARA(ustekinumab) Injection |
Janssen Biotech, Inc. |
美国 |
2016/9/23 |
克罗恩病 |
已批准 |
乌司奴单抗注射液 |
|
27 |
Brodalumab |
Kyowa Hakko Kirin Co., Ltd. |
日本 |
2016/7/4 |
寻常型银屑病,银屑病关节炎,红皮病型银屑病,脓疱型银屑病,斑块状银屑病 |
已批准 |
布罗利尤单抗注射液 |
|
28 |
Vedolizumab |
Takeda Pharmaceuticals U.S.A., Inc. |
美国 |
2014/5/20 |
溃疡性结肠炎,克罗恩病 |
已批准 |
注射用维得利珠单抗 |
|
29 |
Tafamidis |
Pfizer Ltd |
欧盟 |
2011/11/16 |
转甲状腺素蛋白家族性淀粉样多发性神经病,甲状腺素运载蛋白淀粉样变性 |
已批准 |
氯苯唑酸葡胺软胶囊 |
|
30 |
Deutetrabenazine |
TEVABRANDEDPHARM |
美国 |
2017/4/3 |
迟发性运动障碍,亨廷顿氏舞蹈症 |
已批准 |
氘丁苯那嗪片 |
|
31 |
Cenegermin(Recombinant Human Nerve Growth Factor) |
Dompe farmaceutici s.p.a. |
欧盟 |
2017/7/6 |
角膜炎 |
已批准 |
塞奈吉明滴眼液 |
|
32 |
Aldurazyme (laronidase) |
BIOMARIN PHARMACEUTICAL INC. |
美国 |
2003/4/30 |
黏多糖贮积症I型 |
已批准 |
注射用拉罗尼酶浓溶液 |
|
33 |
Replagal(Agalsidase alfa) |
Shire Human Genetic Therapies AB |
欧盟 |
2001/3/8 |
法布雷病 |
已批准 |
阿加糖酶α注射用浓溶液 |
|
34 |
Revatio (Sildenafil Citrate) |
Pfizer Inc. |
美国 |
2009/11/18 |
肺动脉高压 |
已批准 |
枸橼酸西地那非片 |
|
35 |
Lokelma(sodium zirconium cyclosilicate) |
AstraZeneca AB |
欧盟 |
2018/3/22 |
高钾血症的成年患者的治疗 |
已批准 |
环硅酸锆钠散 |
|
36 |
Humira (adalimumab) |
AbbVie Deutschland GmbH Co. KG |
欧盟 |
2016/6/24 |
非感染性中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎。 |
已批准 |
阿达木单抗注射液 |
|
37 |
DUPIXENT Injection |
Regeneron Pharmaceuticals, Inc. |
美国 |
2017/3/28 |
中至重度特应性皮炎 |
已批准 |
度普利尤单抗注射液 |
|
38 |
Eucrisa (crisaborole) Ointment |
Anacor Pharmaceuticals, Inc. |
美国 |
2016/12/14 |
2岁及以上轻度至中度特应性皮炎 |
已批准 |
克立硼罗软膏 |
|
39 |
Crysvita (Burosumab) |
Kyowa Kirin Limited |
欧盟 |
2018/2/19 |
X连锁低磷佝偻病 |
完成审评 |
布罗索尤单抗注射液 |
|
40 |
Velaglucerase Alfa |
Shire Human Genetic Therapies Inc |
美国 |
2010/2/26 |
戈谢病 |
在审评 |
— |
|
41 |
ALPROLIX [Coagulation Factor IX (Recombinant), Fc Fusion Protein] |
Bioverativ Therapeutics Inc |
美国 |
2014/3/28 |
乙型血友病 |
在审评 |
— |
|
42 |
Icatibant |
Shire Orphan Therapies GmbH |
欧盟 |
2008/7/11 |
遗传性血管性水肿 |
在审评 |
— |
|
43 |
Careload LA (Beraprost sodium) |
東?株式会社 |
日本 |
2007/10/19 |
肺动脉高压 |
在审评 |
— |
|
44 |
Dinutuximab |
UnitedTherapeuticsCorporation |
美国 |
2015/3/10 |
神经母细胞瘤 |
在审评 |
— |
|
45 |
Tetrabenazine |
Prestwick |
美国 |
2008/8/15 |
亨廷顿氏舞蹈症 |
在审评 |
— |
|
46 |
Xospata(Gilteritinib fumarate) |
Astellas Pharma Inc. |
日本 |
2018/9/21 |
用于治疗FLT3突变阳性的复发或难治性急性髓细胞白血病。 |
在审评 |
— |
|
47 |
Tecfidera (dimethyl fumarate) Delayed-Release Capsules |
Biogen Idec, Inc. |
美国 |
2013/3/27 |
多发性硬化 |
在审评 |
— |
|
48 |
Xofluza(Baloxavir marboxil) |
(日本)Shionogi & Co., Ltd. 盐野义制药 |
日本 |
2018/2/23 |
治疗甲型和乙型流感 |
在审评 |
— |
|
49 |
Siltuximab |
Janssen Biotech, Inc. |
美国 |
2014/4/23 |
多中心卡斯特莱曼病 |
待申报 |
— |
|
50 |
Canakinumab |
Novartis Pharmaceuticals Corporation |
美国 |
2009/6/17 |
系统性幼年特发性关节炎,冷吡啉相关的周期性综合征,高免疫球蛋白D综合征,家族性地中海热,肿瘤坏死因子受体相关周期性综合症,关节炎 |
待申报 |
— |
|
51 |
Enasidenib mesylate |
CELGENECORP |
美国 |
2017/8/1 |
急性骨髓性白血病 |
待申报 |
— |
|
52 |
Olaratumab |
礼来 |
美国 |
2016/10/19 |
软组织肉瘤 |
待申报 |
— |
|
53 |
Luxturna Voretigene Neparvovec |
Spark Therapeutics, Inc. |
美国 |
2017/12/19 |
双等位RPE65突变相关的视网膜营养不良 |
待申报 |
— |
|
54 |
Biopten Granules 10%,2.5% |
Daiichi Sankyo Co., Ltd. |
日本 |
2013/8/20 |
1.降低因二氢喋啶合成酶和二氢喋啶还原酶缺乏导致的高苯丙氨酸血症患者的血清苯丙氨酸水平(a型高苯丙氨酸血症)。 |
待申报 |
— |
|
55 |
NORDITROPIN (somatropin) injection |
NOVO NORDISK INC |
美国 |
1.Noonan适应症于2007年批准2.Prader-Willi适应症于2018年批准 |
1.Noonan综合症 |
待申报 |
— |
|
56 |
Increlex (Mecasermin [rDNA origin]) Injection |
IPSEN INC |
美国 |
2005/8/30 |
儿童严重原发性胰岛素样因子1缺乏,生长激素受体基因缺陷,体内出现生长激素中和和抗体导致的生长不足的患儿 |
待申报 |
— |
|
57 |
Elaprase (Indursulfase) Injection |
Shire Human Genetic Therapies, Inc. |
美国 |
2006/7/24 |
黏多糖贮积症Ⅱ型 |
待申报 |
— |
|
58 |
Galafold(Migalastat hydrochloride) |
Amicus Therapeutics UK Ltd |
欧盟 |
2016/5/25 |
法布雷病 |
待申报 |
— |
|
59 |
Lysodren(mitotane) |
HRA Pharma |
美国 |
1970/7/8 |
肾上腺皮质癌 |
待申报 |
— |
|
60 |
Ruconest (Recombinant human C1-inhibitor) |
Pharming Group N.V. |
欧盟 |
2010/10/28 |
遗传性血管性水肿 |
待申报 |
— |
|
61 |
Lemtrada (Alemtuzumab) |
Sanofi Belgium |
欧盟 |
2013/9/12 |
多发性硬化 |
待申报 |
— |
|
62 |
Vigadrone(vigabatrin) |
Lundbeck Inc. |
美国 |
2009/8/21 |
1个月到2岁婴儿的婴儿痉挛症(IS);与其他疗法一起用于治疗10岁及以上成年人和儿童的顽固性复合部分发作性癫痫(CPS) |
待申报 |
— |
|
63 |
Ponatinib |
Ariad Pharmaceuticals Inc |
美国 |
2012/12/14 |
慢性髓细胞性白血病,急性淋巴细胞白血病,白血病 |
待申报 |
— |
|
64 |
Eliglustat |
Genzyme Corp |
美国 |
2014/8/19 |
戈谢病 |
待申报 |
— |
|
65 |
Vismodegib |
Genentech Inc |
美国 |
2012/1/30 |
基底细胞癌 |
待申报 |
— |
|
66 |
Apremilast |
Celgene Corp |
美国 |
2014/3/21 |
银屑病关节炎,银屑病 |
待申报 |
— |
|
67 |
Ecallantide |
Dyax Corp. |
美国 |
2009/12/1 |
遗传性血管性水肿 |
待申报 |
— |
|
68 |
Taliglucerase Alfa |
Pfizer Inc |
美国 |
2012/5/10 |
戈谢病 |
待申报 |
— |
|
69 |
Mipomersen Sodium |
Genzyme Corp |
美国 |
2013/1/29 |
纯合子家族性高胆固醇血症 |
待申报 |
— |
|
70 |
Sonidegib |
NovartisPharmaceuticalsCorp |
美国 |
2015/7/24 |
基底细胞癌 |
待申报 |
— |
|
71 |
Dinutuximab Beta |
EUSA Pharma (UK) Limited |
欧盟 |
2017/5/8 |
神经母细胞瘤 |
待申报 |
— |
|
72 |
Vorapaxar |
Merck Sharp And Dohme Corp |
美国 |
2014/5/8 |
心肌梗塞,周边动脉血管疾病,血栓性心血管病 |
待申报 |
— |
|
73 |
Dalfampridine |
Acorda Therapeutics Inc |
美国 |
2010/1/22 |
多发性硬化症 |
待申报 |
— |
|
74 |
Rilonacept |
Regeneron |
美国 |
2008/2/27 |
冷吡啉相关的周期性综合征,穆-韦二氏综合征,家族性寒冷型自身炎症综合征,家族性乳糜微粒血症 |
待申报 |
— |
|
75 |
Lomitapide |
Aegerion Pharmaceuticals Inc |
美国 |
2012/12/21 |
纯合子家族性高胆固醇血症,高胆固醇血症 |
待申报 |
— |
|
76 |
Vestronidase Alfa-Vjbk |
ULTRAGENYXPHARMINC |
美国 |
2017/11/15 |
VII型黏多糖贮积症 |
待申报 |
— |
|
77 |
Vernakalant Hydrochloride |
Cardiome UK Limited |
欧盟 |
2010/9/1 |
心房颤 |
待申报 |
— |
|
78 |
Cablivi(Caplacizumab) |
Ablynx NV |
欧盟 |
2018/9/3 |
获得性血栓性血小板减少性紫癜 |
待申报 |
— |
|
79 |
Tibsovo (ivosidenib) |
Agios Pharmaceuticals, Inc. |
美国 |
2018/7/20 |
急性髓系白血病 |
待申报 |
— |
|
80 |
Brineura (cerliponase alfa) Injection |
BioMarin Pharmaceutical Inc. |
美国 |
2017/4/27 |
晚发婴儿型神经元蜡样脂褐质沉积症(CLN2) |
待申报 |
— |
|
81 |
Verkazia(ciclosporin) |
Santen OY |
欧盟 |
2018/7/6 |
4岁以上儿童及青少年严重性春季角膜结膜炎(VKC) |
待申报 |
— |
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#药品审评#
34