FDA批准口服性脊髓性肌萎缩症(SMA)药物Evrysdi
2020-08-09 Allan MedSci原创
近日,FDA批准了Roche及其合作伙伴PTC Therapeutics的Evrysdi(risdiplam),使之成为首个针对两个月及两个月以上所有类型脊髓性肌萎缩症(SMA)患者的口服治疗药物。
近日,FDA批准了Roche及其合作伙伴PTC Therapeutics的Evrysdi(risdiplam),使之成为首个针对两个月及两个月以上所有类型脊髓性肌萎缩症(SMA)患者的口服治疗药物。Evrysdi(risdiplam)是一款SMN2拼接修饰剂,也称为RG7916,将由罗氏Genentech部门在美国销售。
FDA药物评估和研究中心的神经科学办公室主任Billy Dunn说道:“Evrysdi是首款治疗该疾病的口服药物,它为SMA患者提供了重要的治疗选择”。Biogen和Ionis Pharmaceuticals的Spinraza(nusinersen)需每四个月输注到椎管中,已于2016年获得美国监管机构的批准,而诺华的基因疗法Zolgensma(onasemnogene abeparvovec-xioi)去年已被批准用于SMA患者。
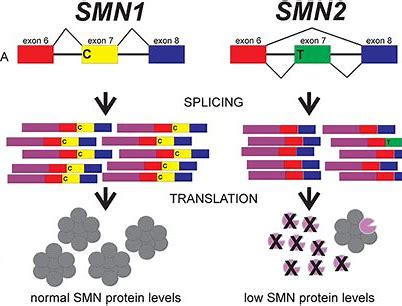
FDA关于Evrysdi的决定是基于FIREFISH和SUNFISH研究的结果。今年1月,罗氏(Roche)报告说,已针对1至7个月的1型SMA婴儿进行了FIREFISH试验。研究的第1部分评估了几种Evrysdi剂量,并确定第2部分的治疗剂量为0.2 mg / kg。该研究的第1部分结果表明,按照贝利婴幼儿发育量表第三版(BSID-III)的测量,接受治疗的婴儿中有41%能够获得至少五秒钟的无支撑坐姿的能力。此外,90%的婴儿在没有永久通气的情况下还活着,并且至少达到了15个月大;而81%的婴儿在经过至少23个月的治疗并达到28个月或更大的年龄后没有进行永久通气。
最近,罗氏(Roche)报告了FIREFISH第2部分的数据,该部分也达到了其主要目标,根据BSID-III的评估,到12个月时,有29%的婴儿能够在没有支撑的情况下能够保持坐姿5秒钟。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#萎缩#
29
#脊髓性肌萎缩#
34
#FDA批准#
32
#SMA#
32
#肌萎缩#
35
#髓性#
29
学习
104
阅读
114