Lancet oncol:因疗效太好,国产药索凡替尼用于晚期胰腺神经内分泌瘤的三期临床试验提前终止!
2020-09-23 MedSci原创 MedSci原创
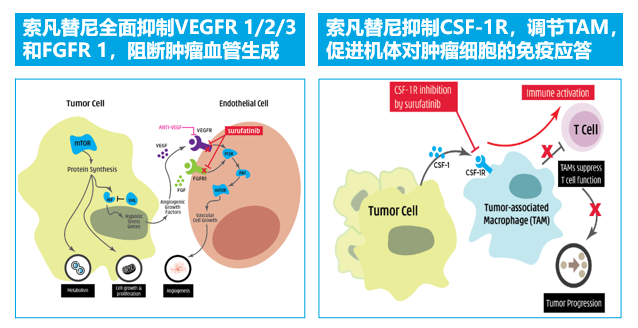
索凡替尼可显著延长晚期胰腺NET患者的无进展存活期,而且安全性良好,或可成为这类患者的潜在治疗选择。
在3期SANET-ep研究中,口服抗血管生成-免疫逃逸激酶抑制剂索凡替尼(Surufatinib)在胰腺外神经内分泌肿瘤(NETs)中显示出优越的疗效。SANET-p研究旨在评估索凡替尼用于晚期胰腺NET患者的疗效和安全性。
SANET-p研究是一项在中国的21家医院开展的随机、双盲、安慰剂为对照的3期试验,招募年满18岁的进展性、晚期、分化良好的胰腺NETs患者,且要求ECOG表现状态0-1分,经针对晚期病程的系统治疗(最多采用过两种)后病情进展。按2:1将患者随机分至索凡替尼组(300 mg,口服,1/日)或安慰剂组,直到病情进展、不可耐受的毒性、撤出研究、不良并发症、使用其他抗肿瘤药物、妊娠、失访或调查者评估停药。主要终点是无进展存活期。
2016年2月18日-2019年11月11日,筛选了264位患者,其中172位被随机分至两组:索凡替尼组 113人、安慰剂组 59人。索凡替尼组和安慰剂组分别中位随访了19.3个月和11.1个月。索凡替尼组和安慰剂组调查者评估的无进展存活期中位值分别是10.9个月 vs 3.7个月(风险比[HR] 0.49,95% CI 0.32-0.76,p=0.0011)。该试验在中期分析时符合早期停止标准,并在独立数据监控委员会的建议下终止。
最常见的3级及以上治疗相关不良反应有高血压(索凡替尼 vs 安慰剂组:38% vs 7%)、蛋白尿(10% vs 2%)和高甘油三酯血症(7% vs 0)。索凡替尼组和安慰剂组分别发生了25例(22%)和4例(7%)治疗相关的重度不良反应。索凡替尼组有3例治疗中死亡(2例死于不良反应:胃肠道出血[可能治疗相关]和颅内出血[不可能治疗相关];1例死于疾病进展)。安慰剂组有1例治疗中死亡,死于疾病进展。
综上所述,索凡替尼可显著延长晚期胰腺NET患者的无进展存活期,而且安全性良好,或可成为这类患者的潜在治疗选择。
原始出处:
Jianming Xu, et al. Surufatinib in advanced pancreatic neuroendocrine tumours (SANET-p): a randomised, double-blind, placebo-controlled, phase 3 study. The Lancet Oncology. September 20, 2020.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#三期临床#
42
#Oncol#
24
#三期临床试验#
29
#国产药#
39
#胰腺神经内分泌瘤#
27
#Lancet#
25
#神经内分泌#
23
#分泌#
27
#神经内分泌瘤#
39
很好
82