胰腺α-细胞研究全新成果汇总
2013-04-11 MedSci MedSci原创
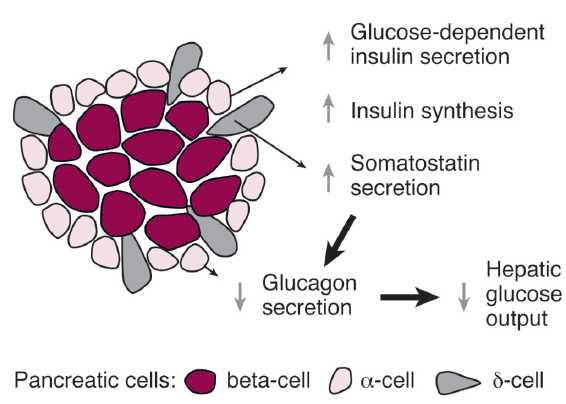
长期以来,胰岛β-细胞和胰岛素一直是糖代谢平衡调节和糖尿病发病与防治研究的“主角”。近年来由于细胞生物学和分子生物学的发展,提出胰腺α-细 胞在β-细胞的生长和胰岛素的分泌调节中,可能起着十分重要的作用。α-细胞可以产生和分泌两种不同的激素—Glucagon和GLP-1,前者可以抑制 β-细胞的生长和调节胰岛素分泌,升高血糖;后者则可促进β-细胞的增殖、存
长期以来,胰岛β-细胞和胰岛素一直是糖代谢平衡调节和糖尿病发病与防治研究的“主角”。近年来由于细胞生物学和分子生物学的发展,提出胰腺α-细 胞在β-细胞的生长和胰岛素的分泌调节中,可能起着十分重要的作用。α-细胞可以产生和分泌两种不同的激素—Glucagon和GLP-1,前者可以抑制 β-细胞的生长和调节胰岛素分泌,升高血糖;后者则可促进β-细胞的增殖、存活和胰岛素分泌,降低血糖。他们是胰岛β-Cell和胰岛素的主要调节者,可 能是糖尿病发病和防治的重要靶点。一个以GLP-1为中心的α-细胞新时代正向我们阔步走来——Alpha Cells Come of Age:
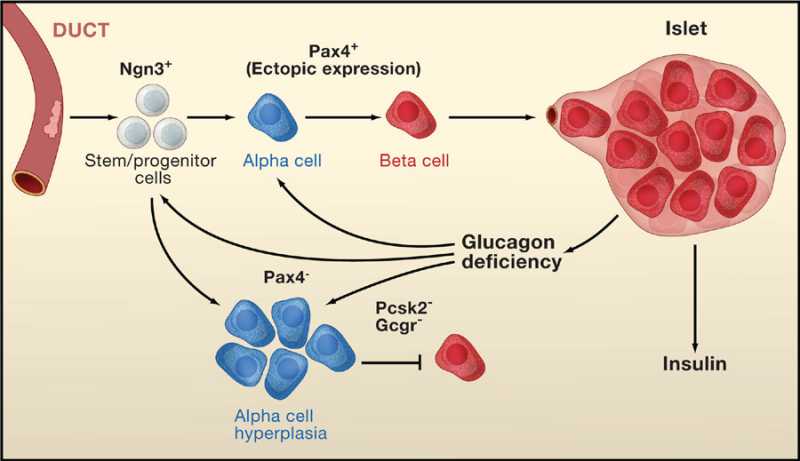
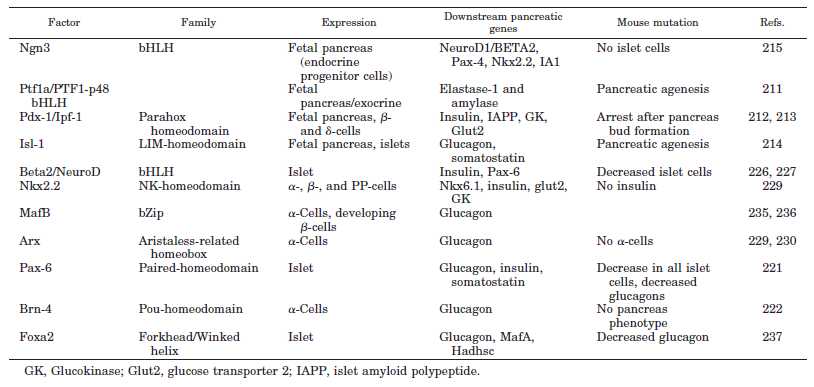
- α-细胞是β-细胞的前体细胞:近年来研究证明胰腺内分泌细胞来自胰腺前体细胞(Facultative Pancreatic Progenitor Cell,FPC),在转录因子(Pdx-1、NGn3等)的作用下,经内分泌前体细胞(Endocrin Progenitor Cell,EPC),分化为前胰岛α细胞(PAC),后者再在转录因子(Arx或Pax-4等)的作用下,分化为成熟的α-细胞和β-细胞。成熟α-细胞 是一类高度可塑性的细胞,在β-细胞受损时,它可通过表观重组(Epigenetic Reprogramming),直接转化为β-细胞。因此,α-细胞是a novel β-Cell Progenitor。
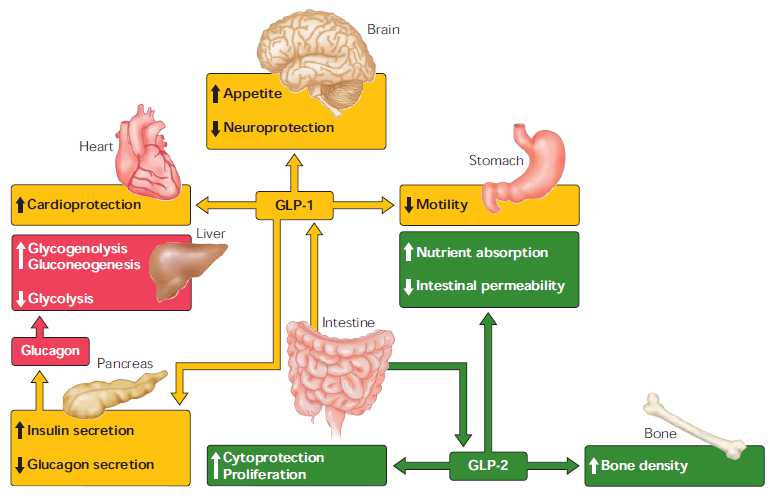
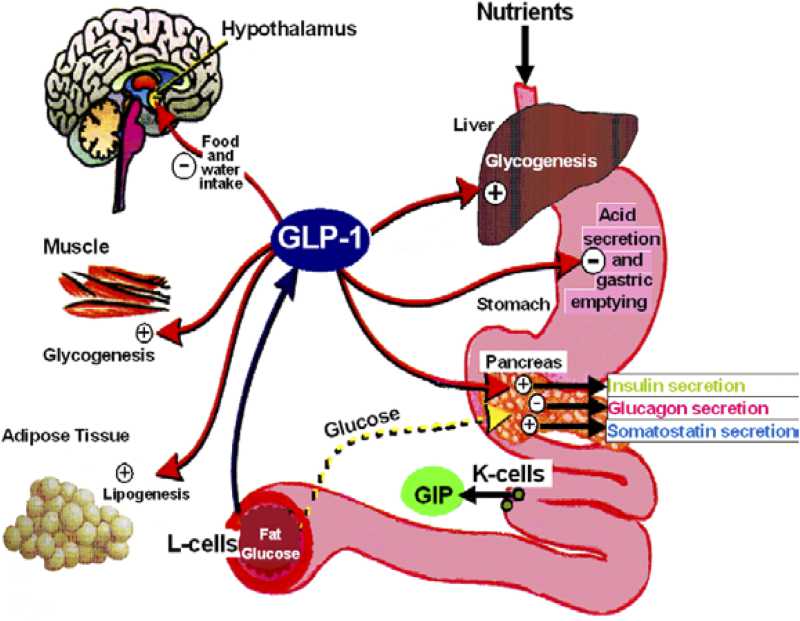
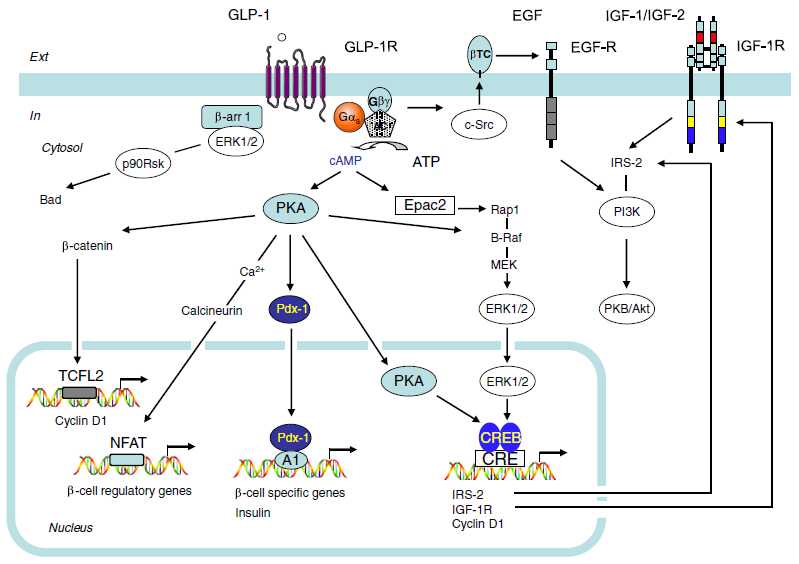
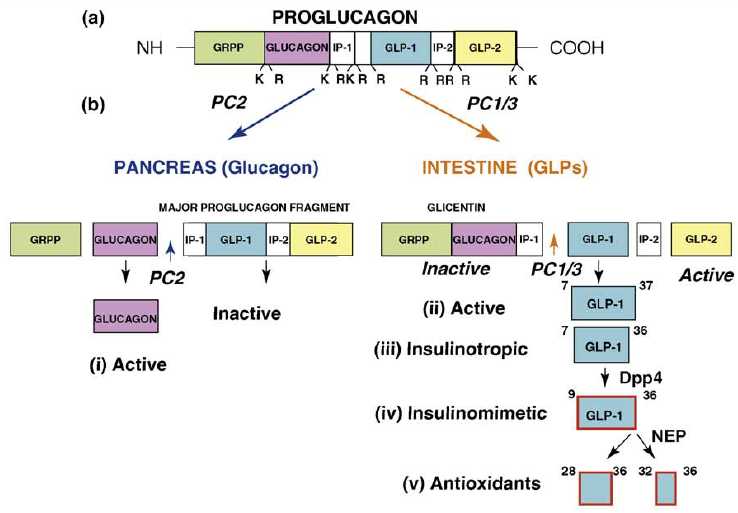
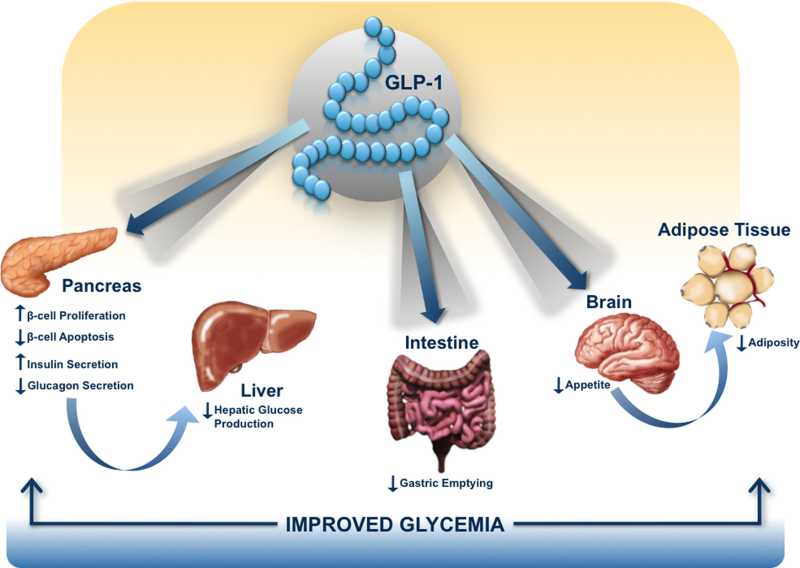
- 胰高血糖素样多肽-1(GLP-1)是β细胞的调节者:α-前体细胞(PAL)、α-细胞和肠L内分泌细胞都有 前胰高血糖素基因(Proglucogen)的表达,可以产生多种Proglucogen-Derived Peptides,在胰腺和肠道可以产生和分泌类胰高血糖素肽(Glucogen Like Peptide-1, GLP-1),它可以通过旁分泌和循环分泌促进β-细胞的生长和增殖,抑制β-细胞的凋亡,延长β-细胞的存活时间,促进胰岛素的合成、分泌和作用。它是 β-细胞生长和存活的维护因素,是胰岛素的调节者。
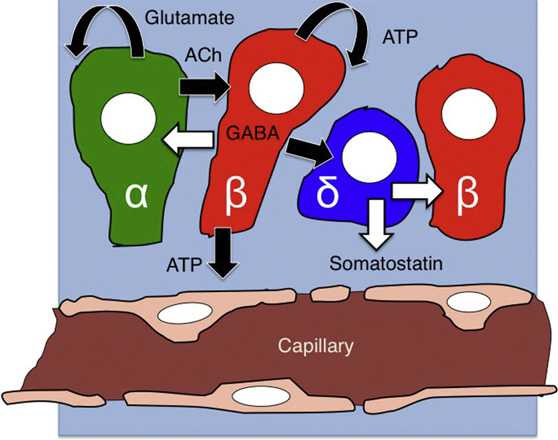
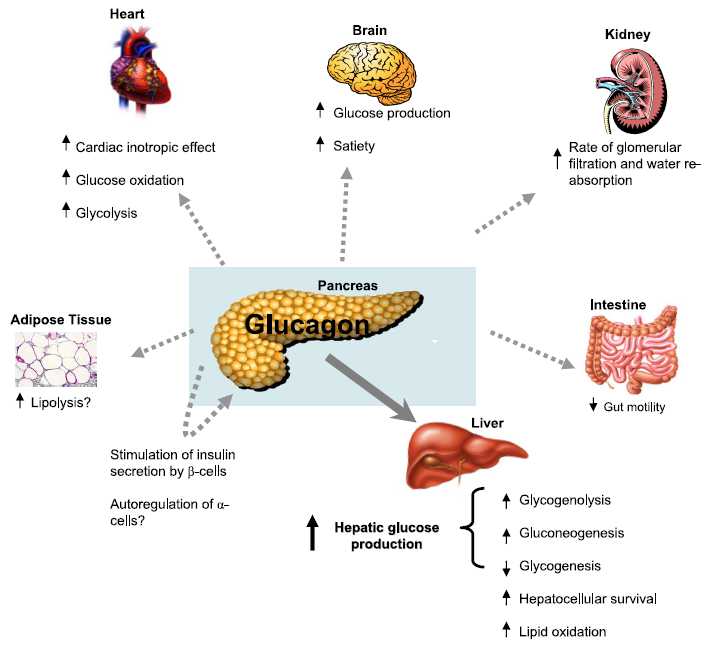
- 胰高血糖素调节β-细胞的生成和作用:成熟的α-细胞可以产生和分泌胰高血糖素,它不仅可以直接参与血糖的调 节,促进糖原分解和醣元异生,调节胰岛素分泌,使血糖升高。它还可以抑制FPC、EPC和α-前体细胞(PAC)的分化,抑制β-细胞的生成,调节β-细 胞的功能。此外,β-细胞还可分泌乙酰胆碱,通过旁分泌方式,调节β-细胞的功能和作用。
- 胰岛α-细胞是血糖平衡调节和防治糖尿病的关键因素:在正常情况下,胰岛β-细胞分泌胰岛素的降血糖作用和胰岛
α-细胞分泌胰高血糖素的升血糖作用相互平衡,以维持血糖的相对恒定。II型糖尿病和胰岛素耐受时,α/β细胞和胰岛素/胰高血糖素平衡失调,血糖升高。
补充和应用GLP-1,可以促进α-细胞向β-细胞转化,促进胰岛素的合成和作用,抑制胰高血糖素的分泌,减少肝糖原生成,增加糖的摄取和利用,可以遏制
血糖的升高,防治糖尿病。GLP-1调节胰岛素的分泌和作用,是血糖依赖性的,应用GLP-1不会产生低血糖。
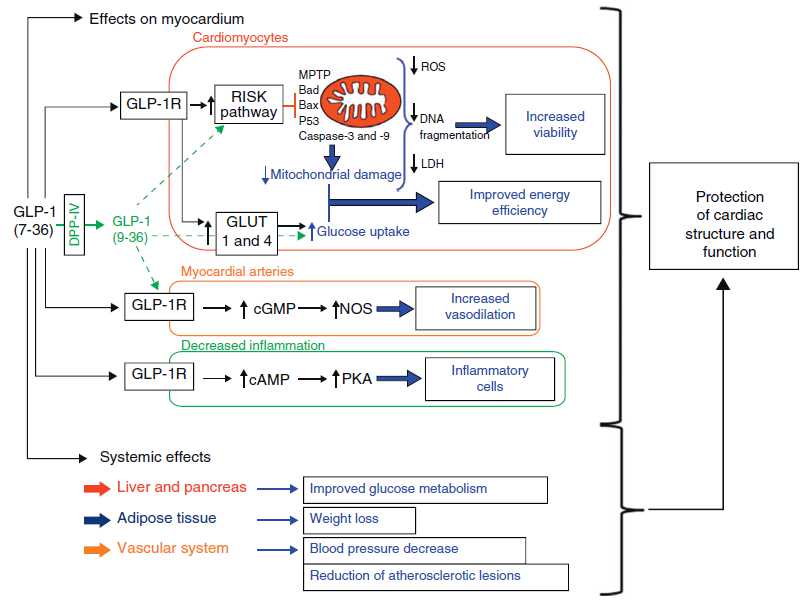
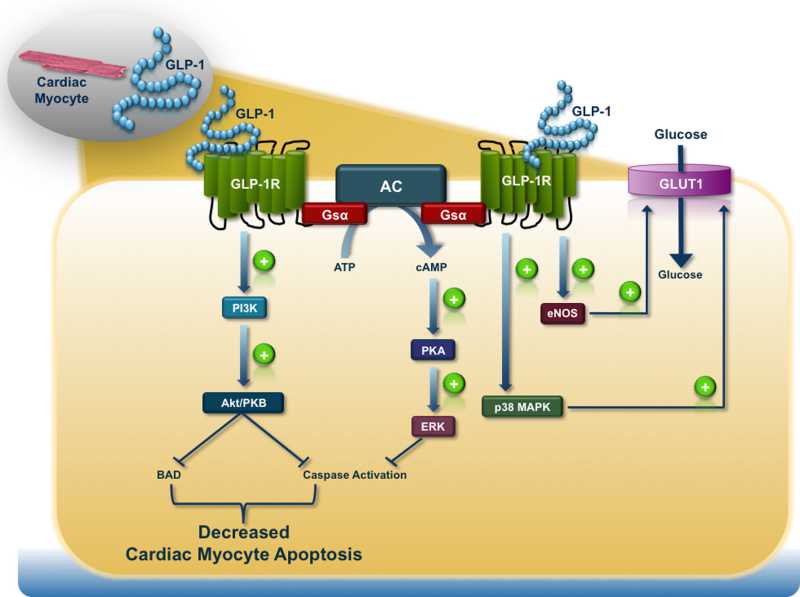
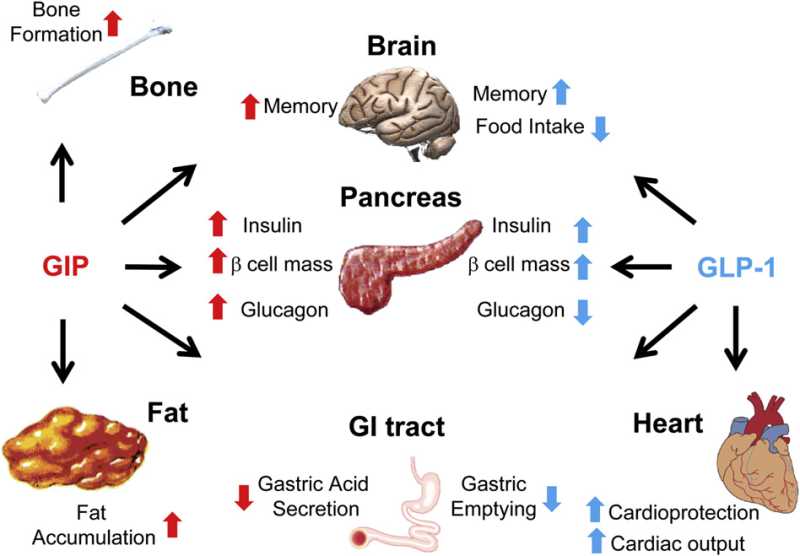
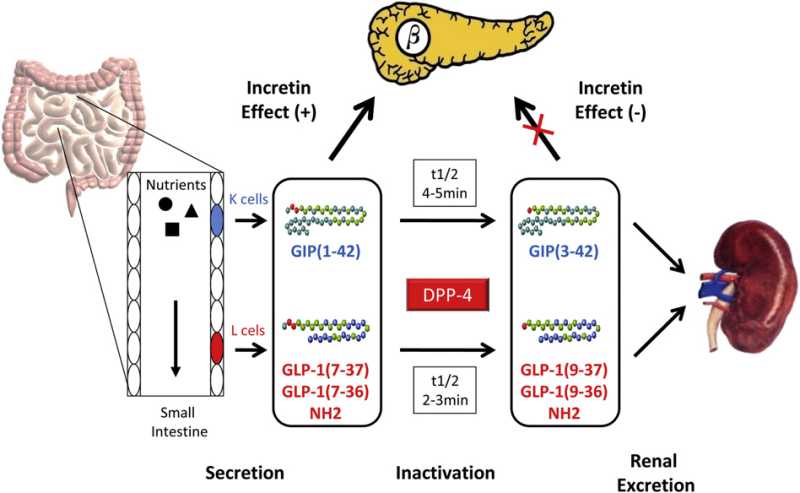
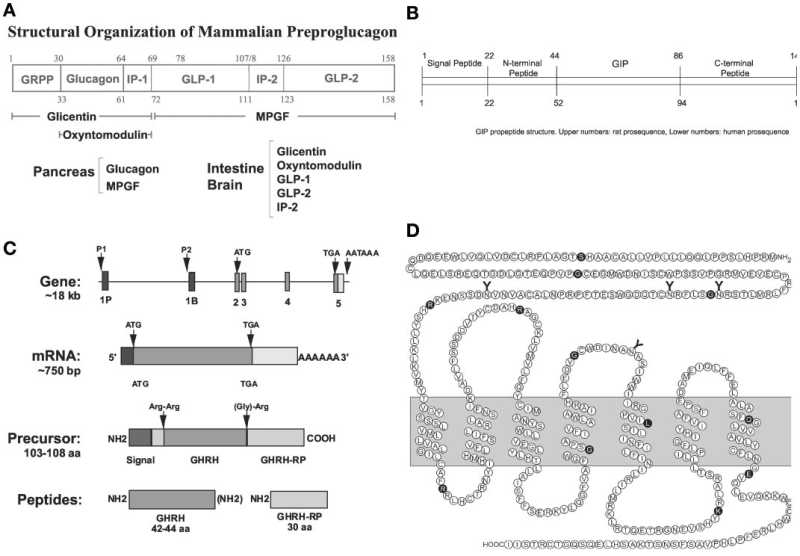
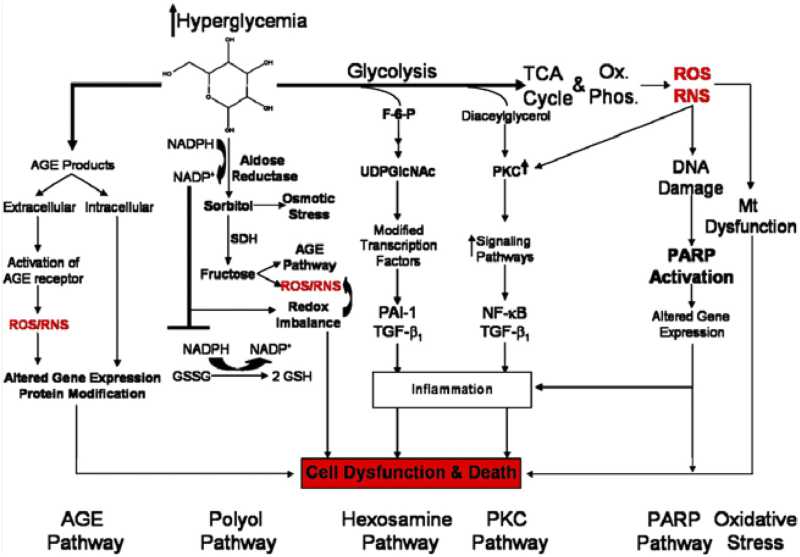
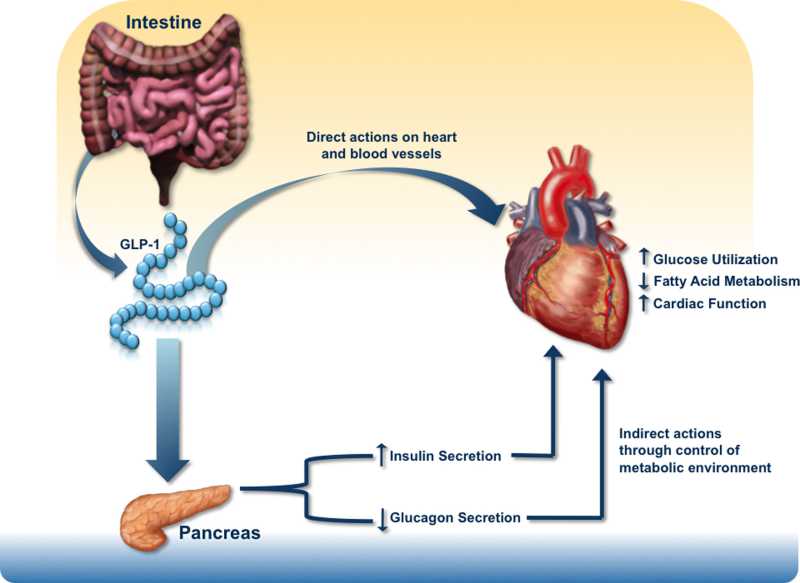
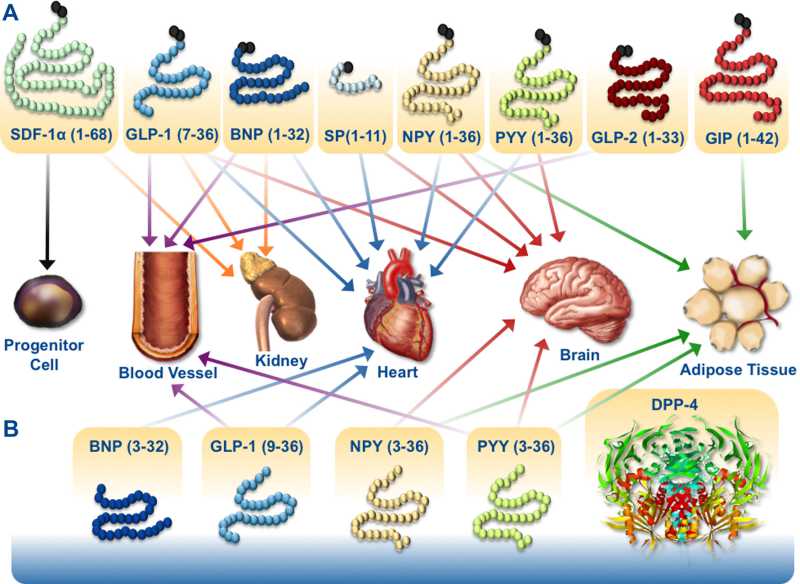
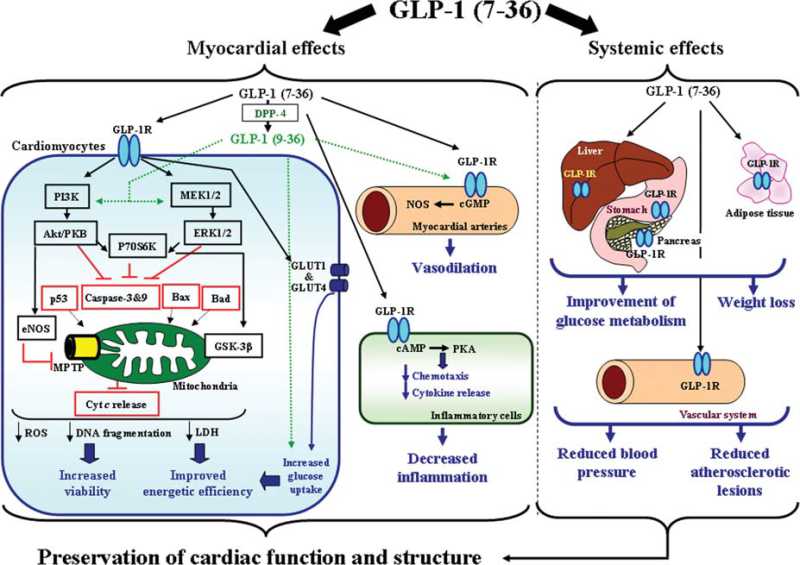
胰高血糖素原基因不仅可以表达和衍化成胰高血糖素和GLP-1,还可以衍化生成GLP-2、IP-1、IP-2、 GRPP、Glicent、MPGF和Oxyntomodulin等十几种多肽,肠道L-内分泌细胞分泌肠促胰岛素(Incretins),它不仅可以产 生GLP-1,还可以产生GIP。这些多肽都可以直接或间接调节胰岛素的生成和作用,影响糖平衡和糖代谢。 - 胰高血糖素样多肽(GLP-1)的心肌保护作用:α-前体细胞和肠L内分泌细胞产生和分泌的GLP-1不仅可以 调节胰岛β-细胞和胰岛素,防治糖尿病和调控血糖,而且还具有强大的心血管保护作用。它可通过GLP-1受体和cGMP与PARP-1途径,激活NOS, 产生NO,保护内皮,舒张血管,降低血压;它可以通过cAMP 和PKA途径,抑制血小板聚集,减少炎症细胞介质的释放,抑制和平滑肌细胞增殖、迁移和巨噬细胞/泡沫细胞形成,可防治动脉粥样硬化;它可以通过P13K /AKt和MAPK的途径,作用于心肌细胞和线粒体,降低ROS,LDH和DNA断裂,抑制心血管细胞凋亡,防治缺血/再灌注损伤,防治急性心梗和心功能 不全等心血管疾病。
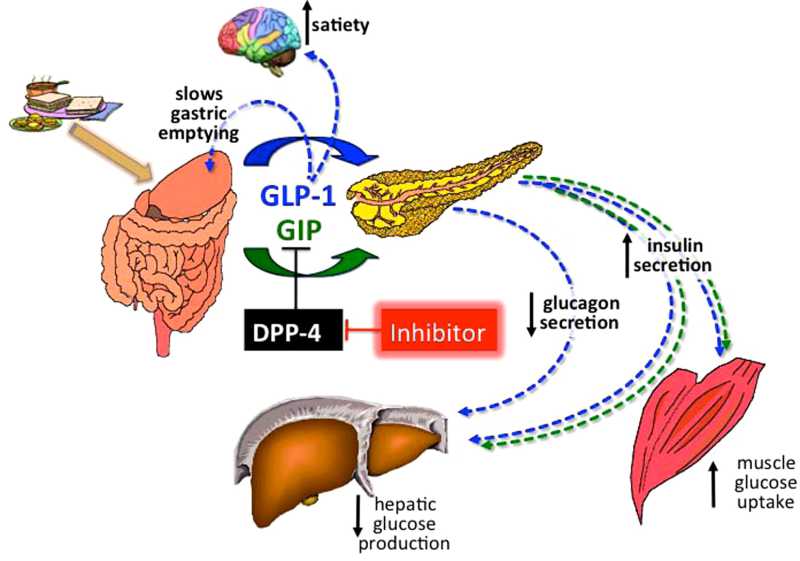
- 胰高血糖素样多肽(GLP-1)的功能多样性:GLP-1除调节胰岛素、糖代谢和心血管保护作用以外;在中枢,它具有神经细胞的保护作用,可促进突触可塑性和神经元的生长,抑制淀粉样变,可增加记忆,防治老年痴呆;它还可以抑制摄食,降低体重,减少肥胖;在胃肠,它可以抑制胃肠蠕动,减少胃酸分泌,延迟胃排空;在肾脏,它可以增加肾小球的滤过率,调节肾小管的重吸收功能;在肝脏和脂肪组织, 它是一种脂代谢平衡的调节剂,它可以通过ERK/PKC和AKt途径,抑制肝脂的积存,促进肝脂的氧化,调节脂肪细胞的增殖和凋亡,抑制脂肪炎症反应,改 善脂质的平衡(JBC 287:6421,2012)。它可以抑制脂肪的吸收,降低血浆甘油三酯和ApoB48的水平,可以抑制VLDL的生成,改变血脂的Profile。 (Endocrin. 154:127,2013; Nat Rev Cardio. 9:209,2012)等等。此外,GLP-1还可参与某些肿瘤的发生、生长和调节。
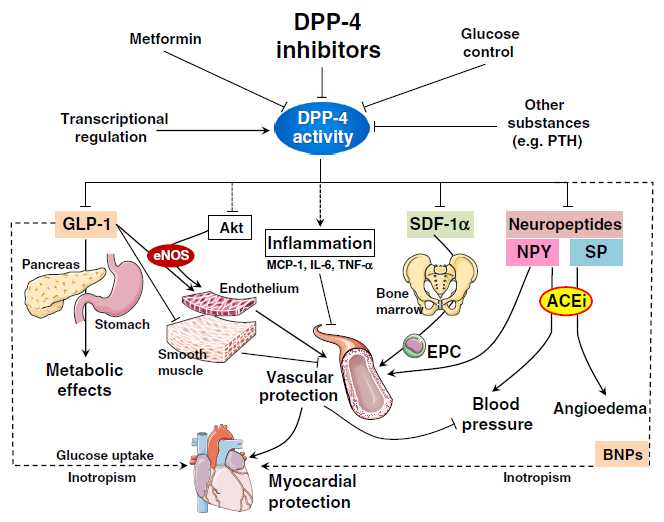
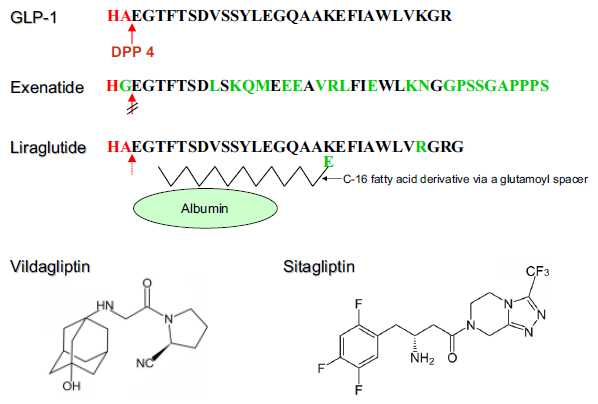
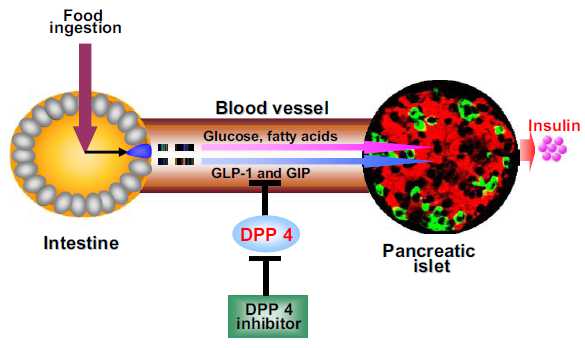
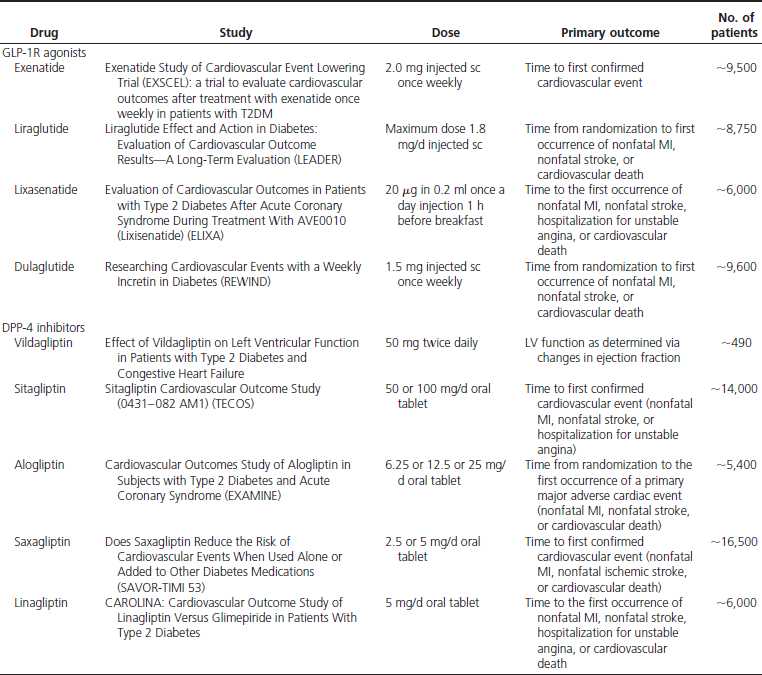
目前GLP-1及其受体激动剂已经在临床用于防治II型糖尿病、肥胖症和一些心血管病。其中进入III期临床试验有 Exenatide、Lixisenatide、Taspoglutide和Liragluide;进入II期临床试验的有Albiglutide、 Semagluide和Exendin-4等,正在临床I期试验的有NN9068和NN9924等。但是GLP-1在体内极易被DPP-4酶所降解,半衰 期极短,亦难以口服,多需静脉注射。DPP-4抑制剂可以有效抑制GLP-1降解,还可以充分发挥内源性GLP-1的作用。此外,DPP-4抑制剂,还有 延长VIP、BNP、SDF-1a等活性多肽半衰期的作用,可促进血管活性多肽的促血管生成和细胞保护作用,现已在临床试用於糖尿病、急性冠脉综合症和心 功能不全等心血管病。主要的DPP-4抑制剂有Saxagliptin、Alogliptin、Sitagliptin、Linagliptin和 Vildagliptin等,且多可口服。此外,一些胰高血糖素受体拮抗剂和阻断剂,如BAY-27-905、MK-0893、LY-2409021等亦 已在临床试用。这为糖尿病和心血管病的防治开辟了一个新的有效途径。但是,这些药物的选择性、联合用药、确切疗效、毒付作用和远期效果,还需进一步观察。
糖尿病和心血管病有着密切的关系,它们都是代谢性炎症免疫性疾病,有着共同的复杂的发病机理。在继胰岛β-细胞和胰岛素以后,GLP和α-细胞又为我们提供了一个新的思路和途径。但是这还是初步的,更深入的作用和机理还需我们进一步研究:其主要问题有:
- α-细胞和β-细胞的生成、分化、调节、相互作用,以及病理生理意义等;
- 胰岛α-细胞本身的自分泌、旁分泌、循环分泌,以及与其它脑肠肽的相互关系等;
- 前胰高血糖素和肠促胰岛素(Incretins/ProGIP)基因表达、转录、修饰、调控、变异和表型的研究;
- 各种前胰高血糖素和肠促胰岛素衍生活性多肽的生成、转运、分泌、代谢、作用、调节、受体、相互关系、信号通路、和生理、药理和病理意义等等;
- 糖尿病的发病和防治是一个“系统工程”,α和β细胞是“系统”中的一个关键节点。还涉及代谢、炎症、免疫、应激损伤等多个环 节。其防治药物除了胰岛素、GLP-1、DDP-4抑制剂,还有C-肽、SGLT-2抑制剂、PPAR-激动剂、Glucokinas激动剂、a- Glucosidase抑制剂、Ghrelin、Leptin等近百种(Pharmacol Rev,64:188, 2012).它们各具特点,又相互联系,需要我们辩证论治,实现个体化的综合防治。
这些都是一个个复杂的相互调控的网络系统,都需要我们进行系统的分析。组织不同、细胞不同、条件不同、受体不同、信号途径不同,其作用也不相同。无论α-细胞,还是β-细胞,都需要我们应用整合医学和转化医学的概念、理论和方法,进行系统的组学研究,才能真正了解代谢性心血管病和糖尿病的发病机理,才能寻找到有效的防治措施。
Pathways of differentiation of the pancreatic endocrine lineage during development and during regeneration of beta cells in the adult mouse

Role of islet transcription factors in endocrine differentiation in the developing pancreas
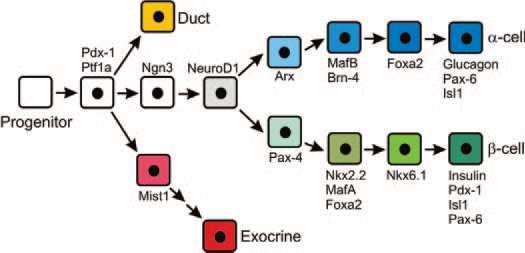
the hierarchical activation of genes involved in islet endocrine cell subtypes specification

Pancreatic β Cell Dedifferentiation as a Mechanism of Diabetic β Cell Failure

The major biological actions of glucagon, GLP-1, and GLP-2 on different target tissues
The GIP gene is localized on human chromosome 17q21.3-q22 and comprises 6 exons. Proteolytic processing of preproGIP generates GIP that is secreted from K cells
(10.1016/j.pbiomolbio.2011.07.010)

Molecular machinery underlying the insulinotropic effects of GIP and GLP-1.
(10.1016/j.pbiomolbio.2011.07.010)
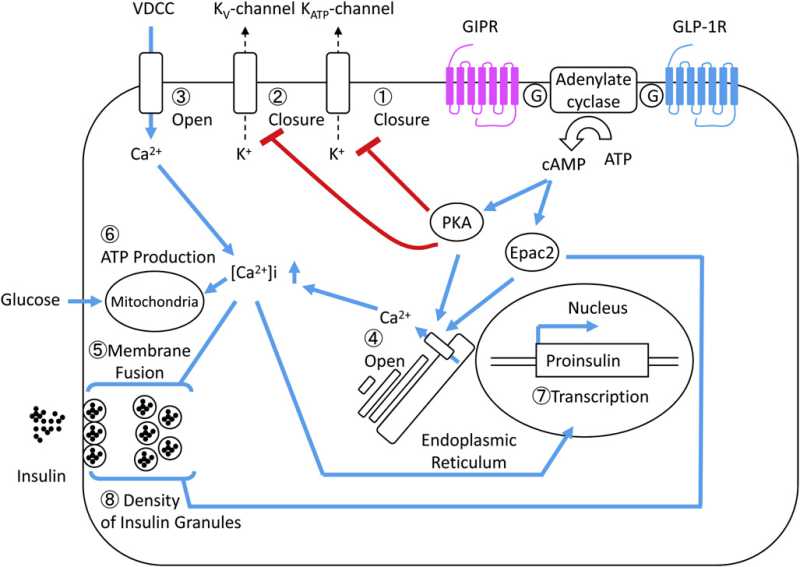
Molecular machinery underlying the anti-apoptotic and proliferative effects of GIP and GLP-1.
(10.1016/j.pbiomolbio.2011.07.010)

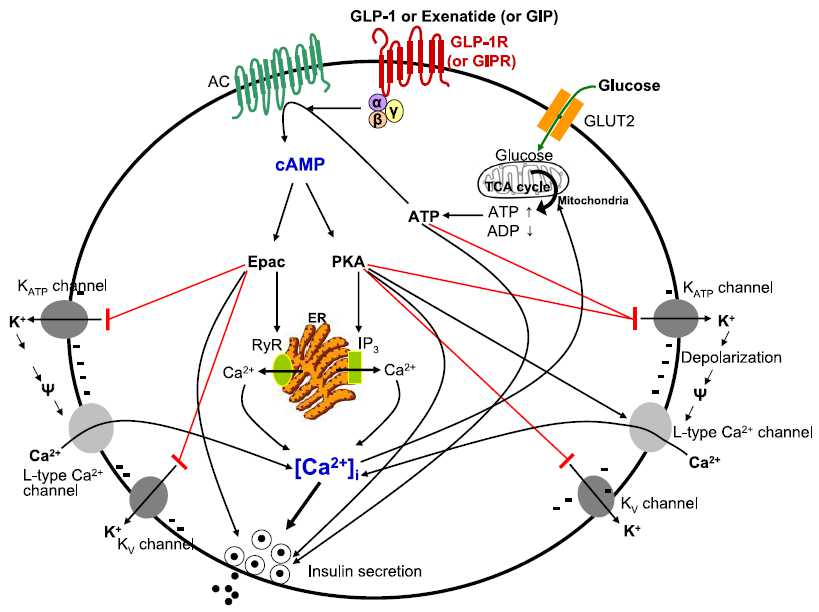
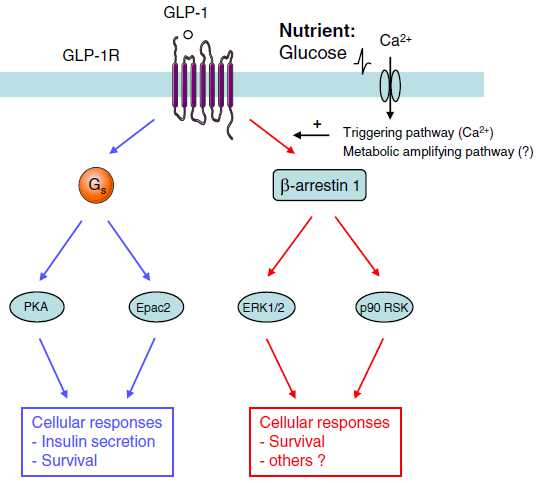
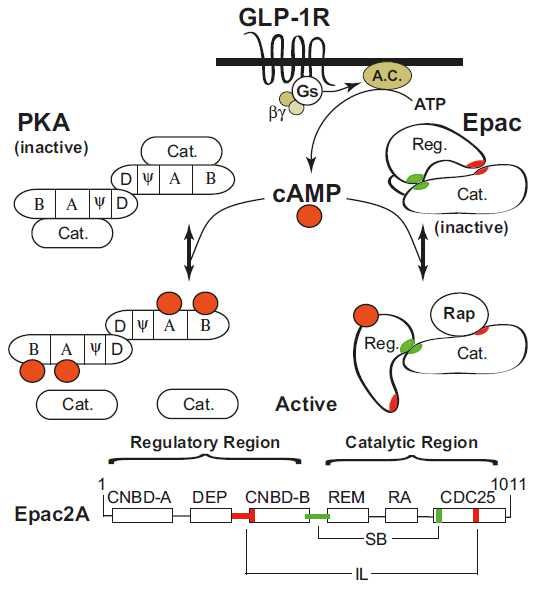
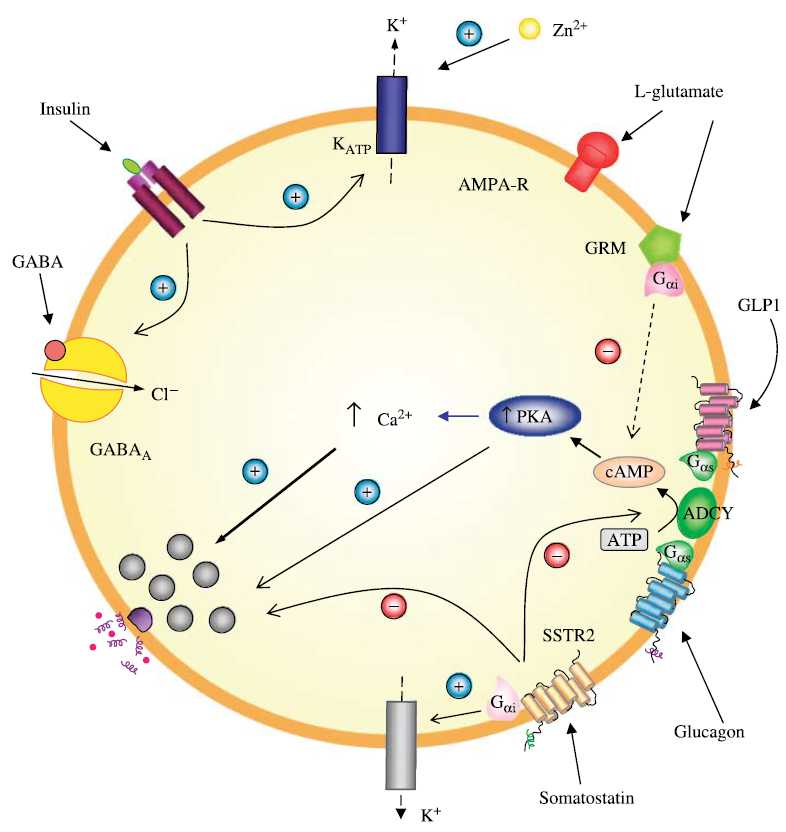
the main molecular events during incretin-induced insulin secretion from a β-cell
Model depicting two hypothetical cell signaling pathways by which GLP-1 exerts insulinomimetic actions on insulin-sensitive target tissues
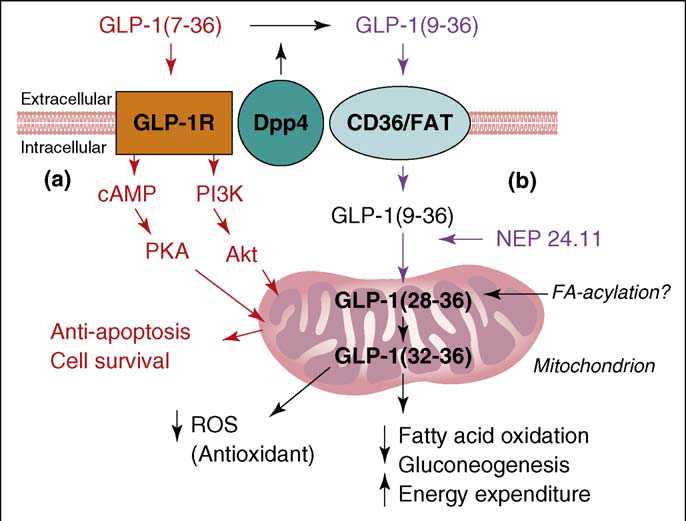
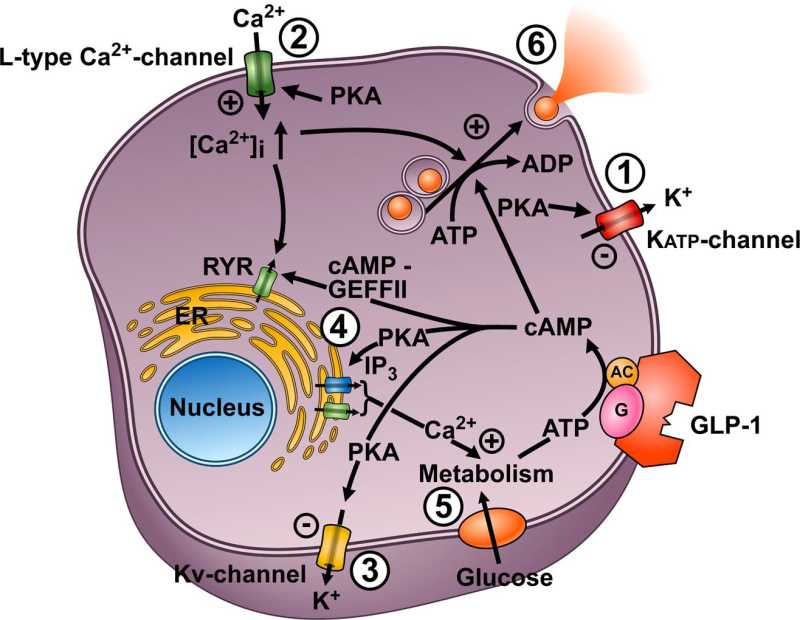
Summary of the cellular actions of GLP-1 that lead to stimulation of insulin secretion
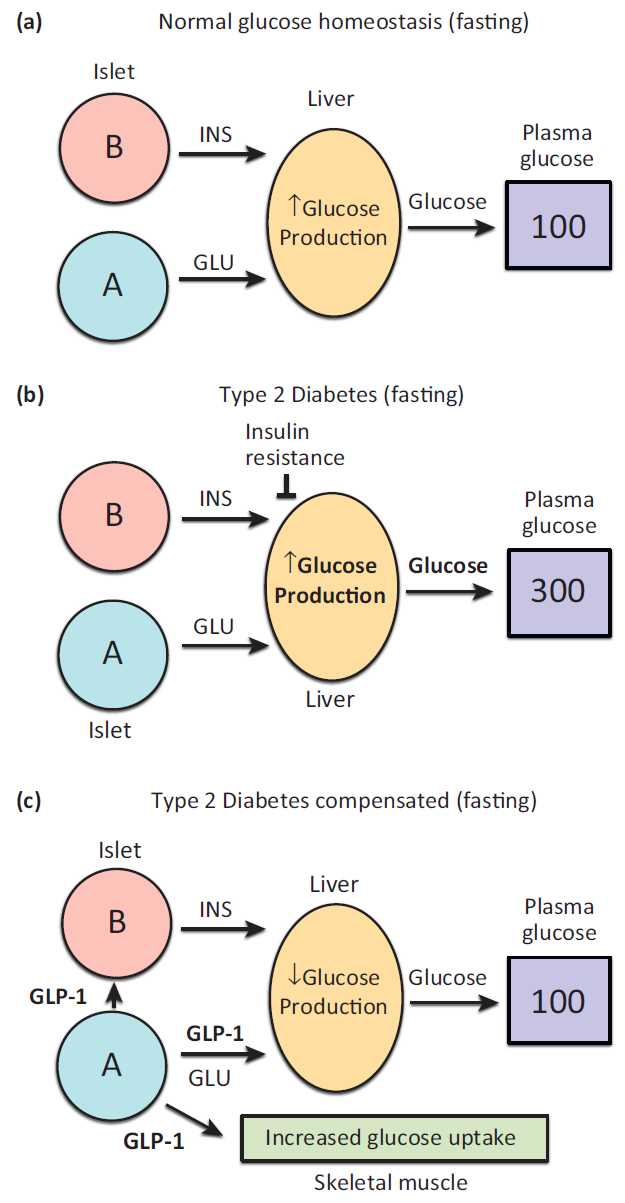
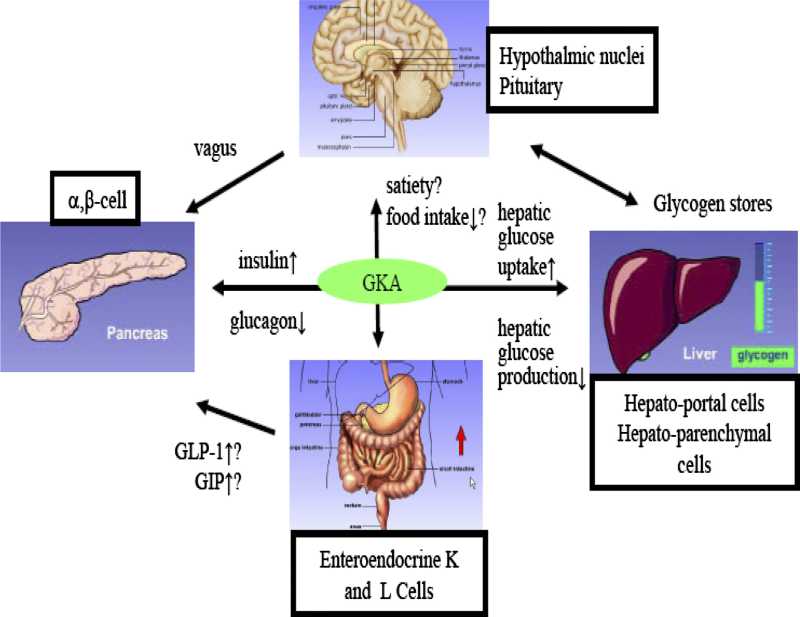
Modulation of hepatic glucose production by β cells and α cells in different conditions
Intracellular pathways proposed as mediators of the cardioprotective actions of glucagonlike peptide-1 (GLP-1).
(10.1016/j.endoen.2012.11.004)
GLP-1R-dependent intracellular signal transduction pathways in the cardiomyocyte
Amino acid sequences of GLP-1 and subpeptides generated by selective modifications by specific proteases

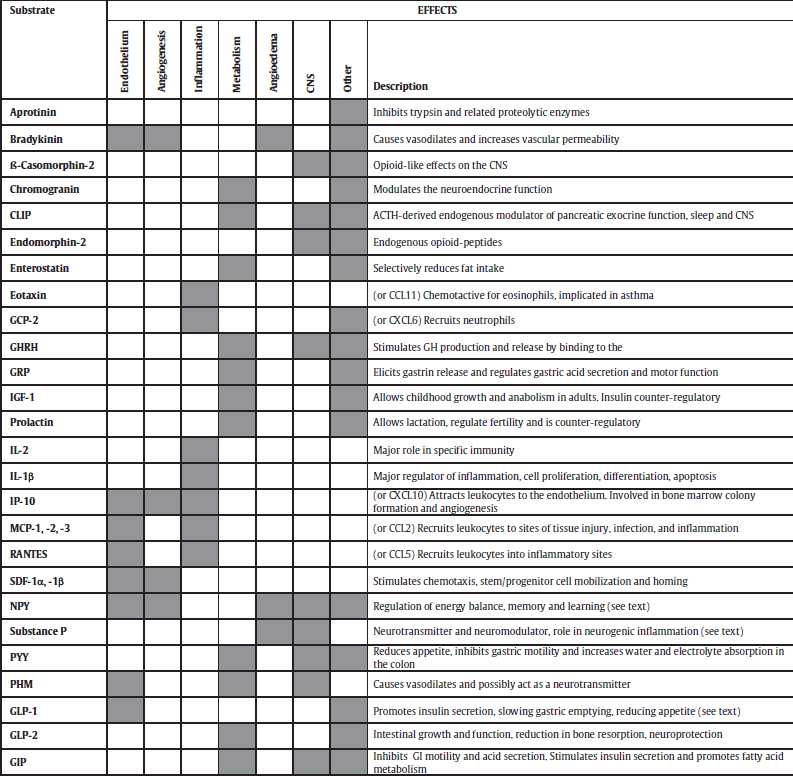
DPP-4 cardioactive substrates and their effects on peripheral tissues that influence the cardiovascular system

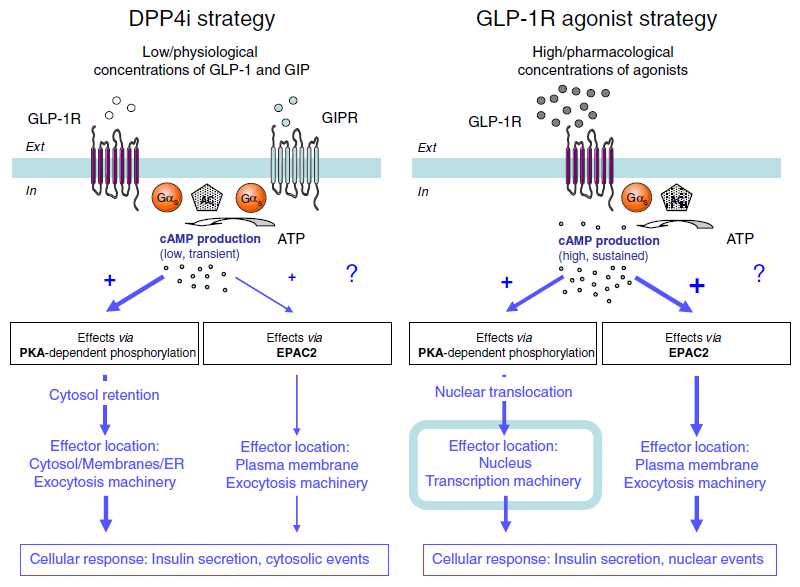
Working hypothesis to investigate differences between DPP4i and GLP-1R agonist strategies in β-cell physiology
(10.1016/j.cellsig.2012.11.009)
Potential mechanisms whereby DPP-4 inhibitors can achieve cardiovascular protection
The possible effects of DPP4 targeting in ischemia/reperfusion injury (IRI).
(10.1016/j.pharmthera.2012.07.012)

Structure of native GLP-1, exenatide, liraglutide, sitagliptin, and vildagliptin
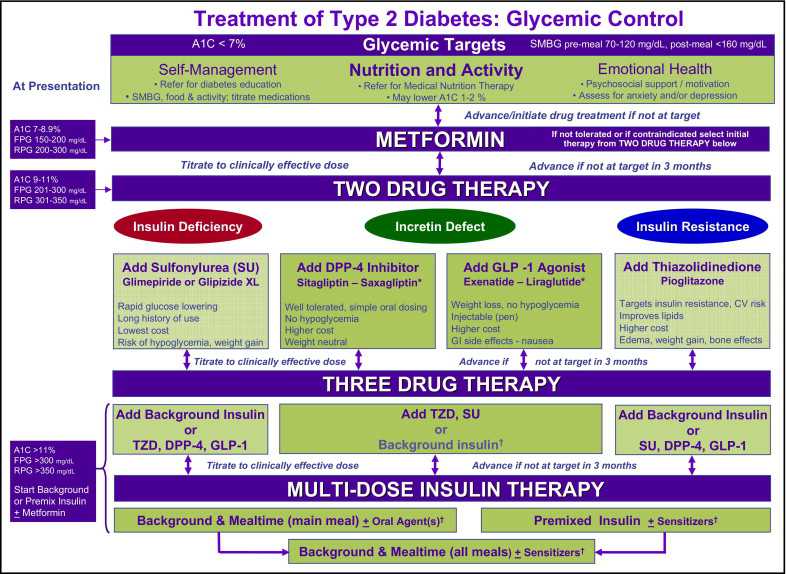
International Diabetes Center (IDC) treatment algorithm for the management of type 2 diabetes center
(10.1016/j.amjmed.2009.03.015)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




















#新成果#
48