ARDS:诊断负担过重的隐患
2023-02-22 重症医学 重症医学 发表于安徽省
区分两个阳性临床试验和三个阴性试验的唯一生理变量是平均气道平台压力。平台压大于32cmH2O的患者的死亡率明显更高。平台压是最能反映肺泡过度扩张和肺部损伤可能性的变量。
ARDS:诊断负担过重的隐患
摘要
ARDS的诊断为一些危险的临床实践提供了借口。临床试验表明,12ml/kg的潮气量会增加患者的死亡率,但6ml/kg的潮气量尚未被证明优于11ml/kg或介于两者之间的潮气量值。目前的指南推荐潮气量为4ml/kg,这造成了严重的空气饥渴,并且会产生危险的(但无效的)镇静剂、麻醉剂和麻痹剂的处方。潮气量的不适当降低也会导致双重触发,从而促进肺泡过度扩张和肺损伤。历年的专家小组都投入了大量精力来制定更精确的ARDS定义来招募患者纳入临床试验。目前普遍的柏林定义的三个支柱中每一个都是极其脆弱的,是混乱和不科学做法的根源。对于床旁医生来说,相比于Ashbaugh及其同事1967年的原始描述,这些修订都没有提高患者的治疗水平。临床医生最好在模式识别的基础上诊断ARDS,而不是将注意力集中在作出诊断后出现的不可避免的众多隐患上。
重症监护与急性呼吸窘迫综合征(ARDS)的关系比与其他诊断都更为紧密。在2017年,多家期刊展示了庆祝Ashbaugh成立50周年的文章以及合著者的原创文章。关于为什么在重症监护大会上有大量的期刊文章和会议专门讨论一种综合征,而这种综合征入住ICU的频率是平均每两个月不到一例 (根据严格的定义标准)。Gattinoni猜测其主要的原因只不过是感情用事。
大多数重症监护医生,尽管不是全部,都感恩于Ashbaugh及其同事在1967年描述的一种以前未被认识的综合症。时隔40年后,两项具有里程碑意义的临床试验证明,呼吸机潮气量是临床结果的决定性因素:接受潮气量为12ml/kg的患者比接受6ml/kg的患者死亡率高22.1%。实际上,在这些试验发表之前,床旁医生已经表示拒绝较高的潮气量。避免使用12ml/kg的潮气量依旧是唯一被证明可以降低ARDS死亡率的治疗步骤。鉴于潮气量12ml/kg不用于任何通气的患者,所以诊断ARDS对临床决策没有影响。
ARDS的诊断为几种危险的做法提供了借口(表1)。在阳性试验发表后,ARDS指南推荐使用6ml/kg的潮气量,尽管6ml/kg的潮气量未被证明优于11ml/kg或两者之间的任何潮气量值。最近的指南更为极端:建议使用4ml/kg的潮气量,这意味着普通人的非自然潮气量为280ml。危重患者的肺部炎症对感受器产生刺激,导致呼吸驱动的增强并出现呼吸困难。呼吸困难患者的反应是尝试更深的呼吸。当低潮气量的设定阻碍了这种反应时,通过延髓向大脑皮层的高压放电,就会导致痛苦的呼吸困难。通气不足的高碳酸血症会加重呼吸困难。PaCO2从45mmHg上升到50mmHg,就会使分钟通气量增加25升,并出现严重的空气饥渴。
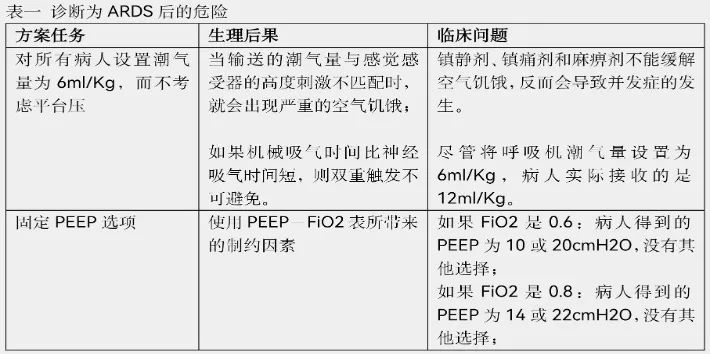
区分两个阳性临床试验和三个阴性试验的唯一生理变量是平均气道平台压力。平台压大于32cmH2O的患者的死亡率明显更高。平台压是最能反映肺泡过度扩张和肺部损伤可能性的变量。指南小组成员没有关注平台压,而是提出了以每千克毫升表示的潮气量的建议。这类似于根据患者的体重滴定抗高血压药物的剂量来管理高血压急症,而不是根据血压的反复变化来调整剂量。最近对高潮气量与低潮气量的五项试验数据进行了重新分析,最终得出一个结论:潮气量不应再以每公斤毫升为单位。毫不犹豫地采用潮气量为6ml/kg也许是ICU住院患者最普遍的规则,但最终还是被认为是有科学缺陷的。
当接收到非自然的低潮气量时,患者会出现严重的空气饥渴、呼吸机对抗。医疗人员使用镇静剂、麻醉剂和麻痹剂来对付顽固的患者,并将其限制在只允许6ml/kg的床位上。镇静剂和麻醉剂不能缓解空气饥渴。神经肌肉阻断剂会消除行为线索,从而使呼吸困难加重。因为这些线索恰恰可以提醒医疗人员注意到患者的不适。对于在过去40年里照顾通气患者的临床医生来说,看到大剂量的镇静剂、麻醉剂和麻痹剂的处方被开出是很沮丧的。这种现象扭转了20世纪80年代至90年代在减少使用这些药物方面取得的巨大进步。为平台压在20cmH2O以下的患者设定非自然的低潮气量,违反了生理学的所有原则。
ARDS网络资源和指南推广了一种一刀切的机械通气方法。方案的倡导者没有生理学的基础,没有认识到低潮气量必然伴随着机械吸气时间的缩短。一旦机械吸气时间变得小于神经吸气时间,双重触发就不可避免。协议热衷者认为他们提供的潮气量是6ml/kg,但患者实际接受的是12ml/kg--这种设置被证明会增加死亡率。(双重触发导致潮气量加倍)
根据ARDS网络的PEEP-FIO2表来管理患者,这与所有的生理学原理甚至常识是相悖的。如果FIO2设置为60%(在ARDS的常见设置)患者得到的PEEP是10或20cmH2O,没有其他选择。如果FIO2设置为80%,患者得到的PEEP是14或22cmH2O,没有其他选择。
自Ashbaugh最初的描述以来,ARDS的定义已经被多次修订。随着每个新表述的展开,作者通过指出前定义中的严重缺陷并承诺修改并纠正过去的瑕疵来证明其修订是合理的。在Ashbaugh和他的同事预言新的综合征后不久,Murray博士就大力批评,劝告临床医生不要做出这种诊断。随后,Murray博士改变了想法,建议最好用肺部损伤评分来进行诊断。六年后,美国-欧洲共识委员会声称Murray评分中的缺点需要重新定义。2012年,柏林工作组列出了其前身中的许多缺陷,并宣布他们的定义是首次尝试将专业协会认可的国际共识小组与对数千名患者的修订标准的实证评估联系起来。最近几周,有迹象表明,另一次迭代正在进行中。Einstein评论说,这是重复做同样的事情并期待不同的结果。他的结论令人不敢恭维。
我最近指出,在COVID-19大流行的高峰期,对ARDS的柏林定义的迷恋可能造成了患者的死亡。柏林工作小组的一些成员对这一推论表示不满。然而,工作组不可能预见到他们的定义在随后的大流行如何被使用。世卫组织关于COVID-19的指南在ARDS的诊断和鼓励早期气管插管之间建立了明确的联系。这随后被证明增加了COVID的死亡率。世卫组织明确指出,"ARDS的低氧性呼吸衰竭......通常需要机械通气"(文中传达的是有创方式)。这是不正确的。许多ARDS患者接受无创通气或吸氧得以治疗。在PubMed上搜索会发现许多作者在诊断Covid患者的ARDS和早期插管之间建立了联系。例如,参见Ziehr等人的报告(他们的引文#7指定了柏林的定义),Yaroshetskiy等人随后对此进行了评论。
Ashbaugh及其同事提出的定义包括简单的定性描述(严重呼吸困难、呼吸急促、低氧血症、肺顺应性下降、肺泡浸润)。后续定义的作者表现得好像他们赞同开尔文勋爵关于数字精确性的名言。实际上,正是(柏林定义的)三个支柱的数字包装使它们非常不稳定(图1)。放射性浸润的标准取得了令人沮丧的评分间一致性,卡帕评分为0.296。
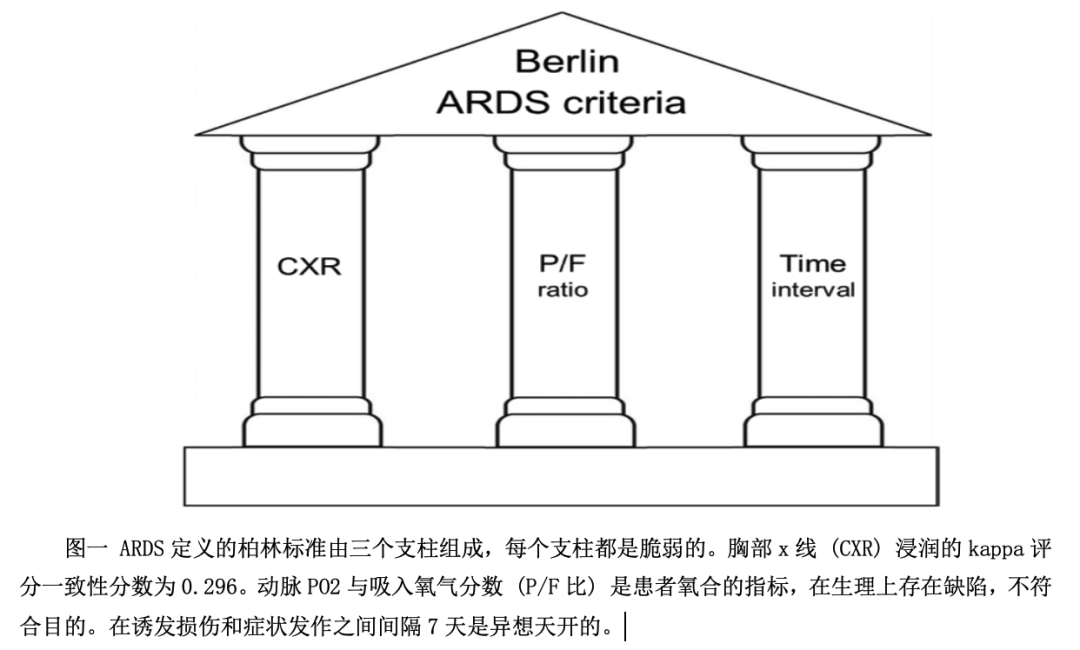
柏林小组规定,只有在确认的侵犯损伤发生后7天内发现呼吸衰竭,才能合法地诊断为ARDS。这个异想天开的时间限制是Covid大流行期间相当混乱的根源,作者认为Covid肺炎不代表ARDS,因为呼吸衰竭发生在首次症状后的8-12天。
严重的低氧血症一直是诊断ARDS的一个先决条件。Ashbaugh之后的定义一直用PaO2/FIO2比率来表示低氧血症。Murray及其同事选择该比率作为气体交换异常的规范,因为它 "更容易从患者病历中的常规可用的信息中计算出来"。不想给别人造成负担的意图很少会适得其反。众所周知,PaO2与FIO2具有曲线关系,该关系随通气-灌注不平等程度和分流程度而变化。在ARDS和固定分流的患者中,FIO2的改变导致PaO2/FIO2不可预测地波动,波动幅度大于100mmHg。在一组符合ARDS标准的所有患者中,给予100% 氧气30分钟会导致PaO2/FIO2增加,以至于58.5% 的患者不再符合ARDS标准。
PaO2是医学界最精确的测量方法之一。一些器官如颈动脉体,对PaO2的微小变化有反应,它是氧气输送到大脑和心脏的关键决定因素。相比之下,PaO2/FIO2在任何生物过程中都不起作用。PaO2是解开一些Covid患者表现出沉默性(显性的)缺氧之谜的决定性线索,而不是PaO2/FIO2或氧饱和度(SaO2)。
由于在历次ARDS定义中始终包含PaO2 /FIO2,所以成千上万的作者根据这一比率报告了患者的氧合情况。在早期的Covid系列中,来自西雅图(重症监护的摇篮之一)的作者只以PaO2/FIO2的形式报告了患者的氧合情况,没有提到PaO2。PaO2 /FIO2比值可能是医学领域Gresham定律最突出的例子,在这种情况下,一个糟糕的测量结果会淘汰一个好的测量结果。
对重症监护医生来说,应该警惕的认识到,这个被认为是重症监护标志性的诊断是由最不科学的标准来定义的。可以理解的是,研究人员希望完善招募标准,使得患者进入临床试验,但这种内部工作可以通过试验人员之间的私下交流更好地处理,而不会分散临床医生对更重要事情的注意力。如果临床医生将注意力集中在每个患者特有的生理问题上,并制定个性化的治疗解决方案,那么患者将会得到更好的服务。
当我作为一名临床医生工作时,我认为ARDS的诊断是一个有用的、尽管有点杂乱的标签。像许多综合征一样,ARDS是粗泛的,缺乏精确的临床疾病界限,如军团病或内囊出血导致的偏瘫。我根据已知的知识和对呼吸困难、体征、低氧血症和射线浸润的识别来诊断ARDS,而没有去纠结于数字或分布模式。对ARDS的诊断并不是最终的终点,我将继续寻找根本原因:肺炎球菌肺炎的治疗与胰腺炎的治疗不同。
研究人员(试验主义者)不切实际的愿望使ARDS不堪重负,他们希望利用社会学的策略将一个不可言喻的实体转化为一个合乎逻辑的自然事物(一种“自然类型”)。科学的发展与安徒生的童话不同。现在是时候让研究人员停止向往光荣的天鹅,并接受ARDS作为丑小鸭的事实了。如果由肺部和重症监护专家组成的领导小组不能提出一个科学上令人满意的ARDS定义,那么患者代表(最近的提案)能解决深层的认识论和本体论的核心难题吗?诺贝尔奖获得者Peter Medawar是上世纪生物学最重要的认知论家,他警告过对定义崇拜的危险,以及它们限制而不是解放思想的倾向。标签只不过是一种唯名主义的用法,渴望永恒的无可置疑的确定性是危险的。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言