中国正在改变临床开发的格局,这将如何影响外国企业的全球开发战略?
2019-10-11 老药 药时代
在不到24个月的时间里,中国从根本上改变了全球临床开发的格局,开创了颠覆传统药物开发范式的商业化新途径。
在不到24个月的时间里,中国从根本上改变了全球临床开发的格局,开创了颠覆传统药物开发范式的商业化新途径。
自2017年6月作为正式监管成员加入ICH以来,中国已将监管流程的重点重新集中到创新疗法和器械的快速批准上,非本土的生物制药公司成为主要受益者。
这些改革措施除了使中国,全球第二大市场,几乎在一夜之间变得门户大开而更加可及之外,对行业产生的更深远影响在于,中国的政策调整和新兴的全球角色为未来的全球临床开发和监管战略指明了一种新的令人振奋的范例。
先前的20世纪药物创新模式
以前的药物创新模式源于美国在药物创新方面的明显领导地位,其驱动因素为:
公共部门对美国学术研究的大力资助;
FDA作为监管批准的全球金标准的地位;
公共市场和风险投资机构提供的充足的资本;
美国药品价格居高不下,促使公司和投资者将注意力集中在以美国为中心的药品开发上。
美国卓越地位背后的每一个驱动因素都在逐渐受到侵蚀。美国公共部门研究资金停滞不前,开发和监管准则趋于全球化,全球资本来源日益多样化,以及终止美国为全球药物创新提供价格补贴的美国国内政治压力越来越大,这些都已经成为人们熟悉的主题。
60%至70%的药物开发成本存在于临床研究阶段,将旧模式钉牢的越来越重要的一颗钉子是美国对临床试验对象的竞争。简化的法规和新技术的使用并未改变临床开发的基本原理:如今,太多的美国试验追逐太少的受试者。随着精准医学要求更特定和排他的入组标准,这一挑战将继续增大。不可避免的结果是:招募速度更慢,试验时间更长,直接和间接费用不断上升,而这又必须在更狭窄定义的愿意或能够支付更高价格的潜在美国患者中分担。
新兴药物创新模式的驱动力
中国迅速发生的变化创造了一个新的全球环境,工业界的公司迅速整合了一系列新的驱动因素,以制定真正的全球开发战略。
例如,中国以前需要等待数年的临床试验批准现在只需要60个工作日,这使得将中国纳入全球2期和3期试验成为可能。此外,如果符合全球质量标准,美国监管机构将接受中国数据。我们越来越多地寻求与美国FDA和中国NMPA同时举行IND前会议,以确保在这两个主要市场上完全统一临床计划。
另一个例子是患者招募速度。在美国试验难以招募患者的领域,包括免疫肿瘤学、NASH、慢性病和许多罕见病适应症,中国有大量未接受治疗的患者集中在顶级城市医疗中心,直接费用通常比美国的低30%。结果,招募速度通常可以快2-3倍。此外,使用少量试验中心可以使项目管理和质量保证变得简单,同时可与国际认可的主要研究者(PI)建立更深的关系。
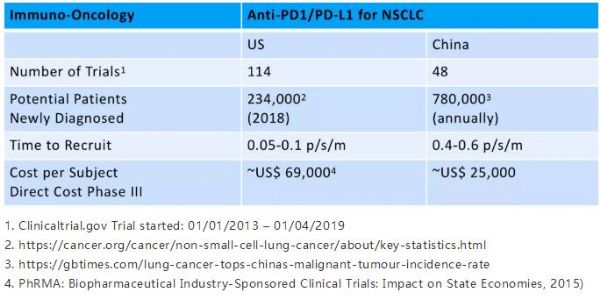
举例来说,下表显示了美国和中国每年在非小细胞肺癌(NSCLC)患者中进行PD-1 / PD-L1试验的次数以及新诊断的患者数。毫不奇怪,在中国,患者招募的速度和直接费用看起来更具吸引力。随着致力于创新的中国公司和更具国际影响力的西方生物技术公司开始利用中国的吸引力,双边的差距正在缩小,但是对试验时间和成本的潜在影响提供了一个令人信服的理由去重新考虑美国/欧盟与中国的研究中心之间的平衡。
表 1. 中美非小细胞肺癌(NSCLC)试验的比较
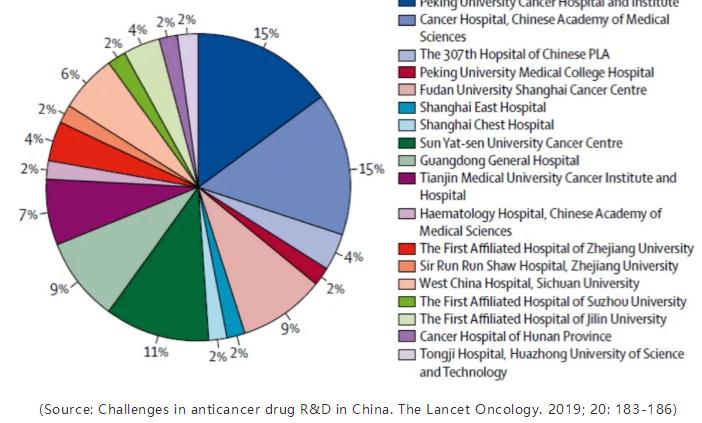
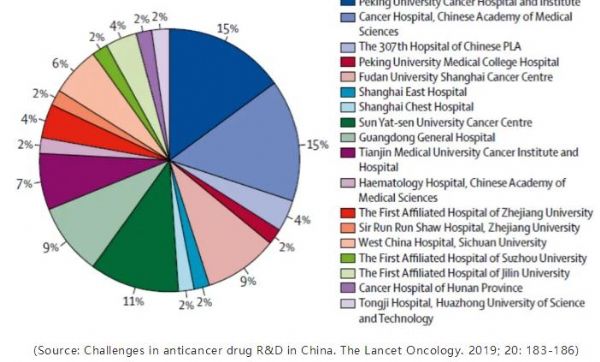
下图显示了在中国进行的180项肿瘤学研究的临床试验地点分布。这些研究中有将近60%集中在五个中心。数十个高质量中心尚未得到充分利用。
图1. 在中国进行的180项肿瘤学研究的试验中心分布。
(Source: Challenges in anticancer drug R&D in China. The Lancet Oncology. 2019; 20: 183-186)
同时,中国的风险投资者和商业化合作伙伴正在寻找新颖的化合物来满足中国患者的需求或扩大其全球业务。专注于中国的医疗保健基金筹集的资金总额从2014年的不到40亿美元跃升至2018年的428亿美元。流向治疗性药物的投资继续快速增长,从2017年的27亿美元增加到2018年的76亿美元。这创造了可以出售中国的权利以筹集非稀释性资本的机会,或者增加中国投资者以支持更强大和真正全球性的开发计划。后面这种情况发生的越来越多。
作为额外的激励措施,创新药物,主要来自外国公司,首次被纳入了中国国家医保目录(NRDL),尽管价格的下降幅度很大。2017年,首批30种药品(主要是在中国已经可用的肿瘤疗法)进入国家医保目录,降价幅度为50%至70%。罗氏是进入医保目录的疗法的数量最多的公司,中国对其药物的需求急剧增长,其销量远远可以弥补顶线销售额和获利能力之间的差距。2018年,NRDL增加了36种创新药品。新的一批创新药品可能会在2019年第三季度宣布。
规划未来
在中国庞大且更加触手可及的市场获得注册的同时加快开发并降低成本,为建立更广阔的全球开发模式提供了令人信服的逻辑。开发创新药物的公司可以采用以下方法:
与美国FDA和中国NMPA同时召开pre-IND Meeting(新药临床试验申请前会议),以设计在两个市场均适用的临床和监管策略。
在这两个国家都开始进行试验,以最大速度同时降低成本为目标设计受试者的分配,提供美国、中国和其它主要监管机构所需的数据。
关键的挑战
随着企业面临寻求创新解决方案的压力日益增加及同时发生的监管壁垒的逐渐消减,此时此刻,渴望利用中国在全球范围内的地位和作用的生物技术公司必须着眼于确定可满足全球标准并与西方临床和监管团队无缝合作的值得信赖的合作伙伴。
西方公司最常问的问题包括:
在中国这个汪洋大海中,有如此多各种各样的商业伙伴、CRO和投资者,我该如何推进?
哪里可以找到资源,帮助弥合我们对临床开发领域和法规细微差别的了解的不足?这些会不会引起潜在的管理上大幅度的分散?
我如何确定来自中国的数据的质量将支持我的全球项目并达到关键的里程碑呢?
明确的答案显然取决于每个公司的能力和目标。但是,这里有一些实用的建议可能会有用:
寻求在中国开发创新药物方面具有丰富经验的合作伙伴。
只有少数历史悠久的中国生物制药公司拥有其仿制药产品组合以外的临床或监管经验。创新性中国生物技术公司对创新药物的复杂性更加了解,但只有少数几家公司将其项目从实验室推进到临床。此外,大多数本地和全球CRO都建立了旨在满足中国旧模式需求的组织,这些组织的重点是本地仿制药或已经在美国和欧洲注册多年的创新性西药的获批。
寻找一个您可以信赖的团队,与您的全球临床和监管专业人员进行平稳有效的协作。
除了克服语言差异和临床实践差异等明显的挑战之外,您的中国合作伙伴对全球标准的理解和承诺是该挑战的核心。通常只有数十年帮助全球领先的生物制药公司在中国进行临床开发而积累了丰富管理经验的团队才具有这种能力。
构建实现价值最大化的方法和时机。
中国权利交易的价值一直在上升,中国投资者和被许可人主导实打实的讨价还价,要求大量数据来支持有吸引力的估值。因此,无论是寻求在本地与中国合作或目标全球范围的交易,在推进中国注册的同时对早期临床开发进行前期投资都能带来很高的回报。弥合资金缺口以提供前期投资变得越来越容易实现。
寻求共享的“所有者心态”,试着问您自己:
我的商业化合作伙伴是否分享我对新药分子及其全球开发的热情,还是他们只专注于本地商业化和为当地监管部门的批准而提供临床支持?
我的CRO的中国团队是否将自己视为应尽职责的服务提供商,还是他们像真正的合作伙伴那样可以帮助预见挑战并提供既能反映中国复杂性又能满足我的全球开发目标的创新性解决方案?
美国领先的风险投资公司的经验丰富的CEO经常问的一个问题:对于我们的潜在的投资候选人,他们是否愿意利用新的全球开发模式,还是他们深陷过去,根深蒂固,注定要等待观望而被他人超越?
如何回答这个问题并相应采取行动将带来天壤之别。
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#企业#
18