47个药物拼“钱途”!PD-1/PD-L1抗体太“火”了……
2017-03-20 佚名 生物探索
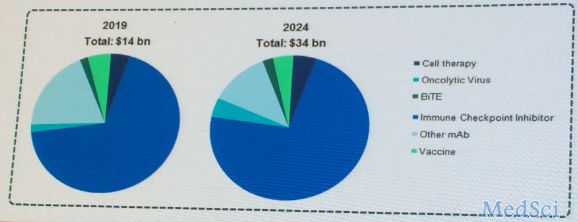
PD-1/PD-L1抗体是最惹人注目、最有“钱途”的抗癌免疫疗法之一。Opdivo 2016年全年销售额达37.74亿美元,Keytruda去年销售额达14.02亿美元。目前,国内外企业在这一领域的进展非常激烈。那么,在这种情况下,开发PD-1/PD-L1抗体需要考虑哪些问题呢?



本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#PD-L1#
34
学习了,分享了
55