一例“肚脐样”抗核抗体核型引发的关注
2022-05-28 刘长宁 柳州市人民医院 “检验医学”公众号
ANA免疫荧光抗体技术检测阳性最常见于各种自身免疫性疾病(AID)的患者,特别是系统性AID,也可见于器官特异性AID、感染、肿瘤患者及健康人群等。
前 言
抗核抗体(ANA)是以真核细胞的核成分为靶抗原的器官非特异性自身抗体的总称,属自身抗体中的一组抗体。目前临床常规仍多采用间接免疫荧光法(IIF法)作为ANA总抗体的筛查试验。
ANA免疫荧光抗体技术检测阳性最常见于各种自身免疫性疾病(AID)的患者,特别是系统性AID,也可见于器官特异性AID、感染、肿瘤患者及健康人群等。
本案例中,一名风湿免疫科患者在采用IIF法检测抗核抗体时,检测人员在镜下发现了较罕见的“肚脐样”核型,是在制片过程中产生的干扰,还是提示与什么疾病的关联性呢?是否与临床的诊断和症状相符呢?
案例经过
患者,女性,67岁,因到期行环磷酰胺治疗入院,门诊拟“系统性硬化症”于2022年4月27日收治入院。
现病史:患者自诉3年余前无明显诱因下开始出现双手遇冷变紫,保暖后颜色可恢复,无皮瘆、口腔溃病、脱发、关节疼痛等,当时未予特殊诊治。逐渐出现双手、双前臂皮肤增厚。2年前开始出现反复咳嗽、咳少许白痰,无咳血、心悸、胸闷、胸痛等,未予特殊治疗。
2021年6月咳嗽加重,咳白色粘液痰,伴活动后气促,自觉活动耐力下降,双手雷诺同前,双手、双前臂皮肤增厚同前,有口干,反复至当地卫生院就诊,经抗炎、化痰等治疗后症状好转。现患者偶有咳嗽、咳白色粘痰、活动后气促、休息后可缓解,口干、双手雷诺现象减轻,无畏寒、发热,无腹痛、腹泻、腹胀、尿频、尿急,无关节疼痛、眼干、口腔溃疡等不适,到期行环磷酰胺治疗入院,门诊拟“系统性硬化症”收住入院。
既往史:平素体健无慢性病史、外伤及手术史。自诉双手雷诺现象3年余,反复咳嗽2年余。
体格检查:T:36.7℃,P:85次/分,R:18次/分,BP:127/80mmHg;神清,全身皮肤巩膜无黄染。全身浅表淋巴结未触及肿大,咽无充血,扁桃体无肿大。双肺呼吸粗,两下肺可闻及少量湿性啰音。心率85次/分,心律齐,各瓣膜未闻及病理性杂音。腹软,全腹无压痛、反跳痛,肝脾肋下未触及,肠鸣音正常。双下肢无水肿。颜面部皮肤蜡样光泽,面具脸,口周放射纹,双前臂、双手皮胰增厚变硬,双手关节无压痛。
实验室检查:
血常规:WBC 5.67×109/L,N% 82.7%,LYM% 10.8%;
肝肾功能、电解质等未见明显异常;
流式细胞检查:总T淋巴细胞绝对值、辅助/诱导T淋巴细胞绝对值、抑制/细胞毒性T淋巴细胞绝对值均偏低;
ANA既往结果:均质型(H)1:320、颗粒型(S)1:320(起始滴度1:100)。
初步诊断:
系统性硬化症(弥漫型 硬化期)继发间质性肺炎
纵膈占位性质待查
骨质疏松症
治疗经过:患者于2021年10月15日至我院住院予甲泼尼龙24mgqd抗炎控制病情,10月27日予环磷酰胺(0.4g dl+0.6gd2,目前累积量为1g)免疫抑制治疗,抗感染、护胃、补钙等治疗后好转出院。出院后定期门诊随诊,规律口服药物治疗,定期返院行环磷酰胺治疗。
2021年11月29日、2022年1月19日、2022年2月23日、2022年3月27子环磷酰胺(目前累积量为4.8g)免疫抑制治疗。本次就诊继续予泼尼松10mgqd,自备青霉胺、吡非尼酮抗纤维化,余护胃、补钙抗骨质疏松等治疗,择期行环磷酰胺免疫抑制治疗。
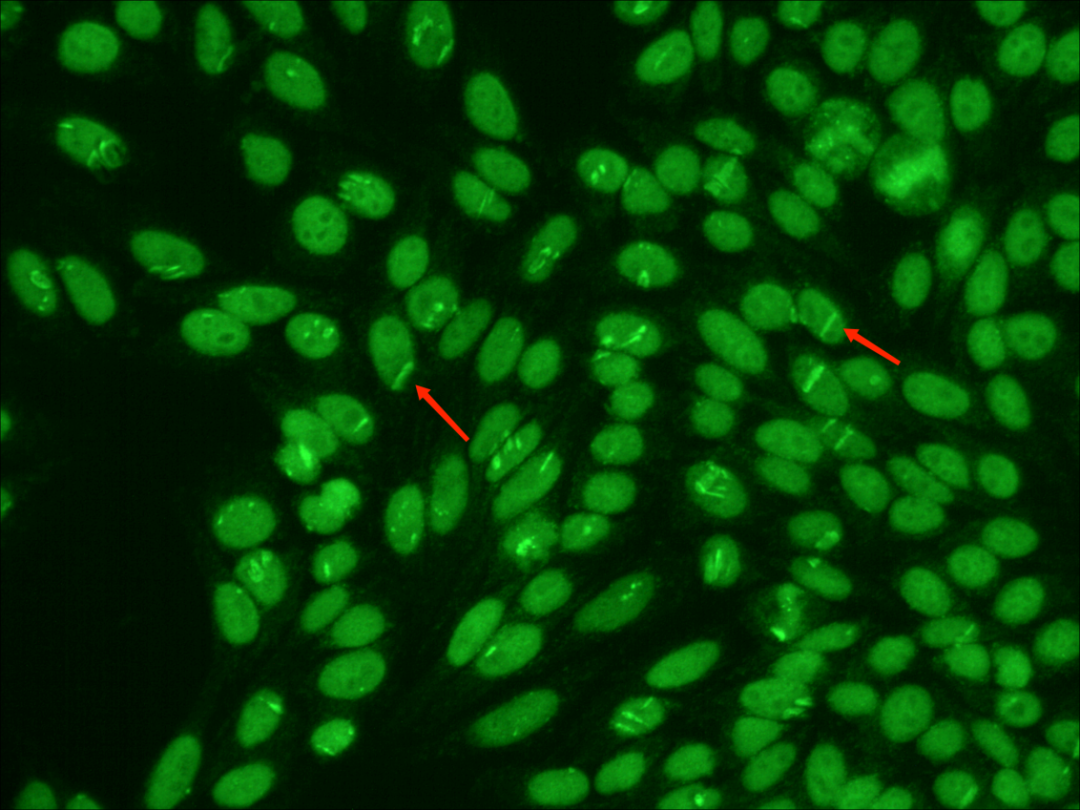
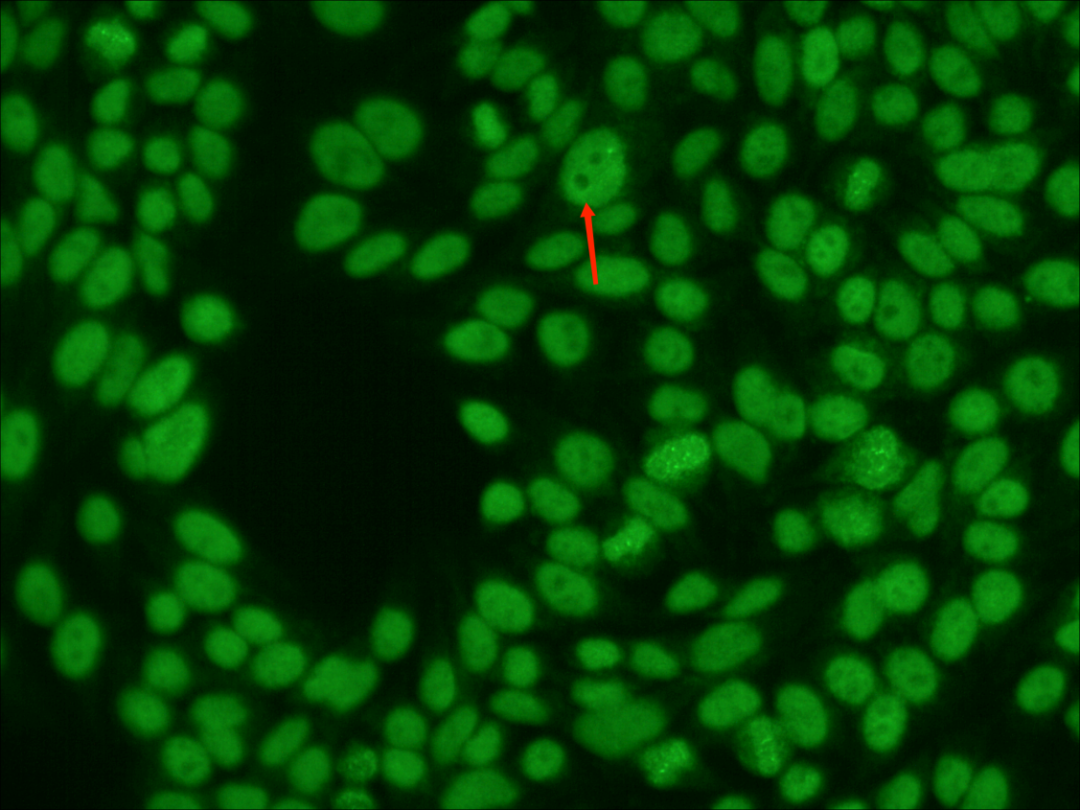
在入院后第2天,医生再次对该患者进行抗核抗体ANA和抗双链DNA的监测检查。镜下,检验人员在Hep-2基质中发现了较为罕见的类似于“切迹”的棍状荧光及“肚脐样”的空心荧光表现。
案例分析
镜下发现这些较为罕见的荧光特征,引起了检验人员的高度注意。这到底是在制片过程中人为操作(例如“压片”或者是环境湿度干燥等)造成的细胞裂痕,还是与疾病有相关联性的较为罕见的核型呢?
在阅览全片后可以看到,核型所表现出的均质型(H)、颗粒型(S)、核仁型(N)都是清晰明显的,这种“切迹样”和“肚脐样”的荧光特征也并不偶见,全片均可以找到。
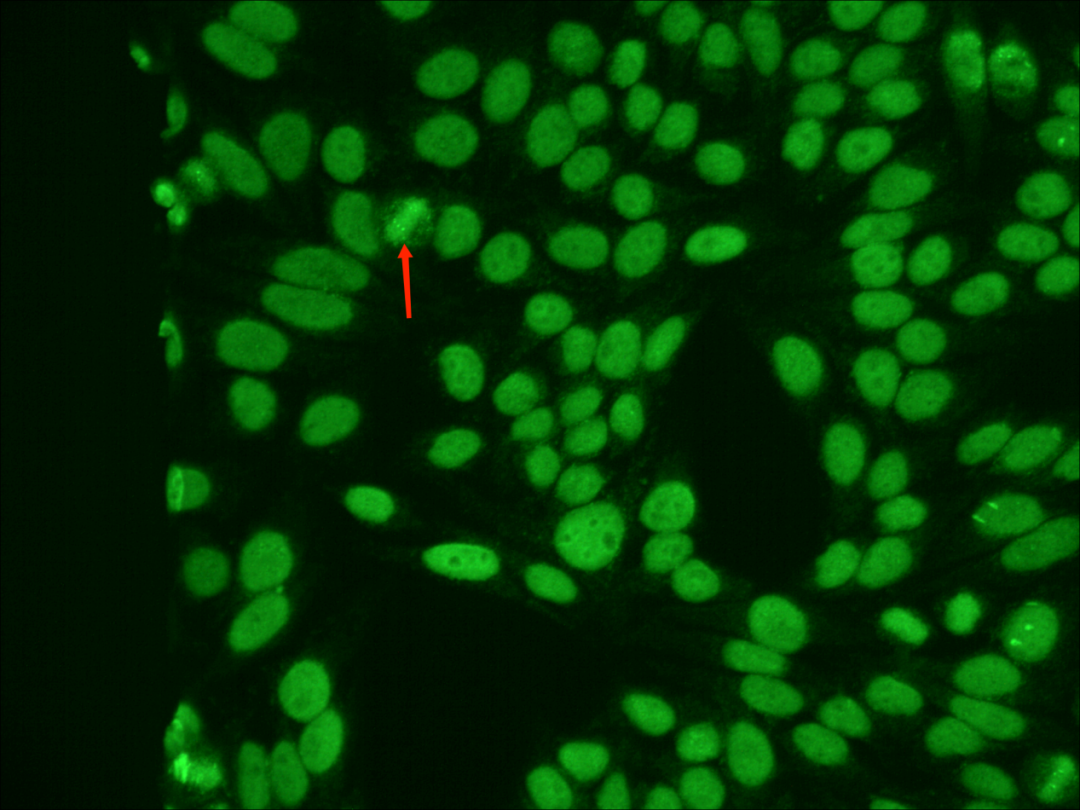
为排除人为操作的偶然影响,用该患者的血清再次重复检测了一次抗核抗体,同时加做了抗核抗体谱(ENA)检测,重检的镜下结果再次出现相同的特征性荧光表现,并且在细胞分裂期的核仁中央找到“针尖样”的亮点,同时ENA也出现了Scl-70阳性的结果,Scl-70是TopoI型的特异性靶抗原,这更加验证了实验人员的判断,结合荧光核型分析和临床表现,此病例即是一例TopoI核型病例。
案例总结
TopoI型也称为DNA拓扑异构酶I型(AC-29),在ICAP分类中属于疑难级非必报核型,其已知的靶抗原为Scl-70。AC-29核型对系统性硬化症具有高度特异性,特别是弥漫性皮肤型系统性硬化症和更具侵袭形式的系统性硬化症[1-2]。
目前很多书籍和图谱上对于Hep-2中的TopoI核型的描述大致是:分裂间期细胞核呈现细颗粒荧光,细胞核边缘模糊,并可见向胞浆扩散的点状荧光,核仁呈现均匀荧光或无荧光;分裂期细胞染色体呈现均匀或颗粒样的增强荧光,且周围可见稀疏较弱的细颗粒荧光,有时可见染色体上散在的增强点状荧光;猴肝可见颗粒或均匀荧光,核仁有或无荧光,荧光强度与Hep-2细胞一致。
书中和图谱中的描述可能缺乏一些更为特征性的描述,所以有的时候实验人员在阅片过程中若速度太快或没留心的时候,可能往往会将这种TopoI的核型误判为是均质型+颗粒型,而TopoI或者是Scl-70的阳性常被视为预后不良的标志,核型的错误判断可能会对临床的诊疗和判断造成错误的提示。
该案例中出现了TopoI核型的一些比较特殊的表现。当视野中发现这种“切迹样”和“肚脐样”的荧光表现时,镜检人员应该要马上提高警觉,这其实是一种变形核仁的表现。而在细胞分裂期的核仁中央组织区看到“针尖样”的亮点时,就应该要更加怀疑,这很有可能就是Nor-90抗体,该抗体常见于SSc患者[3],阳性患者常伴有雷诺现象,该抗体也可偶见于其他AID患者(SLE、RA、SS、PBC)和肝癌等患者。如果此时再有ENA中的Scl-70阳性的辅助,那就可以更加确定是TopoI核型啦。正确的核型和滴度判断,能为临床提供最准确和及时的诊断、用药等指导作用。
专家点评
副主任技师刘纲毅:
自身抗体疾病的诊疗比较依赖实验室抗核抗体检测结果,抗核抗体IgG荧光核型分析仍是目前抗核抗体检测的金标准,但荧光核型分析所表现出的复杂性也让检验人员有时难以判断结果,该案例尝试为疑难级TopoI核型寻找特征性的荧光表现,以期提高检验人员对该核型的辨识度。另外,该案例中提到的“切迹样”、“肚脐样”“针尖样”等荧光表现是否具有随机性?即或是TopoI核型的特征性荧光表现?均还需收集更多的案例加以验证。
参考文献:
[1]陶月,朱益佳,朱文波,等.抗核抗体 人喉癌上皮细胞细胞核型中AC-29的临床应用[J].中华风湿病学杂志,2019(12):845-846-845-846,C4.
[2]刘合会,袁李梅,杨滨宾,等.抗Scl-70抗体与系统性硬化病临床特征的相关性研究[J].临床皮肤科杂志,2021,50(02):71-75.DOI:10.16761/j.cnki.1000-4963.2021.02.003.
[3]刘合会,邓丹琪.系统性硬化症相关自身抗体的临床意义[J].医学综述,2019,25(01):113-118.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#抗核抗体#
44