Nature子刊:杨辉团队开发新型DNA碱基编辑器,首次实现高效腺嘌呤碱基颠换编辑
2023-01-11 生物世界 生物世界 发表于上海
虽然AYBEv3的编辑效率及纯度仍需进一步提高,腺嘌呤颠换碱基编辑器的开发填补了目前碱基编辑器不能高效实现A-to-C或A-to-T的空白,对相关疾病模型的建立及基因治疗领域等都有着非常重要的意义。
碱基编辑器(Base editor,BE)是一类可以在不产生DNA双链断裂的情况下实现单碱基水平碱基替换的工具,其在基础研究和基因治疗领域显示出了极大的潜力。在导致人类产生遗传疾病的单点突变中,约四分之一的致病突变的修复需要实现腺嘌呤碱基的颠换(A-to-T和A-to-C;或互补链的T-to-A和T-to-G)。然而,还没有一种碱基编辑器能够实现A-to-T和/或A-to-C这类碱基之间的颠换(即嘌呤变嘧啶)。开发能够实现腺嘌呤碱基颠换的新型DNA碱基编辑器对基因治疗领域有着重大的潜在价值。
2023年1月9日,杨辉团队与临港实验室/上海脑科学与类脑研究中心胥春龙团队合作,在 Nature Biotechnology 期刊发表了题为:Programmable A-to-Y base editing by fusing an adenine base editor with an N-methylpurine DNA glycosylase 的研究论文。该研究开发出了一种新型DNA碱基编辑器,首次实现了高效的腺嘌呤碱基颠换编辑。
该研究综合利用蛋白质工程、流式细胞术、深度测序等技术手段,对ABE进行一系列的重新设计、工程化改造、蛋白质进化、突变筛选及验证,开发出了新型DNA碱基编辑器——腺嘌呤碱基颠换编辑器(AYBE,Y = C or T)。该研究对基础研究领域疾病模型的建立及基因治疗领域等都有着非常重要的意义。
这是辉大基因继获得中国首个自主研发CRISPR-Cas13基因编辑工具(Cas13X/Y)并拥有底层专利、开发出具有高效靶向编辑活性但极低脱靶编辑活性的高保真xCas12i变体(hfCas12Max)之后,在新一代基因编辑工具开发领域取得的新突破,。

现在广泛使用的ABE(Adenine base editor,腺嘌呤碱基编辑器)和CBE(Cytosine base editor,胞嘧啶碱基编辑器)可以实现A-to-G和C-to-T此类碱基之间的转换(transition;即嘌呤变嘌呤,嘧啶变嘧啶)。在CBE基础上开发出的CGBE或GBE(Glycosylase base editor,糖基化酶碱基编辑器)能实现C-to-G和C-to-A此类碱基之间的颠换(transversion;即嘧啶变嘌呤)。CGBE或GBE的开发得益于对CBE编辑副产物(包括 C-to-G 和 C-to-A的颠换)的深入研究,拓展了人们对DNA损伤修复机制的研究并拓宽了碱基编辑器的应用。
细胞中存在可以高效切除胞嘧啶脱氨产生的尿嘧啶(U)的酶(UNG,尿嘧啶DNA 糖基化酶),引入UNG或剔除CBE融合蛋白中的尿嘧啶糖基化酶抑制剂(UGI)组分都能通过生成无碱基(AP,apurinic/apyrimidinic site)中间体介导高效的C-to-G 和/或 C-to-A的碱基颠换。ABE的编辑副产物极少,是由于细胞中尚未发现能高效切除腺嘌呤脱氨形成的脱氧肌苷(I)中次黄嘌呤碱基(Hx)的酶,A脱氨形成的I直接被当作G读取,进而获得A-to-G的高纯度编辑。这也为开发AYBE增加了很大的困难。
研究团队发现N-甲基嘌呤DNA糖基化酶(MPG;也称烷基腺嘌呤DNA糖基化酶,AAG)有一定的切除Hx的活性,于是猜想可以通过工程化改造MPG逐步优化,开发出高效的AYBE。研究团队首先将MPG融合在ABE8e的不同位置构建了AYBE的三种原型版本。为了方便且灵敏地评估腺嘌呤碱基颠换的发生以及颠换编辑的效率,研究团队设计了一套基于内含子剪接可激活的荧光报告系统。
在该荧光报告系统中,只有发生了腺嘌呤碱基的颠换,才能纠正内含子剪接信号使剪接过程正确发生,进而激活绿色荧光蛋白(EGFP)的正常表达,以便结合流式细胞术检测绿色荧光阳性细胞的数目及荧光强度。研究团队利用A-to-T报告系统及A-to-C报告系统都检测到了腺嘌呤碱基的有效颠换编辑,并发现与另外两种融合原型相比,将野生型MPG融合在ABE8e的C端(TCM,称为AYBEv0.1)获得了最高比例的阳性编辑。
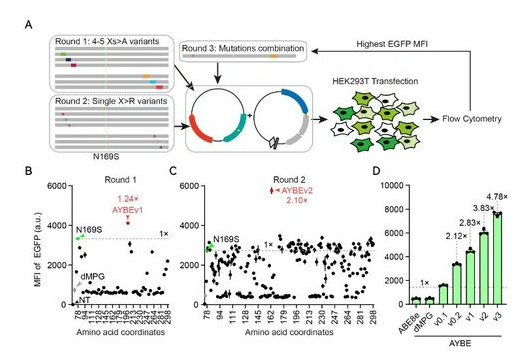
图1:AYBE的工程化设计、蛋白质进化、突变筛选及颠换编辑活性检测
为了提升AYBE的腺嘌呤颠换编辑活性,研究团队利用上述报告系统在哺乳动物细胞中对AYBE中的MPG组分开展了逐步的优化。研究人员设计了多种工程化改造方案,构建了一系列突变体库,经过多轮的突变筛选获得了腺嘌呤颠换编辑效率较高的突变体(图1)。利用报告系统评估,AYBEv3版本的腺嘌呤颠换编辑效率达到了初代版本AYBEv0.1的4.78倍,获得了非常显著的优化升级。各个突变体的颠换编辑效率在基因组内源位点上也得到了验证(A-to-T的编辑从 5.88%提高到了 15.49%,A-to-C的编辑从 14.42%提高到了 30.98%),而且AYBEv3有着与AYBEv0.1相当的低indels频率。
接下来,研究团队在基因组内的35个靶点对AYBEv3作了综合评估,发现其可实现高达72%的颠换编辑效率(其中个别位点A-to-C的颠换效率可达53%,纯度可达70%,图2)。AYBEv3在A7、A8这两个位置及CAA和CAG这两种基序有着最高的颠换编辑效率。另外,AYBEv3在多种哺乳动物细胞类型中都能有效的实现腺嘌呤的颠换编辑。通过对gRNA依赖的及gRNA非依赖的脱靶分析,研究团队发现与ABE8e相比,AYBEv3的DNA脱靶水平更低。该研究也进一步通过建立稳转细胞系探究了AYBEv3在一些疾病相关突变位点上的应用潜力。研究人员发现基因DMD和SLC26A4中提前终止密码子的突变及基因ATM和TTN中内含子剪接位点处的突变可以使用AYBEv3得到有效的纠正。
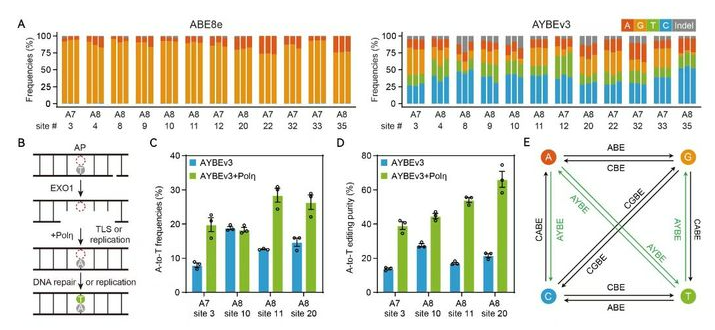
图2:AYBEv3在基因组内源位点上的性能评估及一种ATBE开发策略
在这项研究中,研究团队通过引入DNA损伤修复蛋白Polη(一种在跨损伤DNA复制过程中倾向于在AP中间体对侧添加A的DNA聚合酶),大大提高了A-to-T的编辑效率和纯度,为进一步开发更精准的ATBE或ACBE提供了新的策略(图2)。虽然AYBEv3的编辑效率及纯度仍需进一步提高,腺嘌呤颠换碱基编辑器的开发填补了目前碱基编辑器不能高效实现A-to-C或A-to-T的空白,对相关疾病模型的建立及基因治疗领域等都有着非常重要的意义。
原文链接:
https://www.nature.com/articles/s41587-022-01595-6
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言