《自然》发布颠覆百年癌症代谢理论,肿瘤环境中葡萄糖消耗罪魁祸首并非肿瘤细胞
2021-04-09 JACKZHAO MedSci原创
这一发现颠覆了过去百年来的肿瘤微环境中新陈代谢竞争的普遍观点,有助开发新的抗癌疗法和用于癌症诊断与检测成像新策略。
 NFCR
NFCR
4月7日,《自然》杂志在线发表了美国范德堡大学Kimryn Rathmell研究团队研究成果,这项题为“Cell-programmed nutrient partitioning in the tumour microenvironment”(肿瘤微环境中细胞程序化营养分配机制)最新研究发现或将改变此前认为的在肿瘤微环境中肿瘤细胞具有较高的葡萄糖摄取水平的认识。研究认为,肿瘤细胞并非此前认为的高代谢葡萄糖的罪魁祸首,而是被称为巨噬细胞的免疫细胞存在较高葡萄糖高代谢水平。这一发现颠覆了过去百年来的肿瘤微环境中新陈代谢竞争的普遍观点,有助开发新的抗癌疗法和用于癌症诊断与检测成像新策略。
 Reinfeld, B.I., Madden, M.Z., Wolf, M.M. et al. Cell-programmed nutrient partitioning in the tumour microenvironment. Nature (2021). https://doi.org/10.1038/s41586-021-03442-1
Reinfeld, B.I., Madden, M.Z., Wolf, M.M. et al. Cell-programmed nutrient partitioning in the tumour microenvironment. Nature (2021). https://doi.org/10.1038/s41586-021-03442-1
癌症新陈代谢的领域在过去20年中确实出现了爆炸式增长,但是基于奥托·瓦博格(Otto Warburg)在1922年发表的这一观察结果,即癌细胞可以以非常高的速率消耗葡萄糖。
正常细胞体内,葡萄糖会维持一个平衡状态,在缺氧状态时,葡萄糖会转变为丙酮酸进而转变为乳酸,当氧含量正常时,丙酮酸会进入三羧酸循环(tricarboxylic acid cycle, TCA)循环。而肿瘤细胞即使在有氧情况下也不利用线粒体氧化磷酸化产能,转而利用有氧糖酵解,即瓦博格效应(Warburg effect)。
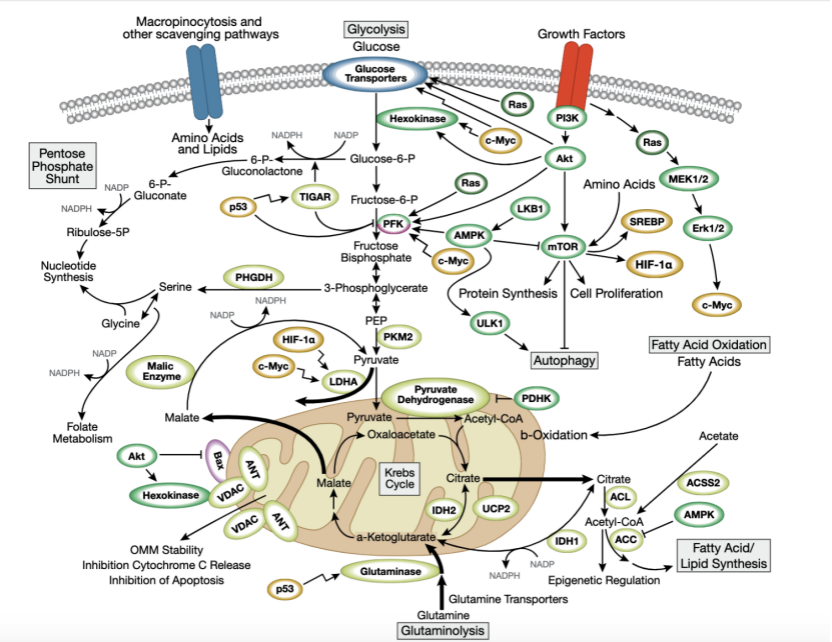 瓦博格效应(Warburg effect)通路,2021 © Cell Signaling Technology
瓦博格效应(Warburg effect)通路,2021 © Cell Signaling Technology
瓦博格效应代表着肿瘤细胞对葡萄糖利用方式由氧化磷酸化到糖酵解的转变,被认为是肿瘤的一大特征。瓦博格效应内在机制十分复杂,虽近年来研究提出并证实了相应的一些调控机制,依然还有很多疑问亟待解决,因此研究瓦博格效应中关键的调控点有助于揭示肿瘤细胞转移的机制,为肿瘤的靶向性治疗提供很好的方向和策略。
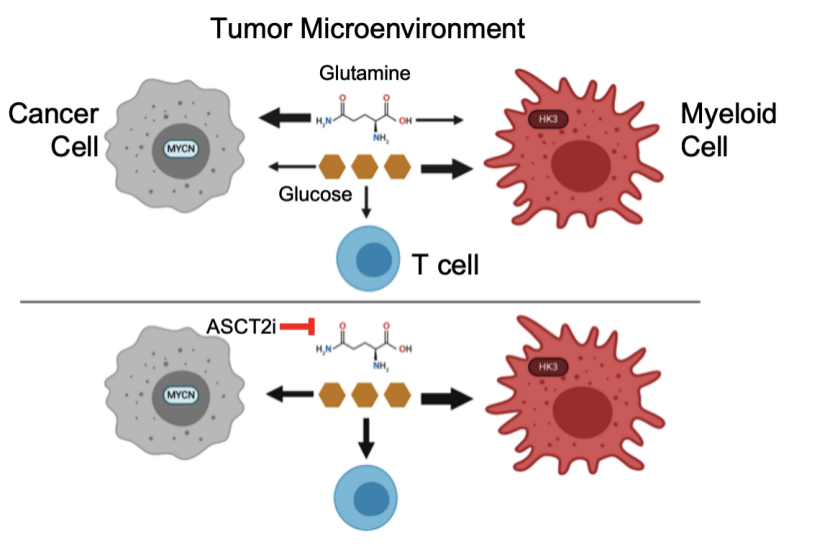 肿瘤微环境
肿瘤微环境
肿瘤浸润的免疫细胞也依赖葡萄糖,而在肿瘤微环境中(TME)中受损的免疫细胞代谢则有助于发生肿瘤细胞逃逸。然而,目前尚不清楚在TME中免疫细胞的代谢是通过细胞内源性程序失调还是通过与癌细胞争夺有限的营养素而失调的。
该研究在使用PET示踪剂来定位测量TME中特定细胞亚群对葡萄糖和谷氨酰胺的访问和摄取。在肿瘤微环境中,葡萄糖的摄取可以通过FDG(18F-fluorodeoxyglucose)的正电子放射断层造影技术对肿瘤细胞以及治疗的响应进行监测。研究小组使用了两种不同的PET示踪剂,分别用于追踪葡萄糖与谷氨酰胺,在一系列肿瘤细胞模型中,包括结直肠癌、肾癌和乳腺癌细胞中,均发现髓系免疫细胞(主要是巨噬细胞)对葡萄糖的摄取量最高,其次是T细胞和肿瘤细胞。而肿瘤细胞对谷氨酰胺的摄取量最高。研究团队认为,这是一种普遍现象,并在多种肿瘤类型中同样存在。
该研究对人类肾癌细胞以及小鼠的皮下MC38肿瘤的软组织间质液中的营养物质进行检测发现葡萄糖、谷氨酰胺和乳酸在肿瘤微环境中的浓度与匹配的健康肾组织或血浆中水平类似。但正常细胞与肿瘤细胞的葡萄糖与谷氨酰胺的代谢水平则存在显著差异。研究者还通过CD45+标记物将肿瘤微环境中的细胞主要分为CD45-的肿瘤细胞和CD45+的免疫细胞,发现免疫细胞能够消耗更多葡萄糖。免疫组化与FDG实验结果发现CD45+免疫细胞的空间分布并无显著差异。这表明细胞营养物质的摄取差异并不是由免疫细胞在肿瘤微环境中存在特异性的空间所致。
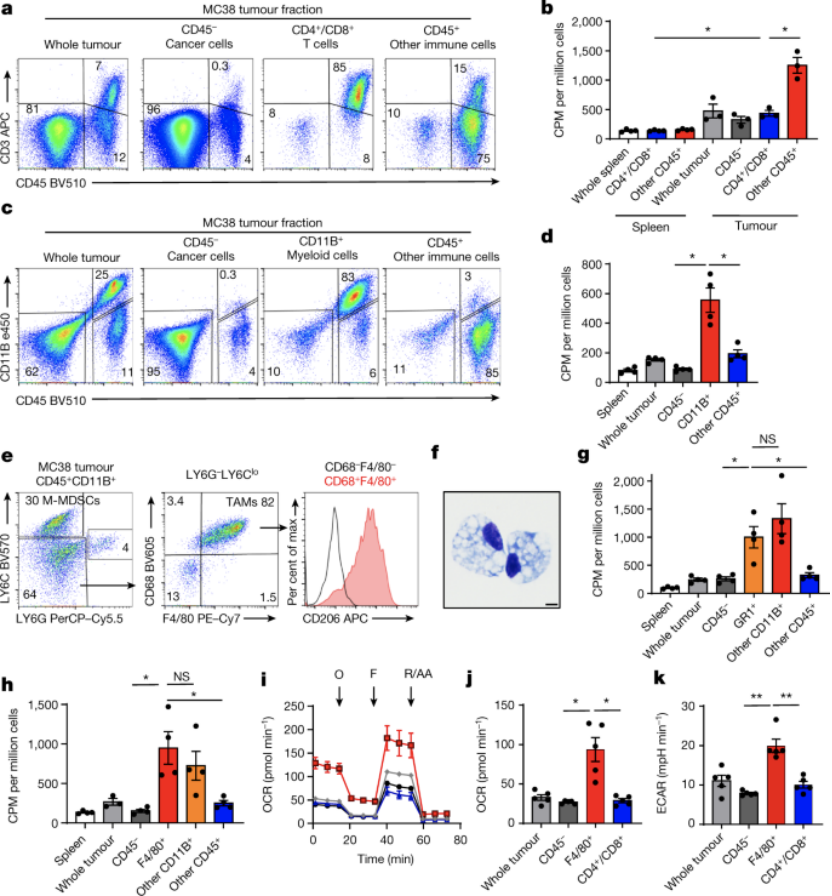
TME髓系细胞比癌细胞摄取更多葡萄糖
研究通过进一步对CD45+通过流式细胞分析,分离得到了CD11B+标记的髓系细胞与其他的CD45+的细胞相比,髓系细胞摄取的葡萄糖水平最高。而且在B细胞和T细胞缺陷的小鼠中CD11B+标记的髓系细胞仍然表现出很高的葡萄糖摄取能力,这表明髓系细胞葡萄糖高摄取效率并不通过适应性免疫。
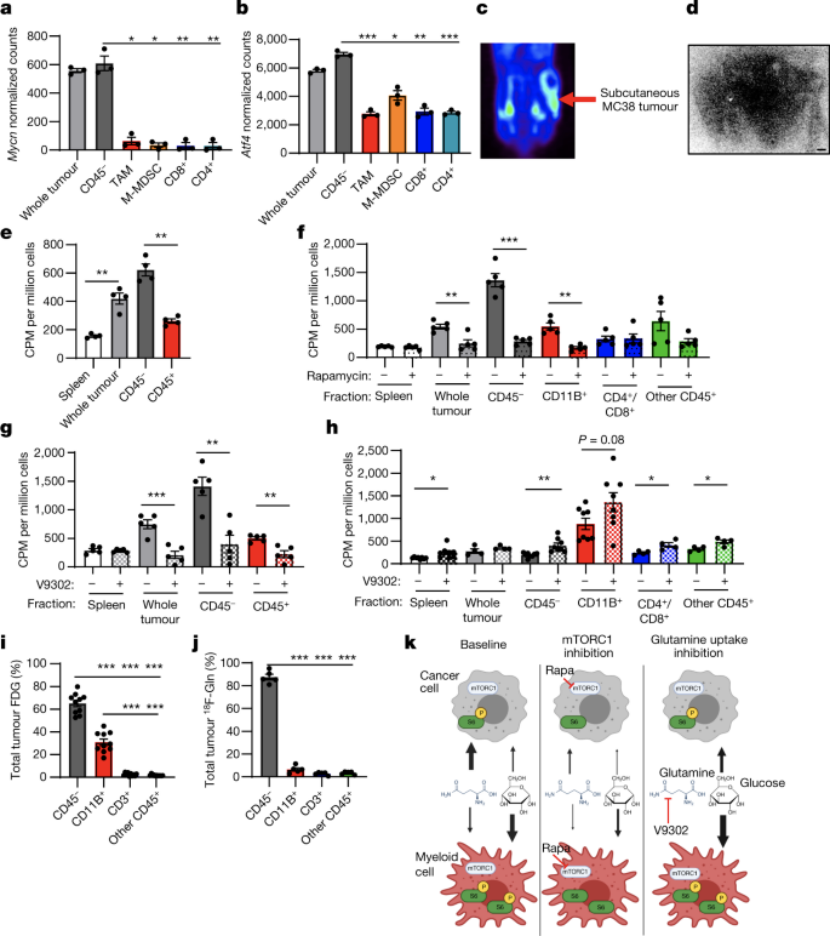 mTORC1支持TME中的葡萄糖摄取和代谢
mTORC1支持TME中的葡萄糖摄取和代谢
文章指出,此前已有研究表明,哺乳动物中mTORC1支持机体的合成代谢和营养吸收。mTOR(mammalian target of rapamycin),即雷帕霉素受体蛋白,主要的研究集中在哺乳动物。与人类透明细胞肾细胞癌和小鼠MC38和CT26肿瘤中的其他肿瘤细胞亚群相比,mTORC1通路在肿瘤骨髓细胞中具有更高水平的磷酸化核糖体蛋白(pS6)活性。
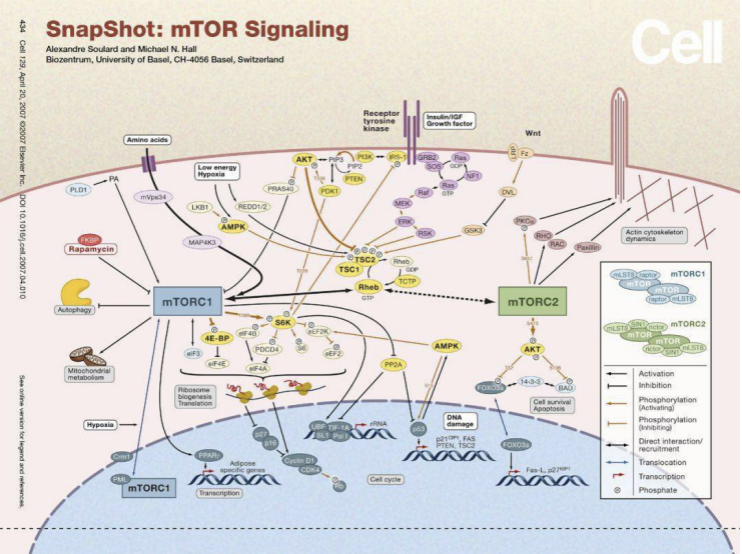 mTORC1信号通路,CELL
mTORC1信号通路,CELL
因此,研究者进一步研究mTORC1信号通路是否参与到了肿瘤微环境葡萄糖的摄取,通过对小鼠MC38肿瘤进行雷帕霉素处理后检测肿瘤细胞亚群摄取营养物质的能力,雷帕霉素是经典的mTOR的抑制剂,能够同时抑制住通路中两个大块头mTORC1和mTORC2的活性。结果发现显示雷帕霉素处理会下调pS6水平以及T细胞浸润性症。这表明,mTORC1信号通路参与了肿瘤微环境代谢。
最近的研究表明,抑制TME谷氨酰胺新陈代谢可以削弱癌细胞的生长,同时增加抗肿瘤免疫力。研究人员假设道,谷氨酰胺的摄取上调可能更优先支持癌细胞的代谢。在进一步研究肿瘤微环境中细胞对谷氨酰胺以及葡萄糖摄取之间的关系中在V9302处理后细胞中谷氨酰胺的摄取显著下降,但是肿瘤微环境中所有肿瘤细胞摄取葡萄糖能力都显著升高,谷氨酰胺的摄取和代谢能积极抑制葡萄糖的代谢;当谷氨酰胺受到限制时,肿瘤浸润细胞能进入并能够显著增加葡萄糖的摄取,因此可以认为,不同肿瘤细胞亚群的细胞内在程序决定了肿瘤微环境对葡萄糖和谷氨酰胺的摄取。
V-9302具有特异性识别hASCT2并抑制其转运氨基酸的功能。谷氨酰胺对肿瘤细胞的增殖生长非常重要,它主要由ASCT2等转运载体输送到细胞中,而ASCT2在肿瘤中表达经常上调,包括多种实体瘤与血液肿瘤,其在肿瘤中的作用已经成为研究热点之一。
总之,Kimryn Rathmell研究团队揭示出不同于以前广泛认为的癌细胞高度消耗葡萄糖从而通过营养竞争加剧免疫细胞功能障碍的经典观点,并且此前研究直接比较癌细胞和免疫细胞之间的体内葡萄糖代谢尚未得到可靠定量分析。这项新发现已经明确在肿瘤微环境中不同细胞亚群对于葡萄糖和谷氨酰胺摄取消耗存在显著差异。其中髓系细胞对于肿瘤内的葡萄糖的消耗能力最高,而癌细胞对于谷氨酰胺的吸收则最高,这种独特的营养分配方式主要是通过mTORC1信号通路以及与葡萄糖和谷氨酰胺代谢相关的基因表达进行调节的。
可以预见,未来这项新发现或将在抗癌疗法开发以及肿瘤监测解决方案中发挥重要作用。
附:
 美国范德堡大学研究人员左起:医学博士Kimryn Rathmell博士,Bradley Reinfeld博士,Matthew Madden博士和Jeffrey Rathmell博士。
美国范德堡大学研究人员左起:医学博士Kimryn Rathmell博士,Bradley Reinfeld博士,Matthew Madden博士和Jeffrey Rathmell博士。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肿瘤细胞#
62
新突破
167