【1】卡非佐米-来那度胺-地塞米松联合干细胞移植治疗多发性骨髓瘤

在多中心的II期研究 (NCT01816971)中,研究人员评估了对新确诊的多发性骨髓瘤(NDMM)患者进行自体干细胞移植(ASCT)联合卡非佐米-来那度胺-地塞米松(KRd)方案的疗效。
NDMM患者,予以4个疗程的KRd诱导-ASCT-4个疗程的KRd巩固,再予以10个疗程的KRd维持。主要终点是8个KRd疗程后严格的完全缓解(sCR)率。共有76位患者参与试验,中位年龄59岁(40-76岁),35.5%的患者有高危细胞遗传学。研究结果达成主要终点,8个疗程后的sCR率为60%。而且缓解的深度随着时间的延长而加深。在意向治疗(ITT)人群中,sCR率为76%。根据校正的ITT,采用二代测序评估的MRD阴性率为70%。中位随访56个月后,ITT人群的5年无进展存活率(PFS)和总体存活率(OS)分别为72%和84%,MRD阴性患者的PFS和OS分别为85%和91%,高危细胞遗传学患者的分别为57%和72%;MRD阴性的高危患者的分别为77%和81%。3/4级不良反应包括中性粒细胞减少(34%)、淋巴细胞减少(32%)、感染(22%)和心血管事件(3%)。无3/4级周围神经病变。
【2】AAV5基因治疗后人血浆中转基因产生的VIII因子的活性
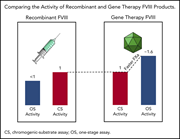
以腺相关病毒(AAV)为基础的基因治疗可以恢复血友病A(HA)内源性因子VIII(FVIII)的表达。AAV载体通常利用B结构域缺失的FVIII转基因,如valoccogene roxparvovec(AAV5-FVIII-SQ)中的人FVIII-SQ。
令人惊讶的是,转基因产生的FVIII-SQ在一期血凝块(OS)中的活性是发色底物(CS)的1.3-2.0倍,而重组FVIII-SQ的OS活性低于CS。在CS实验中,转基因FVIII-SQ与重组FVIII-SQ具有相似的特异活性(IU/mg),说明在OS实验中出现了不同的活性。不同的检测试剂盒和临床实验室中观察到转基因产生的FVIII-SQ具有较高的OS活性,这表明内在的分子特征是潜在的根本原因。在两名受试者中的进一步实验表明,转基因产生的FVIII-SQ加速了早期因子Xa和凝血酶的形成,这可能解释了较高的OS活性是基于OS和CS检测读出时间之间的动力学偏差。尽管凝血开始较快,但凝血酶整体水平没有受到影响。与关节出血的相关性表明,OS和CS检测对于区分血友病和非血友病FVIII活性水平仍然具有临床意义。
【3】RET激活与造血干细胞的存活和扩增

人造血干细胞(HSC)体外培养扩增是一个快速发展的领域,显示出对临床应用的巨大希望。近期研究表明,神经系统和神经胶质家族配体(GFL)是骨髓壁龛中造血存活和自我更新的潜在驱动力,但是,如何将其应用于HSC的维持和扩增尚待探索。
近日研究人员揭示了HSCs细胞表面的GFL受体RET在介导持续的细胞生长、抗压力和改善细胞存活中的作用,贯穿了整个体外扩增过程。用RET配体/共受体复合物GDNF/GFRa1处理HSCs,可提高初次移植时的祖细胞功能,并可提高二次移植时的HSC的长期功能。研究证实,RET驱动多条细胞内信号通路,包括关键信号成员AKT、ERK1/2、NFκB和p53,负责广泛的细胞和遗传反应,进而提高体外培养的细胞生长和存活。
【4】MIF与多发性骨髓瘤患者蛋白酶体抑制剂耐药
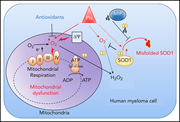
尽管在生物和化疗方面取得了重大进展,但多发性骨髓瘤(MM)在很大程度上仍无法治愈。MM管理中的主要问题是耐药性的产生。
研究发现复发患者来源的纯化的MM细胞中巨噬细胞迁移抑制因子(MIF)的表达明显高于持续缓解患者的,而且MIF高表达的MM患者的无进展存活期(PFS)和总体存活期(OS)明显更短。MM细胞系也表达高水平的MIF,敲除MIF可使MM细胞系对蛋白酶体抑制剂(PI)诱导的细胞凋亡敏感,对其他化疗的治疗效果没有影响。机制研究表明,MIF可通过抑制PI处理时的过氧化物的产生来维持线粒体功能,进而保护MM细胞免受PI诱导的细胞凋亡。具体而言,以纯三聚体形式存在的MIF,充当超氧化物歧化酶1(SOD1)的分子伴侣,抑制PI诱导的SOD1错误折叠并维持SOD1的活性。MIF抑制剂4-IPP和纯三聚体破坏剂ebselen,不会杀伤MM细胞,但可增强PI诱导的SOD1错误折叠和功能丧失,进而明显增加MM细胞系和原代MM细胞死亡。更重要的是,在体内抑制MIF活性展现出与PI的协同抗肿瘤活性,并可使PI耐药的MM细胞对PI治疗再敏感。基因谱数据显示MIF/SOD1的表达与MM患者对PI治疗的反应性明显呈负相关。
【5】β-catenin-TCF/LEF信号通过上调G-CSF受体促进粒细胞分化
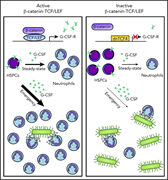
经典Wnt信号通路受β-catenin与TCF/LEF转录因子的相互作用调控,Wnt-靶基因随后转录激活。在造血系统中,该通路的功能主要通过对β-catenin的非特异性遗传操作来研究,但往往得到相互矛盾的结果。
近日研究人员采用表达人TCF4转录因子截断显性阴性形式(dnTCF4)的小鼠来研究β-catenin-TCF/LEF相互作用在造血系统中的作用,该小鼠模型的β-catenin-TCF/LEF的相互作用被破坏。β-catenin-TCF/LEF的相互作用被破坏导致未成熟血液细胞积累,粒细胞分化减少。在机制上,dnTCF4祖细胞的Csf3r基因下调,G-CSF受体水平降低,G-CSF治疗后下游Stat3的磷酸化减弱,G-CSF介导的分化受损。染色质免疫共沉淀实验证明TCF/LEF因子与CSF3R的启动子和推测的增强子区域直接结合。抑制β-catenin信号可损伤粒细胞急性生成程序的激活,粒细胞急性生成需要维持和扩增髓系祖细胞。因此,dnTCF4小鼠容易感染白色念珠菌,对5-氟尿嘧啶诱导的粒细胞再生更敏感。重要的是,遗传和化学抑制人CD34+细胞的β-catenin-TCF/LEF信号可减少粒细胞分化,而激活该信号可增强粒细胞生成。
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#Blood#点击进入话题查看更多相关文章 或评论时插入话题加入讨论
68
厉害厉害厉害。。
84