成人腺泡状横纹肌肉瘤骨髓转移1例
2023-02-19 沙英娇,等 中国人民解放军总医院第一医学中心检验科 “检验医学”公众号 发表于上海
骨髓转移肿瘤是身体其它部位的恶性肿瘤经血或淋巴道扩散至骨髓形成与原发瘤相同的实体性肿瘤。最易发生骨髓转移肿瘤的依次是:神经母细胞瘤、乳腺癌、小细胞肺癌、 前列腺癌、甲状腺癌、肾癌、宫颈癌及膀胱癌等。
前 言
横纹肌肉瘤(rhabdomyosarcoma,RMS)是来源于横纹肌组织或者向横纹肌分化的原始间叶组织的软组织恶性肿瘤。多发于儿童和青少年,极少数病例发生于成人。
世界卫生组织(WHO)将横纹肌肉瘤按组织学类型分为四种亚型:胚胎型横纹肌肉瘤(embryonal RMS,ERMS)、腺泡型横纹肌肉瘤(alveolar RMS,ARMS)、多形性横纹肌肉瘤(polymorphic RMS,PRMS)和梭形细胞/硬化性横纹肌肉瘤(spindle cell/sclerosing,SRMS)[1]。
PRMS最为常见,而ARMS恶性程度极高,其细胞学类似淋巴瘤的圆形细胞肿瘤,早期易发生淋巴及血道转移。ARMS常发生于四肢,头颈部(47%)、泌尿生殖系统(28%)及肢端(9%),骨髓转移较为少见[2]。RMS临床表现并无特异性,极易误诊为血液系统疾病。因此明确RMS骨髓转移的特征对降低误诊率有重要意义。
案例经过
患者女性,34岁,于2022年5月初无明显诱因出现乏力,活动后出现心慌、胸闷,可平卧,持续时间较短,休息后可完全缓解。
2022-06-02就诊当地医院,查血常规见异常:中性粒细胞计数8.2×10^9/L↑,单核细胞计数1.41×10^9/L↑,淋巴细胞计数6.47×10^9/L↑,嗜碱性粒细胞计数0.52×10^9/L↑,白细胞计数16.8×10^9/L↑,红细胞计数2.46×10^12/L↓,血红蛋白测定66g/L↓,平均红细胞血红蛋白量25.9pg↓,平均红细胞血红蛋白浓度314g/L↓,红细胞体积分布宽度测定CV 25.9%↑;血小板计数75×10^9/L↓,原始细胞占1.5%。考虑血液系统疾病,为进一步检查,门诊以“贫血伴血小板减低待查,抑郁状态”收治我院。
患者入院后完善相关化验及检查,化验示:血常规结果较前无明显波动,分类可见1.0%原始细胞。网织红细胞百分率7.46%↑,低荧光网织红细胞0.596↓,中荧光网织红细胞0.192↑,高荧光网织红细胞0.212↑;癌胚抗原测定等:NSE 56.54ng/mL↑;
急诊生化检验:钾3.49mmol/L↓;血沉39mm/h↑;血清丙氨酸氨基转移酶等:甘油三酯1.99mmol/L↑,乳酸脱氢酶1211.9U/L↑,肌酸激酶同工酶45.0U/L↑,高密度脂蛋白胆固醇0.95mmol/L↓;凝血筛查:凝血酶时间测定14.6s↓,血浆D-二聚体测定1.48μg/mL↑;体液免疫:α2球蛋白7.0%↓,β1球蛋白7.6%↑。
检查示:CT(胸部)检查提示:心腔密度减低,贫血可能;双肺CT平扫未见异常。超声(腹部)检查提示:1、肝囊肿;2、脾大;3、轻度脂肪肝。超声(心脏)检查提示:心脏结构及功能未见异常。超声(小器官)检查提示:双侧颈部多发低回声结节,肿大淋巴结,淋巴瘤?
临床案例分析
该患者“乏力1月”,入院后完善相关检查及化验,鉴别以下疾病:
1.急性白血病:
特别是白细胞减少和低增生性白血病,早期肝脾淋巴结不大,骨髓增生减低,仔细观察血象及多部位骨髓,可发现原始粒、单或原始淋巴细胞明显增多,骨髓活检有助于鉴别。
2.淋巴瘤:
表现为无痛性淋巴结肿大,可伴发热、盗汗、消瘦,临床表现和实验室检查无特异性,病理示确诊淋巴瘤的唯一依据。
3.免疫相关性全血细胞减少症:
本病表现为全血细胞减少及其相关症状,一般无肝脾淋巴结肿大,骨髓象示骨髓增生活跃,亦可减低,骨髓细胞Coombs试验可阳性,治疗以免疫抑制剂为首选。免疫相关检查可排除此病。
4.骨髓转移肿瘤:
实体肿瘤多以脏器受累为主,不同部位实体瘤由于组织来源以及肿瘤自身的生物学特点而表现各异。确诊依据是骨髓常规检查或活检找到转移癌细胞。
该患者目前诊断证据仍不足,继续完善PET/CT、骨髓穿刺、淋巴结穿刺活检、免疫相关检查等以明确诊断。
检验案例分析
患者女,34岁,中度贫血(小细胞低色素)伴血小板减少,外周血可见1.0%~1.5%原始细胞,肝、脾、淋巴结大,根据患者的临床症状及实验室检查结果,我们首先考虑该患者可能是:血液系统疾病,如急性白血病、淋巴瘤等,需要结合骨髓穿刺等结果以明确诊断。
后续检查:核医学(PET/CT)检查提示:1、右侧鼻咽部高代谢病变;双侧咽旁间隙、双侧颈部Ⅱ区及腹膜后多枚高代谢淋巴结;视野内中轴骨及附肢骨弥漫分布高代谢灶,以上考虑恶性,不除外鼻咽癌伴淋巴结及骨转移,需与血液系统恶性病变鉴别,建议鼻咽专科检查及右侧颈部淋巴结活检。2、脾大,脾代谢略增高,反应性改变可能。3、双侧附件区生理性囊肿,左侧代谢略增高,考虑生理性摄取,请结合生理周期。4、脂肪肝。5、脑部未见明显异常高代谢病变。(图1)
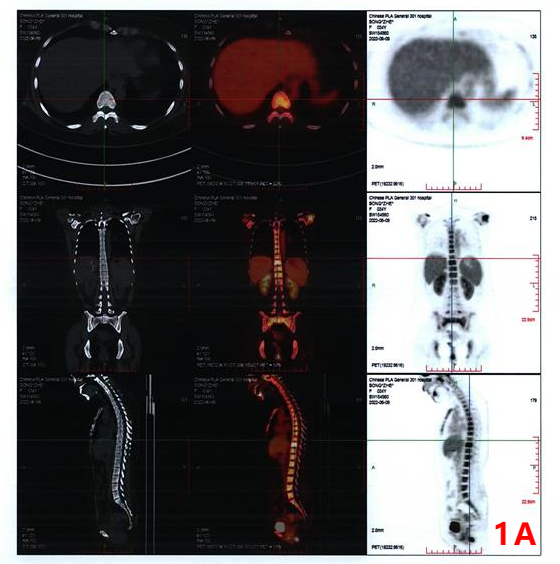
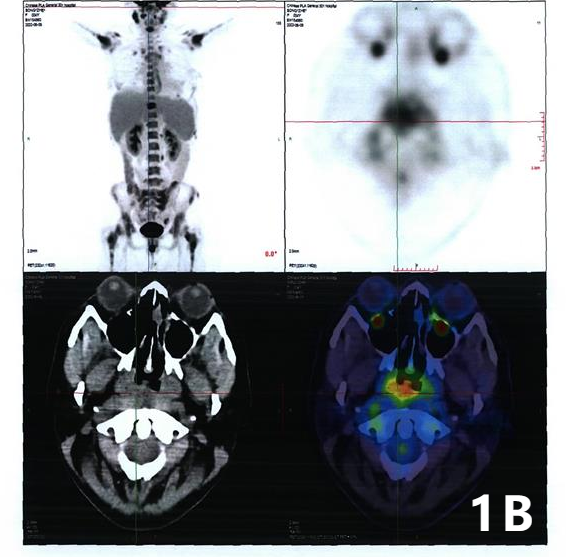
图1 PET/CT检查
1A:视野内颈胸腰椎骶尾骨多处放射性摄取增高;1B:右侧鼻咽部饱满,咽隐窝消失,放射性浓聚
MICM检查及骨髓活检:
细胞形态学结果:骨髓增生明显活跃,粒系、红系、巨核系增生受抑。阅全片,可见76.4%的异常细胞,成团或散在分布;胞核偏于一侧,核膜明显,染色质均匀细腻,核仁模糊不清,部分细胞出现瘤状突起,胞浆呈深蓝色,部分胞浆可见少量空泡,常分布在胞浆边缘,在远核端胞浆可见红色丝状物。部分细胞破坏溶解(图2)。此类细胞化学染色:POX阳性率:1%;PAS阳性率:60%(粗颗粒状或块状)(图3)。外周血可见幼粒、幼红细胞,异常细胞占1.0%,形态与骨髓中类似。
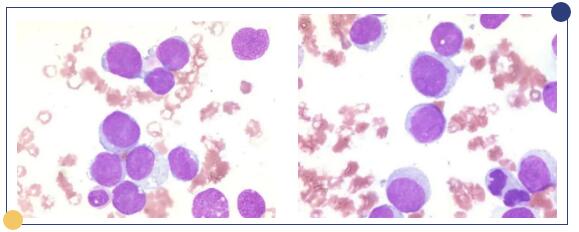
图2 骨髓涂片(瑞士染色x1000)
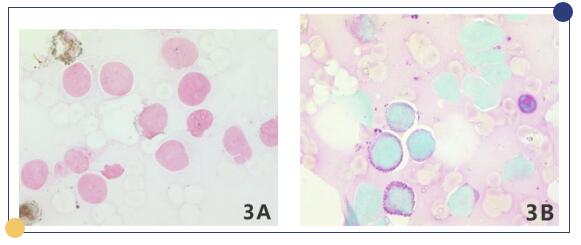
图3 细胞化学染色x1000
3A:过氧化物酶染色;3B:糖原染色
根据细胞学形态的特点,我们考虑该患者为肿瘤细胞骨髓侵犯,建议结合临床病理及免疫分型等相关检查,进一步明确诊断。后续的检查也证实了我们的判断。
骨髓免疫分型结果:获取并分析105万个细胞。各细胞群占有核细胞的比例如下:粒细胞(A门)39.33%,单核细胞(B门)5.85%,淋巴细胞(C门)15.00%,幼稚细胞(D门)1.23%,其他细胞(E门)37.75%。
其他细胞(E门)比例增高,表达CD56、CD81,少量细胞表达CD13、CD23、CD25,不表达CD34、CD15、CD117、HLA-DR、CD38、CD16、CD11b、CD33、CD64、CD61、CD41、CD42b、CD71、CD235a、CD303、CD304、CD123、CD141、CD36、CD19、CD20、CD22、CD138、CD2、CD4、CD5、CD7、CD8、CD43、CD103、CD30、CD27、CD28、CD45RA、CD45RO、CD158、胞浆CD3、胞浆CD79MPO、胞浆TDT。
为不明来源的异常细胞,约占有核细胞的37.75%。幼稚细胞(D门)中,少量细胞异常表达CD34、HLA-DR、CD117、CD33、CD38,为表型异常的幼稚髓系细胞,约占有核细胞的0.86%。粒细胞、单核细胞、淋巴细胞表型未见异常。
意见:(1)39%的异常细胞,考虑非造血细胞组织来源(神经系统来源?);(2)0.86%表型异常的幼稚髓系细胞。(图4)
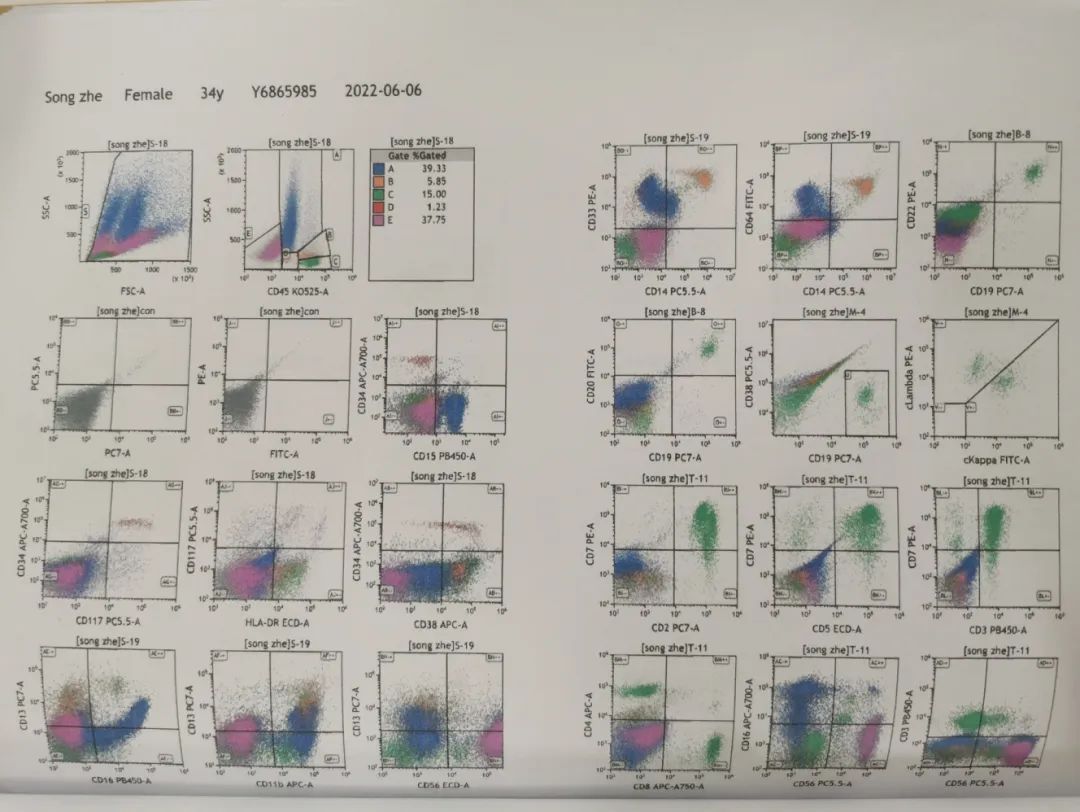
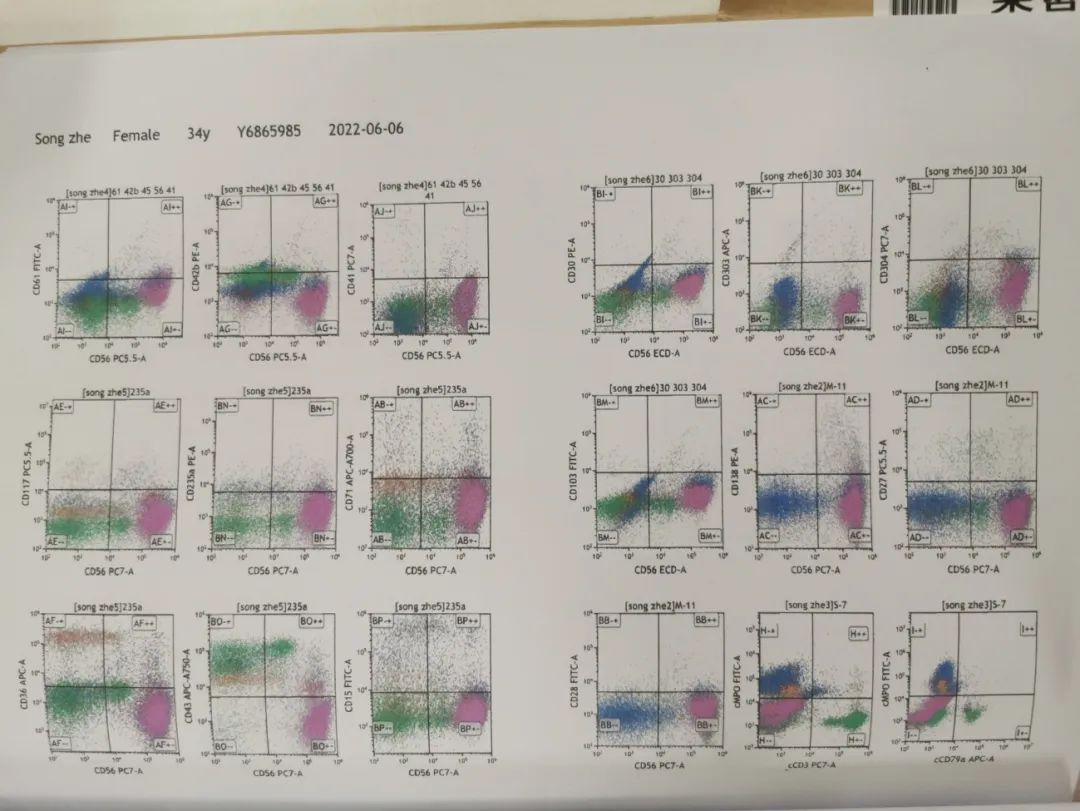
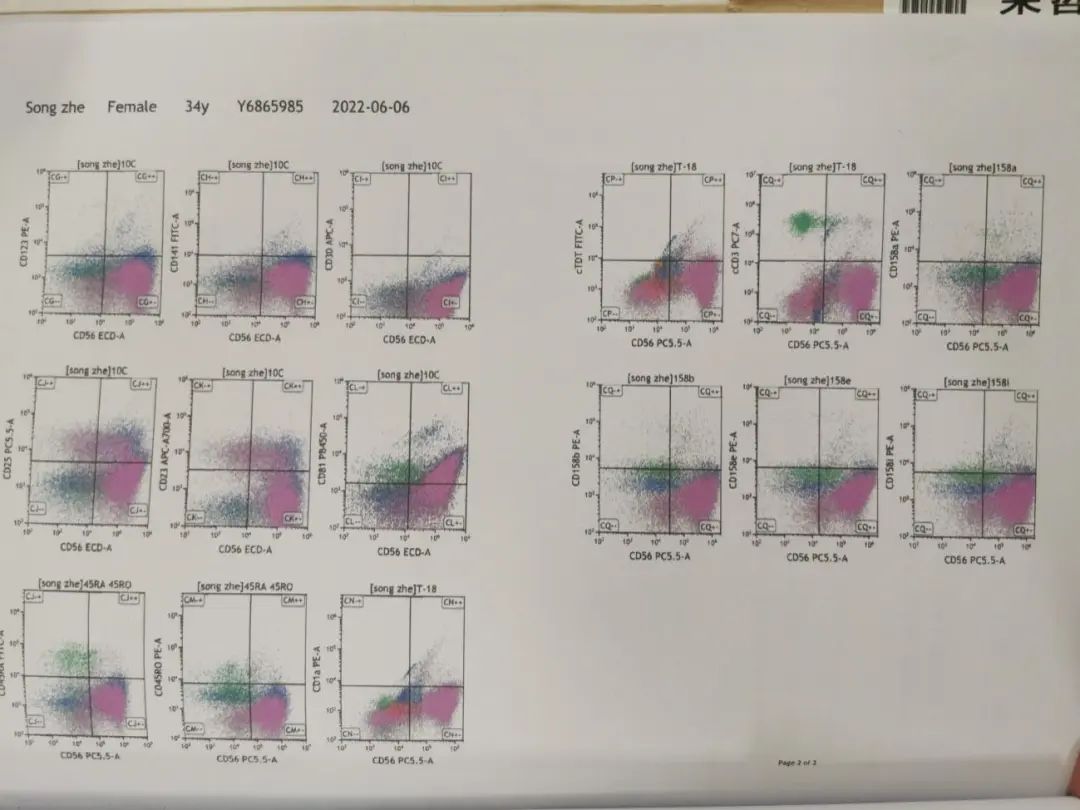
图4 骨髓免疫分型
血液病相关分子生物学结果:未检测到特征性基因异常。
染色体核型分析:46,XX[17],另见5个亚二倍体核型,未形成克隆,可能随机丢失,建议定期复查。
骨髓活检结果:骨髓腔内见小细胞恶性肿瘤,瘤细胞核形不规则,部分似有分叶,染色质深染,核仁不明显,核分裂像易见,可见病理性核分裂,部分胞质中等、淡粉染。结合免疫组化染色结果和PET-CT检查结果,符合转移性横纹肌肉瘤(来自鼻腔)。
免疫组化染色示:瘤细胞Vimentin(+),Desmin(+),Myo-D1(部分+),Myogenin(部分+),CD56(+),LCA(-),CD99(-),NKX2.2(-),CD34(-),SOX-10(-),Ki-67(-),NSE(-),Syn(-),CK(-),S-100(-),HMB45(-),ini-1(少数+),Brg-1(-)。
颈部病理检查结果:(右侧颈部低回声结节穿刺)小细胞恶性肿瘤,纤维组织将肿瘤分隔成清楚的巢状结构,结合免疫组化染色结果和影像学检查结果,符合转移性横纹肌肉瘤(腺泡状),来自“鼻咽”。免疫组化染色示:瘤细胞Ki-67(+70%),Desmin(+),Myo-D1(+),Vimentin(+),Myogenin(+);
知识拓展
骨髓转移肿瘤是身体其它部位的恶性肿瘤经血或淋巴道扩散至骨髓形成与原发瘤相同的实体性肿瘤。最易发生骨髓转移肿瘤的依次是:神经母细胞瘤、乳腺癌、小细胞肺癌、 前列腺癌、甲状腺癌、肾癌、宫颈癌及膀胱癌等。
恶性肿瘤骨髓转移,以癌为多见,肉瘤极少。骨髓转移性肉瘤主要包括尤文氏肉瘤、横纹肌肉瘤等。两者的区别主要有前者多为小圆细胞,胞体中等大小,形态较规则,核大,染色质较粗,核仁明显;而后者胞体较大,胞浆丰富,可见多少不一、大小不等的空泡,核大小不等,核仁深蓝而欠清晰。
骨髓转移肿瘤常以骨痛为首要症状,常见部位为腰骶部 、胸肋部或全身性 ,X线检查显示骨质疏松 、骨质破坏或骨密度显着增高,有时合并病理性骨折。由于肿瘤细胞增生,破坏正常造血组织,因此大多数患者有不同程度贫血、血小板减少,白细胞多数在正常范围。外周血出现幼粒及幼红细胞 ,曾被认为是骨髓转移瘤的特征性表现 。部分患者可见肝 、脾及淋巴结肿大 。
骨髓细胞学和骨髓活检是诊断肿瘤转移的金标准,肿瘤细胞主要有形态异型、分化异常的特点。骨髓转移癌细胞因原发肿瘤的不同而各异,但总的特点都不同于骨髓内的正常造血细胞。多数癌(瘤)细胞成簇、成团出现,少者4—5个成群,多者几十个细胞成簇,彼此间界限不清,形态大小不一,但也有单个散在分界清晰的癌细胞,直径一般大于骨髓细胞(巨核细胞除外),细胞呈多形性改变,可见空泡或脂肪变性,核质比例变大,核的形状与结构异常,核大,核染色质增粗,可见核分裂象,双核、多核易见,核仁巨大不规则,胞质淡蓝色,有少数空泡及颗粒。
典型骨髓转移性肿瘤细胞形态特点
神经母细胞瘤:
低倍镜下呈现一丛丛,一团团的瘤细胞块,可见菊花样排列,中心包裹着粉红色原纤维物质,细胞质相互融合,细胞间界限不清。好发于肾上腺,多见于5岁以下婴幼儿,而RMS较少发生在5岁以下;常有血清NSE及尿中儿茶酚胺含量升高。切片上可见HomerWright菊形团。虽然RMS也可见到红色丝状物,但常无特征性的排列方式。神经母细胞瘤不表达血细胞抗原,可表达CD56、CD81、CgA、Syn和GD2,染色体可检出del(1p)。
小细胞肺癌:
以小癌细胞为主,染色质致密深染, 核仁不明显,外形较规则;有时胞浆融合相互挤压、重叠呈铺路石样或镶嵌样;部分细胞呈站队现象如鱼骨状、竹节状、不规则样、龟背样和刀切样;有时散在分布似淋巴细胞,结合病史、影像学、肿标(NSE)和免疫组化(如NSE、CD56和Syn)等可鉴别。
胃癌:
以大细胞为主,外形不规则,胞核及胞质中 含有大量空泡,有的可见稀疏散在的红色颗粒,胞核多数偏位,呈圆形或椭圆形,染色质呈粗颗粒网状。有的可见大而透明的粘液空泡,其为印戒细胞的典型特点。
前列腺癌:
以大癌细胞为主,多形巨细胞聚集成团,核仁清晰是其突出特点,约3~10个,大小不等,数量不均。癌细胞之间界限较明显。
乳腺癌:
癌细胞呈腺腔样或乳头状排列,大小不等,多数以小癌细胞为主,核仁不明显。
骨髓转移肿瘤由于其细胞形态可能和白血病混淆,抑或实体肿瘤原发病灶的临床表现不明显,仅靠骨髓涂片细胞形态难以辨别,需结合流式、免疫组化、染色体核型分析帮助确诊。肿瘤细胞的骨髓流式细胞分析一般不表达髓系、 淋巴系(T淋巴细胞、B淋巴细胞)抗原。CD56(+)、CD45(-)多考虑神经内分泌肿瘤如:神经母细胞瘤、 小细胞癌、横纹肌肉瘤。骨骼肌分化的 Myo D1、Myogenin及结蛋白阳性可将RMS与其他实体肿瘤鉴别。
案例总结
本例为ARMS伴骨髓转移,属于临床Ⅳ期,临床上十分罕见,现将该病的特点总结如下。
01
形态学
瑞氏染色:骨髓中RMS细胞呈簇状或单个细胞散在分布,细胞小-中等大小,呈母细胞样,胞体圆形或椭圆形,体积约为60~100μm,部分细胞一端呈飘带状延伸或呈瘤状突起样伪足。胞核偏于一侧,核膜明显,细胞核染色质均匀细腻,核仁模糊不清,在细胞胞浆远核端可见一缕平行缠绕的红色丝状物,包裹细胞核一侧或以细胞核边缘为起点向细胞胞浆远端延伸,应为肌原纤维。胞浆呈深蓝色,部分细胞胞浆可见少量空泡,常分布在胞浆边缘,胞质也可出现嗜酸性颗粒。有时可见肿瘤细胞吞噬红细胞现象,其它系统各阶段细胞比值及形态大致正常。[3,4]
细胞化学染色:POX多为阴性,本病例中POX阳性率:1%;PAS多为阳性,其特点为细胞胞浆中可见红色粗大砂粒样阳性颗粒,颗粒沿细胞胞浆边缘均匀分布,在远核端和突起处颗粒常出现聚集增多现象,且更为粗大[3,4]。
02
免疫组化
肿瘤细胞可不同程度的表达desmin、vimentin、SMA、myogenin和Myo-D1[5],尤其是myogenin和Myo-D1具有高度特异性和敏感性,通常作为RMS的首选标准抗体[6]。desmin虽然不是骨骼肌特异性的标志物,但对横纹肌肉瘤的鉴别诊断意义较大[7],在硬化性横纹肌肉瘤中(SRMS)呈特征性核旁点状阳性表达,不同于其他组织学类型横纹肌肉瘤。
03
遗传学
ARMS具有特异性的染色体异常,最常见的染色体易位是t(2;13)(q35q14)(PAX3-FOXO1),t(1;13)(p36;q14)(PAX7-FOXO1)较少见[8] 。
对骨髓转移肿瘤,由于缺乏特异性的临床表现,临床上常易误诊。如果患者出现贫血、发热、骨痛、恶液质、血沉增快,即应作骨髓细胞学及骨髓活检,仔细寻找转移瘤细胞。
作为形态工作者,我们不仅要熟练掌握血液系统肿瘤细胞的形态特点,对非造血来源的肿瘤细胞也要认识清楚。在看到形态不典型的细胞时,要结合临床资料(年龄、病史、体征和实验室结果)、细胞形态学、病理活检与免疫组化及遗传学结果进行综合诊断,才能提高我们报告的准确率。
专家点评
中国人民解放军总医院第一医学中心检验科李绵洋
RMS早期易发生淋巴及血道转移,常见受累部位为头颈部、泌尿生殖系统及肢体末端,很少累及肝、肾、骨及骨髓等。ARMS细胞学类似淋巴瘤,容易与血液系统细胞如原始粒细胞、幼稚淋巴细胞、原始巨核细胞、组织细胞等混淆,可通过常规的骨髓涂片瑞氏染色、细胞化学染色及流式细胞学等鉴别。该病例比较罕见,病例内容详实,检查全面,通过该病例的学习,为今后诊断和鉴别骨髓中的RMS细胞与其它实体肿瘤细胞骨髓转移提供了更多实验室证据。
参考文献
[1] Fletcher CDM, Bridge JA,Hogendoorn P, et al. WHO Classification of Tumours of Soft Tissue and Bone. 4thed. Paris: IARC Press, 2013.
[2] 刘丽丽,赵成龙,刘文婷,等.腺泡状横纹肌肉瘤八例临床病理及分子遗传学特征分析[J].中华病理学杂志, 2016, 45(6): 411?412. DOI: 10.3760 / cma. j. issn. 0529?5807.2016.06.013.
[3] 张雪,李蓓,王琳,等.腺泡状横纹肌肉瘤骨髓转移后细胞形态特点分析及细胞化学染色鉴别[J].中国小儿血液与肿瘤杂志,2008,13(6):254-257.
[4] 邵靓婧, 曹红琴,梅建刚,等.1例前列腺胚胎性横纹肌肉瘤骨髓转移后细胞形态学分析并文献复习.现代肿瘤医学,2013, 21(11):2564-2567.
[5]Jawad N, McHugh K. Theclinical and radiologic features of paediatric rhabdomyosarcoma. Pediatr Radiol,2019, 49(11):1516-1523.
[6] Cessna MH, Zhou H, Perkins SL, et al. Are myogenin and myoD1 expression specific for rhabdomyosarcoma? A study of 150 cases, with emphasis on spindle cell mimics. Am J Surg Pathol, 2001, 25( 9):1150-1157.
[7] Yaren A, Guclu A, Sen N, et al. Breast metastasis in a pregnant woman with alveolar rhabdomyosarcoma of the upper extremity. Eur J Obstet Gynecol Reprod Biol, 2008, 140(1):131-133.
[8]Skapek SX, Ferrari A, Gupta A, et al. Rhabdomyosarcoma. Nat Rev DisPrimers, 2019, 5(1):2.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







