连接阿尔海默病淀粉样蛋白和线粒体病理的分子通路 CHCHD6/APP茨
2022-11-11 brainnew神内神外 brainnew神内神外
淀粉样β前体蛋白(APP)加工与阿尔茨海默病线粒体功能障碍之间的机制关系长期以来一直未得到相关的研究。
淀粉样β前体蛋白(APP)加工与阿尔茨海默病(Alzheimer 's disease, AD)线粒体功能障碍之间的机制关系长期以来一直未得到相关的研究。近日《Acta Neuropathol》期刊发表题为《A CHCHD6–APP axis connects amyloid and mitochondrial pathology in Alzheimer’s disease》的研究论文,作者团队研究发现哺乳动物线粒体接触位点和嵴组织系统的核心蛋白CHCHD6(coil- coil-helix-coil -helix- helix domain containing 6)通过循环反馈回路机制降低CHCHD6并提高APP加工从而连接了AD特征。
在细胞和动物AD模型以及人类AD大脑中,APP胞内结构域片段通过结合CHCHD6启动子抑制其转录。CHCHD6与APP相互结合并稳定。CHCHD6的减少增强了APP在线粒体相关ER膜上的积累,加速了APP的加工,并诱发线粒体功能障碍和神经元胆固醇积累,促进淀粉样蛋白病变。AD小鼠模型中CHCHD6缺失的补偿可以减少AD相关的神经病理和认知障碍。因此,作者认为CHCHD6连接了AD中的APP加工与线粒体功能障碍,这为患者提供了一个潜在的新的治疗靶点。
 AD模型中CHCHD6的降低
AD模型中CHCHD6的降低
与MICOS核心复合体溶解相关
在哺乳动物中,CHCHD6与mitofilin和CHCHD3复合物形成约700 kDa的MICOS(mitochondrial contact site and cristae organizing system)核心成分,控制着线粒体膜结构的完整性和生物发生。作者团队首先通过非变性聚丙烯酰胺凝胶电泳(BN-PAGE)使用抗CHCHD6、mitofilin或CHCHD3的抗体进行常规的western blotting检测MICOS的核心成分在AD细胞模型中的变化。结果发现,野生型Neuro2a细胞和稳定表达野生型APP 或AD相关的APP瑞典突变的Neuro2a细胞分离出来的线粒体的MICOS中CHCHD6明显减少(图1a)。
总蛋白裂解物的WB分析也证实了CHCHD6的选择性丢失(mitofilin和CHCHD3不受影响,图1b)。实时定量PCR 结果也显示与对照组相比APPwt和APPswe细胞中的CHCHD6 的mRNA降低了约70%(图1c)。相比之下,MICOS复合体的其他成分,包括mitofilin, CHCHD3,MINOS1,APOO,APOOL,CHCHD10和QIL1的mRNA水平并没有明显差异(图1c)。综上所述,这些结果表明,CHCHD6的降低可能在AD中MICOS核心复合体的溶解中发挥重要作用。
为了了解MICOS核心复合物的组成是否也在AD模型小鼠和人类AD组织中发生了类似变化,作者团队从APPNL-G-F和APPNL-F敲入(KI)小鼠入手检测。这些小鼠携带由其内源性启动子驱动的人源化小鼠APP基因并含有人类AD突变,能够发展出淀粉样斑块并形成神经认知缺陷。APPNL−G−F KI结构包含一个人源化的Aβ区域和三个致病突变(瑞典“NL”、伊比利亚“F”和北极突变“G”),而APPNL−F KI结构只有NL和F突变。这两种小鼠均以野生型水平表达APP,避免了APP过表达可能引入的假象,同时也产生了高量的致病性Aβ。
一般情况下三突变的APPNL−G−F KI小鼠能够迅速产生AD病理和出现认知障碍,而APPNL−F KI小鼠则表现出较慢的慢性疾病进展。作者团队分离了APP KI或WT小鼠在3、6和9月龄时海马线粒体并对其蛋白溶出物进行BN-PAGE和MICOS核心蛋白的western blotting。结果显示海马MICOS上CHCHD6的水平在AD小鼠中年龄依赖性的降低(WT小鼠中不存在这一现象),并且在疾病迅速发展的APPNL-G-F KI小鼠中最为严重(图1d)。而CHCHD6是唯一在APP KI小鼠中随年龄增长而下调的MICOS核心复合体蛋白,mitofilin和CHCHD3的水平在所有年龄的APP KI和WT小鼠中保持相似(图1e)。
与疾病慢性发展的APPNL-F KI小鼠相比,疾病迅速发展的APPNL-G-F KI小鼠中CHCHD6的下降发生得更早且幅度也更大(图1e)。在APP KI小鼠的海马中CHCHD6的 mRNA也显著降低了(图1f)。此外,对AD患者死后的海马检测也发现了CHCHD6的减少(图1g),并且mitofilin和CHCHD3的mRNA水平也没有改变(图1g)。接下来,作者团队通过免疫荧光观察了AD小鼠和人AD患者脑组织中海马CHCHD6的表达,并观察到了与年龄匹配的WT小鼠相比,APPNL−G−F小鼠CHCHD6的表达年龄依赖性下降(图2a和b)。
重要的是,CHCHD6免疫密度的降低与Aβ斑块积累的增加相伴而生(图2a和b)。CHCHD6主要表达在NeuN+神经元中,在WT和AD小鼠海马区NeuN+细胞数量不变的情况下,其表达量下降(图2c和e)。同样,与正常受试者相比AD患者海马区和皮层NeuN+神经元中CHCHD6的强度显著降低(图2d和f)。而CHCHD6在Iba1+小胶质细胞和GFAP+星形胶质细胞中的表达明显较低,表明CHCHD6的表达主要在神经元中富集。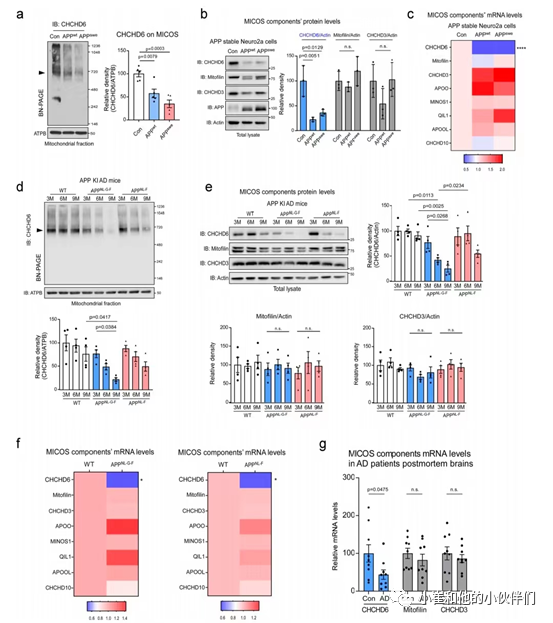 图一:AD模型中CHCHD6在转录水平选择性降低
图一:AD模型中CHCHD6在转录水平选择性降低
CHCHD6和APP在物理上相互稳定,
CHCHD6的缺失会导致APP异常加工
作者团队将神经母细胞瘤细胞暴露于有毒的Aβ1-42 (APP切割产物)中并没有改变CHCHD6、mitofilin、CHCHD3的蛋白质或mRNA水平,这暗示了淀粉样蛋白可能在生物学的其它方面影响了MICOS的完整性。为了进一步研究CHCHD6在AD中的分子作用,作者团队通过计算分析以确定在遗传、功能、表型和疾病水平上与CHCHD6相关的基因、途径、表型和疾病。基于之前开发的上下文敏感网络的排序算法对生物医学实体进行了优先级排序揭示了许多与CHCHD6显著相关的MICOS基因。
CHCHD6的预测路径排名靠前的是“蛋白质代谢”、“线粒体蛋白质输入”、“免疫反应”、“脂质和脂蛋白代谢”和“阿尔茨海默病”。这些数据强烈提示CHCHD6可能与APP存在生物学上的交叉,从而可能参与AD的病理生理过程。
由于APP已经定位到线粒体,作者团队接下来检查了CHCHD6和APP是否可能直接相互作用。从小鼠海马HT-22细胞中免疫沉淀APP结果可以显示出CHCHD6和APP之间的物理相互作用,这被CHCHD6 CRISPR-cas9敲除(KO)证实(图3a)。重组蛋白的体外结合试验也表明CHCHD6和APP之间存在直接和选择性的相互作用,因为APP和mittoillin或CHCHD3之间均未观察到结合(图3b)。
通过原位近距离连接试验(PLA)进一步检测APP与CHCHD6的结合,在对照组细胞中观察到PLA阳性斑点,但在CHCHD6 KO细胞没有观察到(图3c)。在WT和APPNL−G−F KI小鼠海马中也观察到抗APP和抗CHCHD6抗体之间的PLA阳性点,并且AD小鼠的相互作用显著减少(图3d)。作者团队进一步在正常人死后海马中证明了CHCHD6和APP存在强大的直接相互作用,而在AD患者海马中相互作用减弱(图3e)。另外作者团队还观察到使用shRNAs下调APP后显著增加了CHCHD6的水平(图3f)。这表明CHCHD6与APP水平呈负相关。
有意思的是,作者团队发现CHCHD6的减少增强了APP在MAMs(mitochondria-associated endoplasmic reticulum membranes)上的积累。与WT相比,CHCHD6 KO细胞中APP与MAM标记脂肪酸辅酶a连接酶4 (FACL4)之间产生了更多阳性PLA荧光点 (图3g);线粒体分选的WB也证实了CHCHD6 KO细胞MAM上APP和C99水平的增强。与WT相比,APPNL - G - F KI小鼠海马区APP和FACL4之间的PLA阳性点数量也明显增加(图3h)。MAMs是APP处理的细胞内部位, APP的C99切割产物(Aβ的淀粉原体) 在MAMs处的积累会损害线粒体生物能,破坏细胞脂质内平衡,并破坏膜脂成分。
作者团队在CHCHD6 KO细胞中观察到APP总蛋白水平显著下降和C99片段增强(图3i)。而重新表达CHCHD6后APP水平恢复,C99水平降低(图3i)。综上所述,这些结果表明CHCHD6与APP相互作用并相互稳定,CHCHD6的丢失促进了APP在MAMs上的积累和异常加工。 图二:CHCHD6在AD小鼠和AD患者的大脑神经元中减少。
图二:CHCHD6在AD小鼠和AD患者的大脑神经元中减少。
APP加工产物AICD结合
CHCHD6启动子并抑制CHCHD6转录
除C99外,APP加工的另一个裂解产物是AICD,它能通过AICD - Fe65 - Tip60复合体直接与基因启动子结合调节基因转录。APP蛋白水解后的AICD通过与Fe65结合转位到细胞核并调节基因转录。因此,作者团队进一步研究了AICD是否可能参与APP水平升高相关的CHCHD6的转录抑制。结果发现在敲除HT-22细胞中的CHCHD6后大大增强了细胞核中AICD的强度(图3j)。这一结果说明CHCHD6的丢失促进了APP的加工,也导致了AICD的积累。
接下来,作者团队在存在或不存在APP shRNA的HEK293细胞中过表达了APP、GFP标记的AICD和MYC-Fe65(稳定AICD并增强其核易位的adaptor蛋白)(图3k)。结果表明APP过表达会持续降低CHCHD6蛋白水平,并且单独表达AICD或AICD和Fe65共表达会导致更大程度的降低(图3k)。AICD和Fe65的共表达也抑制了APP敲低所引起的CHCHD6蛋白的升高(图3k)。这些结果表明AICD和Fe65水平与CHCHD6水平呈负相关。组蛋白乙酰转移酶Tip60能与APP的细胞质尾部和核衔接蛋白Fe65形成复合物,增强复合物与靶向基因启动子的结合能力。
为了进一步研究AICD和Fe65是否可以直接结合CHCHD6启动子,作者团队在HEK293细胞中过表达了AICD、Fe65和Tip60并将CHCHD6基因5 '区片段亚克隆到荧光素酶报告载体pGL3中。结果发现AICD和Fe65的共表达显著降低了CHCHD6启动子驱动荧光素酶表达的能力(图3l)。在共表达AICD、Fe65和Tip60的细胞中进行染色质免疫沉淀(ChIP)试验也发现三者能结合CHCHD6启动子(图3m)。这些结果表明AICD/Fe65/Tip60复合体直接结合CHCHD6启动子抑制其活性,并支持APP以高表达形式介导CHCHD6的转录抑制(图1)。
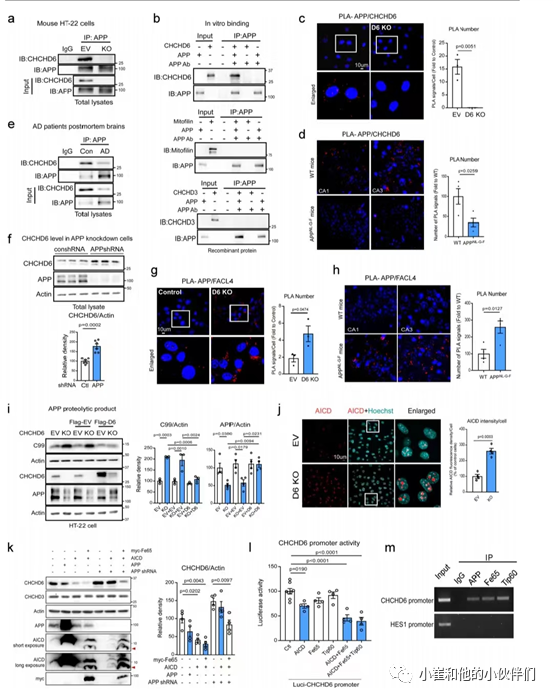 图三.CHCHD6与APP相互依赖,相互调节
图三.CHCHD6与APP相互依赖,相互调节
CHCHD6缺乏可引起
线粒体损伤和细胞死亡
接下来,作者团队评估了CHCHD6缺陷对线粒体完整性和神经元存活的影响。HT-22细胞中的CHCHD6 KO导致线粒体去极化,表现出线粒体膜电位(MMP)显著下降(图4a)。CHCHD6的下调增加了具有Tom20+点状或短棒状线粒体的细胞比例,表明线粒体碎裂(图4b)。并且CHCHD6 KO增强了对a β诱导的细胞死亡的敏感性(图4c)。
与以往的研究一致,CHCHD6缺乏抑制线粒体呼吸活性,表现为线粒体基础耗氧率降低,最大耗氧率降低,完整细胞ATP产生减少(图4d)。在稳定的APPWT和APPSWE过表达的Neuro2a细胞中也观察到ATP的产生减少(图4e)。在CHCHD6 KO HT-22细胞中也检测到较低水平的线粒体细胞色素C(图4f)。
通过过表达CHCHD6- FLAG构建物来补偿稳定的APP Neuro2a细胞中的ATP生成(图4e),能够减少HT-22小鼠海马神经元中由CHCHD6 KO诱导的细胞色素c释放(图4f),并减弱aβ诱导的细胞死亡(图4g)。综上所述,这些结果表明CHCHD6是维持线粒体质量控制和生物能学所必需的,CHCHD6的缺失会扰乱线粒体嵴的完整性,导致生物能量缺陷和细胞死亡。
 图四.CHCHD6缺乏可引起线粒体损伤和细胞损伤
图四.CHCHD6缺乏可引起线粒体损伤和细胞损伤
在AD模型中CHCHD6缺失
诱导神经元胆固醇积累
为了进一步评估CHCHD6缺乏对AD相关神经元损伤的影响,作者团队对CHCHD6 KO HT-22小鼠海马神经元进行了全转录组RNA-Seq分析。在HT-22细胞中鉴定出的5336个RNA转录本中筛选出了CHCHD6 KO HT-22细胞中明显改变的1827个RNA(图5a,绿色和红色点)用于路径富集分析。KEGG分析的结果显示CHCHD6 KO细胞中涉及胆固醇代谢的基因发生了显著改变(图5a)。Filipin(一种用于监测胆固醇沉积的荧光探针)染色结果也显示与对照细胞相比,CHCHD6 KO HT-22细胞中明显有更多的filipin结合胆固醇(图5b)。在AD中胆固醇的积累具有突触毒性,这些研究结果表明CHCHD6的缺失可能通过调节胆固醇代谢基因的表达来促进胆固醇在神经元中的积累。
为了测试CHCHD6丢失对体内神经元胆固醇水平积累的影响,作者团队使用AAV表达CHCHD6的shRNA来特异性下调APPNL−F小鼠和年龄匹配的WT小鼠的CHCHD6。并在人类突触素(hSyn)启动子的控制下,使得病毒仅限于在神经元选择性表达(图5c)。在病毒立体定向注射6个月后,作者团队观察到含有CHCHD6 shRNA的mCherry标记的AAV被成功表达(图5c)。并且注射了AAV5-CHCHD6 shRNA的小鼠海马蛋白提取物中CHCHD6含量与对照组相比明显减少(图5d)。小鼠海马区的Filipin染色结果显示CHCHD6的抑制造成了明显的胆固醇积累(图5e和5f。酶联免疫吸附分析也证实CHCHD6的抑制增加了小鼠海马中总胆固醇的含量(图5g)。
作者团队进一步分析了与胆固醇生物合成、降解、运输和修饰相关的基因,发现细胞和APPNL - F KI小鼠中在CHCHD6抑制后hmgcr、cyp46a1和lrp1显示出一致性的改变(图5h)。Hmgcr编码HMG-CoA还原酶(HMGCR),是胆固醇合成的限速酶;Cyp46a1编码细胞色素P450家族46亚家族A1(CYP46A1),在神经元中特异表达催化24-羟基胆固醇转化从大脑中排出。因此CHCHD6的下调可能通过增强胆固醇的生物合成和抑制胆固醇的消除来促进胆固醇在APPNL - F KI小鼠中的积累。而lrp1编码LDL受体相关蛋白(LRP1),介导了星形胶质细胞对含胆固醇的ApoE的摄取。LRP1的转录水平也被AICD-Fe65-Tip60复合体结合其启动子而抑制,因此其表达降低可能受到了与CHCHD6的下降类似的调控。
 图五.在AD模型中,CHCHD6缺乏可诱导神经元胆固醇积累
图五.在AD模型中,CHCHD6缺乏可诱导神经元胆固醇积累
CHCHD6减少加速了APPNL−F KI
小鼠的认知缺陷和AD病理
接下来,作者团队研究了CHCHD6的下调是否会影响病理慢性发展的APPNL−F KI小鼠的AD样神经病理和行为缺陷。在12月龄(注射AAV 6个月后)的WT和APPNL−F小鼠注射了AAV对照shRNA后,在Y迷宫认知测试中均没表现出认知障碍。然而,注射AAV5-CHCHD6 shRNA后的WT和APPNL−F小鼠Y迷宫试验中自发改变率下降(图6a)。虽然在12个月大的WT和注射了对照shRNA的APPNL−F小鼠的巴恩斯迷宫认知测试中没有表现出差异,但注射了AAV5-CHCHD6 shRNA的APPNL−F KI小鼠在寻找目标逃逸区域时花费了更长的时间和产生了更多的错误(图6b)。综上所述,这些数据表明慢性APPNL−F AD小鼠CHCHD6缺乏可促进空间学习和长期记忆障碍。
为了研究AD的病理标志物是否也受到CHCHD6基因敲除的影响,作者团队首先检测了12月龄海马蛋白提取物中APP处理产物的水平。WB分析显示,注射AAV-CHCHD6 shRNA增强了WT和APPNL−F小鼠的APP处理,显示C99片段水平升高(图6c)。在注射了AAV-CHCHD6 shRNA的APPNL−F小鼠中,C99产物的水平远远高于注射了对照shRNA的小鼠(图6c)。此外,与注射对照shRNA组小鼠相比,注射AAV-CHCHD6 shRNA提高了APPNL - F小鼠NeuN+细胞中AICD的强度(图6d)。使用6E10抗体对12个月大的小鼠的大脑部分进行染色以标记淀粉样蛋白聚集,结果发现注射了AAV-CHCHD6 shRNA的APPNL−F小鼠海马中有更多的6E10+淀粉样蛋白沉积和更大的淀粉样蛋白斑块覆盖区域(图6e)。这些数据与在HT-22细胞中的发现一致(图3i和j),即CHCHD6的缺失促进了APP的处理,进而加速了淀粉样蛋白的病理。
由于AD中突触丢失与认知能力下降密切相关,作者团队用抗突触素(一种突触前标记物)和突触后密度95 (PSD95:一种突触后标记物)的抗体对小鼠大脑部分进行染色。结果显示,注射了AAV-CHCHD6 shRNA后,APPNL - F小鼠CA3区突触素和PSD95免疫活性点数量显著减少,表明突触密度降低(图6f和g)。接下来作者团队又检查了神经炎症。免疫荧光染色显示注射了AAV-CHCHD6 shRNA的APPNL−F小鼠海马区IBA1(小胶质细胞的标记物)和GFAP(星形胶质细胞的标记物)的强度明显高于注射了shRNA对照组小鼠(图6g和i)。这表明CHCHD6的下调增强了AD相关的神经炎症。总的来说,这些数据表明CHCHD6的下调加速了AD小鼠的神经病理和认知缺陷。
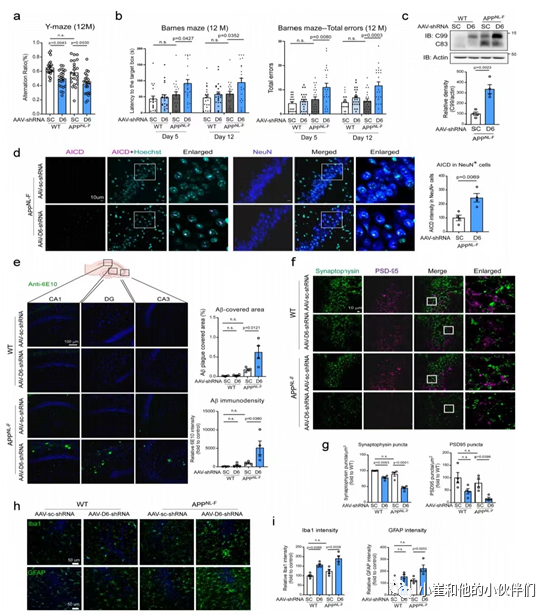 图六.病毒载体介导的CHCHD6下调加速了APPNL−F KI小鼠的认知缺陷和AD病理
图六.病毒载体介导的CHCHD6下调加速了APPNL−F KI小鼠的认知缺陷和AD病理
对CHCHD6缺失的补偿减轻了
APPNL - G - F KI小鼠的神经病理和认知缺陷
最后,作者团队探讨了补偿CHCHD6缺陷是否会减轻APPNL−F-G AD小鼠的AD样神经病理和认知缺陷。将CHCHD6插入hSyn启动子(AAV5-hSyn-CHCHD6-eGFP)控制下的AAV载体中,实现GFP标记的CHCHD6在神经元中的选择性表达(图7a)。采用AAV5-hSyn-eGFP作为空载体对照。将AAV5-hSyn-CHCHD6-eGFP或AAV对照构建体立体定向注射到3月龄APPNL-G-F小鼠和年龄匹配的WT同胎小鼠的双侧海马中。
6个月后 western blot分析显示AAV5-eGFP-CHCHD6注射的APPNL-F-G小鼠海马蛋白提取物中CHCHD6蛋白水平显著上调,与注射AAV5-eGFP对照的WT小鼠相似(图7b)。AAV5-eGFP对照组注射的APPNL-G-F小鼠在9月龄时通过Y迷宫评估显示短期认知能力下降;相比之下,注射了AAV5-eGFP-CHCHD6的年龄匹配的APPNL−G−F小鼠在Y迷宫测试中有改善的自发改变率,达到了与WT小鼠相似的水平(图7c)。
这些结果表明,CHCHD6神经元过表达可改善APPNL−F−G AD小鼠的空间工作记忆。此外,CHCHD6过表达也显著改善了9月龄APPNL−G−F小鼠在Barnes迷宫测试中的表现(图7d)。注射了AAV-CHCHD6的APPNL-G-F小鼠比注射了对照病毒的小鼠在寻找目标逃逸区域方面的时间更短,错误更少 (图7c和d)。
作者团队还评估了对CHCHD6损失的补偿是否可以减弱AD相关的胆固醇代谢紊乱。结果发现AAV5-eGFP-CHCHD6注射消除了升高的胆固醇合成基因HMGCR,抑制了胆固醇消除基因CYP46A1(图7e)。在9月龄时观察到注射对照病毒的APPNL - G - F小鼠海马中filipin+胆固醇显著增加,从3月龄开始AAV-eGFP- CHCHD6病毒表达降低了这一水平(图7f和G)。
此外,ELISA分析显示,AAV-eGFP- CHCHD6表达消除了APPNL - G - F小鼠海马中增加的胆固醇含量(图7h)。AAV-eGFP-CHCHD6对WT小鼠的胆固醇含量无影响(图7h)。与注射了对照病毒的小鼠相比,CHCHD6过表达还降低了9月龄APPNL−G−F小鼠NeuN+细胞中的AICD强度和海马区Aβ覆盖区域(图7j和8a)。
此外,影像学分析显示,注射对照病毒小鼠在9月龄时海马突触素和PSD95显著下降,通过AAV介导的CHCHD6过表达恢复正常(图8b)。此外,AAV5-eGFP-CHCHD6过表达显著降低了APPNL−G−F小鼠中IBA1免疫密度,表明抑制了神经炎症(图8c)。因此,这研究结果表明,补偿快速发育的APPNL - G - F小鼠海马中CHCHD6的缺失可以减少AD相关的病理和认知障碍。
 图七.对CHCHD6缺失的补偿可以减少APPNL - G - F KI小鼠的神经病理和认知缺陷
图七.对CHCHD6缺失的补偿可以减少APPNL - G - F KI小鼠的神经病理和认知缺陷
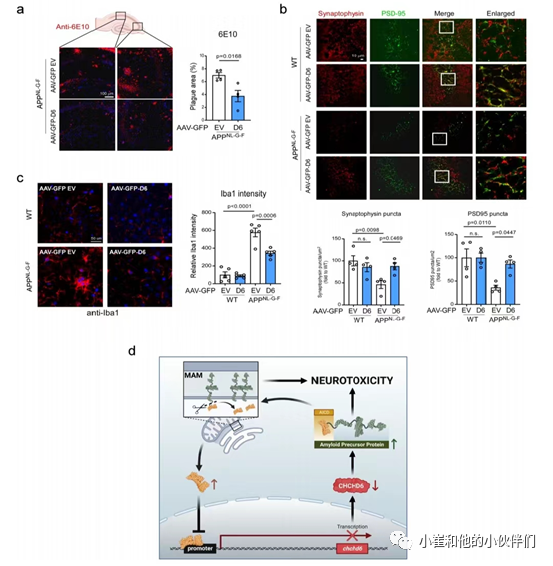 图八.对CHCHD6缺失的补偿可以减少APPNL-G-F KI小鼠的淀粉样蛋白积累、突触损失和胶质细胞增生
图八.对CHCHD6缺失的补偿可以减少APPNL-G-F KI小鼠的淀粉样蛋白积累、突触损失和胶质细胞增生
在这项研究中,作者团队揭示了MICOS亚基CHCHD6在调节APP淀粉样化过程(AD的标志物之一)和神经元胆固醇积累(AD的已知风险因素)中的独特功能。CHCHD6的病理性缺失作为一种诱导条件,作用于APP淀粉样物质加工和神经胆固醇积累的上游,这为线粒体损伤对AD神经病理的影响提供了直接的机制解释。同时,在AD模型中,对CHCHD6缺失的补偿可以恢复胆固醇稳态,抑制淀粉样蛋白生成,减少神经退行性变和认知缺知。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













学习了,谢谢分享
48