免疫治疗能否触及驱动基因阳性NSCLC,治疗禁区? OR 新突破?
2023-03-22 找药宝典 网络 发表于上海
ICI作为单药治疗或与化疗联合治疗NSCLC中每个可靶向致癌驱动因素的临床数据。
经过近二十年的靶向治疗开发,已经在NSCLC中建立了九个可操作的致癌驱动基因,每个驱动基因都有一套已获批的靶向治疗方法。然而,接受靶向方案的患者长期生存普遍受到获得耐药性的阻碍。随着治疗选择的增多,“驱动阳性”患者的表型已经扩大到包括对免疫检查点抑制剂(ICI ) 具有不同敏感性的肿瘤。了解ICIs在这些患者群体中的疗效和毒性,有助于按顺序优化部署ICIs并结合全身疗法制定更好的治疗策略。
来自SAGE journals的一篇综述中,总结了ICI作为单药治疗或与化疗联合治疗NSCLC中每个可靶向致癌驱动因素的临床数据,并讨论了未来提高获益的潜在策略。

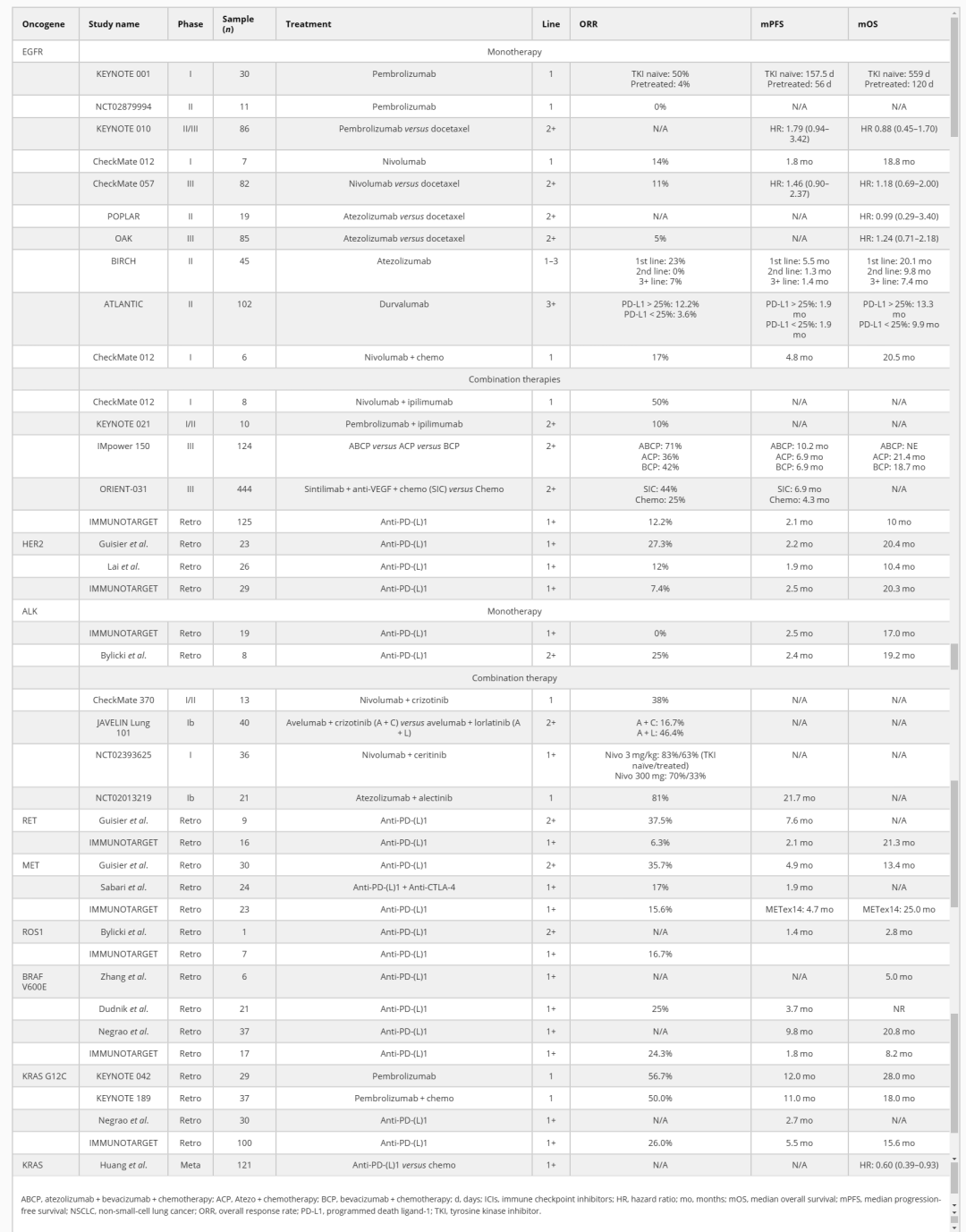
ICI在致癌基因驱动的NSCLC中的临床结果。
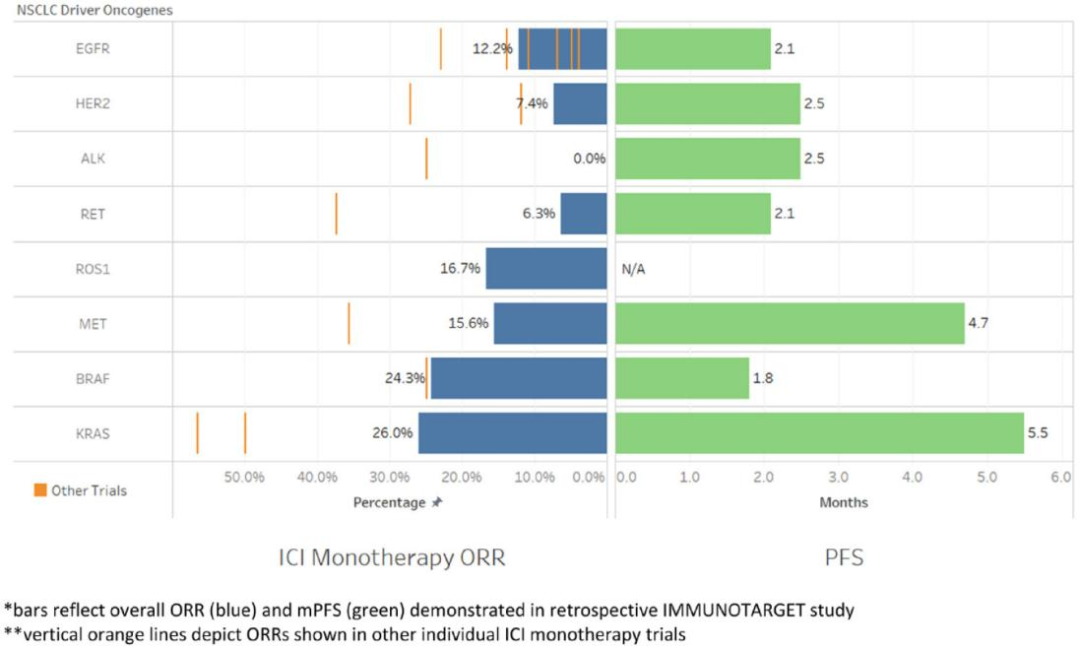
驱动致癌基因对NSCLC的ICI单一疗法ORR和mPFS。
1
EGFR突变
EGFR 中的经典突变(外显子19缺失或外显子21 L858R突变)是2004年第一个在NSCLC中发现的可操作致癌驱动基因,并且EGFR突变的NSCLC由于患病率高(约20%的肺腺癌),仍然是研究最多的致癌基因。尽管早期临床前数据表明EGFR突变上调PD-L1表达,但来自早期ICI单药治疗试验的大量亚组分析表明EGFR突变患者的疗效降低。
ICI单药无法改善EGFR突变人群的OS
在II/III 期KEYNOTE-010 试验中,与多西紫杉醇相比,帕博利珠单抗单药治疗在既往接受过治疗的 PD-L1 ≥ 1%患者中的总生存期 (OS) 有所改善(12.7 vs 8.5个月),但在亚组中显示EGFR突变人群的OS没有改善。同样,I 期CheckMate 012试验表明,纳武利尤单抗一线单药治疗EGFR突变晚期NSCLC患者疗效不佳,总缓解率(ORR)为23%,中位无进展生存期(mPFS)为1.8个月,中位OS (mOS)为18.8个月。在 III 期 OAK 试验中,阿替利珠单抗证明在先前治疗的NSCLC中,与多西他赛相比可显著改善OS(mOS 13.8 VS 9.6个月)。然而,在亚组分析中,EGFR突变患者无论接受阿替利珠单抗还是多西紫杉醇治疗,其OS均无显著差异。II 期BIRCH试验有了类似的发现,该试验在一线、二线和三线环境中评估了阿替利珠单抗,在EGFR突变和EGFR-WT肿瘤中均具有活性,阿替利珠单抗在EGFR中的mOS 疗效较差-突变组。最后,II 期 ATLANTIC 试验评估了度伐利尤单抗在接受至少两种既往治疗方案后进展的晚期NSCLC患者中的疗效。虽然 PD-L1 > 25% 的EGFR突变NSCLC比PD-L1 < 25%表现出更高的ORR,但获益非常有限,两组的 mPFS 均为1.9月。
ICI应用于TKI之前的方案假设被打破
一个最初的假设是,EGFR突变患者的ICI活性可能在没有暴露于TKI的患者中更好。这一假设源于对I期研究KEYNOTE-001的回顾性分析,其中4名未接受TKI治疗的EGFR突变NSCLC患者的ORR为50%,mPFS为157.5天,mOS为559天,而26名接受TKI预处理的患者ORR为4%,mPFS为56天,mOS为120天。然而,这一假设在帕博利珠单抗用于未接受过TKI治疗的EGFR突变患者的II期试验(NCT02879994)中得到了评估,该试验在25名计划患者中有11名因无效而停止;尽管73%的患者PD-L1表达≥50%,但只有一例有客观反应,并且在重新分析时发现EGFR该患者的突变被错误报告。此外,随后接受EGFR TKI治疗的两名患者死亡,其中一名死于肺炎,这表明对TKI之前使用ICI可能会增加毒性。
联合疗法提高一线生存获益/打破TKI耐药进展
加入化疗和VEGF抑制剂可显示强大潜力。在III期IMpower 150试验中,将阿替利珠单抗添加到贝伐珠单抗和化疗(ABCP)作为非鳞状NSCLC的一线治疗证明了所有患者的OS获益,在针对EGFR突变患者的亚组分析中(124例EGFR突变,91例敏化突变),与BCP相比,ABCP改善了OS和PFS(OS HR:0.31 [0.23–0.75];PFS HR:0.41 [0.23– 0.75])。在接受ABCP的患者中ORR为73.5%(vs 40.9%),mPFS为10.2个月(vs 7.1个月)。
在III 期ORIENT-31试验中,评估了EGFR-TKI治疗后进展的患者使用抗PD-1信迪利单抗联合化疗(有或无VEGF抑制剂IBI305)与单独化疗的效果。结果表明:在接受信迪利单抗+IBI305+化疗组中观察到更长的 mPFS(6.9 个月vs单独化疗mPFS为4.3个月)。此外,需要更多数据来确定VEGF抑制剂是否真正调节ICI敏感性EGFR突变的肿瘤。
2
EGFR ex20ins突变
EGFR ex20ins突变占所有NSCLC的2-3%,并且由于其对经典EGFR-TKI耐药性而与预后不良相关。值得注意的是,在HER2中也发现了结构相似的外显子20插入突变,占HER2 突变的90%。关于ICIs在EGFRex20突变NSCLC中疗效的数据很少,然而,一项回顾性研究证明ICI治疗的具有罕见EGFR 突变(包括外显子 18 G719X 和外显子20插入)与常见EGFR突变的患者中ORR有所改善(71% vs 35.7%)和 PFS(256 vs 50天)。需要进一步更大规模的研究阐明ICI在EGFRex20突变NSCLC中的作用,以及它是否真的不同于经典GFR突变NSCLC。
3
HER2突变
HER2突变发生在大约3%的肺癌中。一项回顾性研究纳入了23例HER2突变NSCLC患者,旨在评估纳武利尤单抗和帕博利珠单抗的效果,结果显示:ORR为27.3%,mPFS为2.2个月,mOS为20.4个月。在这项研究中,接受ICI治疗的HER2突变NSCLC的PFS和OS短于接受其他致癌基因驱动因素(如BRAF、MET和RET)的患者,大多数研究参与者的PD-L1状态未知。另一项回顾性研究显示,26名接受ICI治疗的HER2突变NSCLC患者的结果比非驱动NSCLC更差,ORR为12%,mPFS为1.9个月,mOS 为10.4个月。PD-L1表达也很低,在77%的分析患者中PD-L1 表达 <1%。
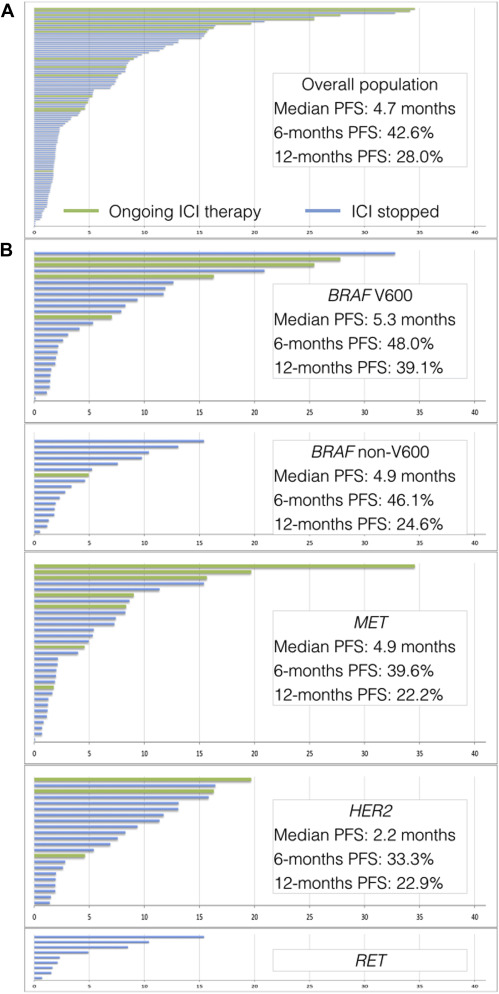
4
ALK突变
在早期ICI临床试验中,通过EGFR改变评估了具有ALK融合或重排的NSCLC,疗效相对较低。一项大型回顾性研究显示,19名接受单药ICI治疗的ALK融合NSCLC患者的反应率为0 %,68%的患者出现疾病进展,mPFS 为2.5个月。另一项回顾性研究显示,8名接受ICI治疗的ALK融合NSCLC患者的ORR为25%,mPFS为2.4个月,mOS为19.2 个月。
ALK TKI已被确定为ALK融合NSCLC的一线治疗药物,将探索把免疫疗法添加到TKI药物中。在 I/II 期研究 CheckMate 370中评估了在ALK融合NSCLC的一线治疗中,将纳武利尤单抗加入克唑替尼。然而,由于38% 的参与者出现严重的3级肝毒性,试验被终止,其中两人随后死亡。
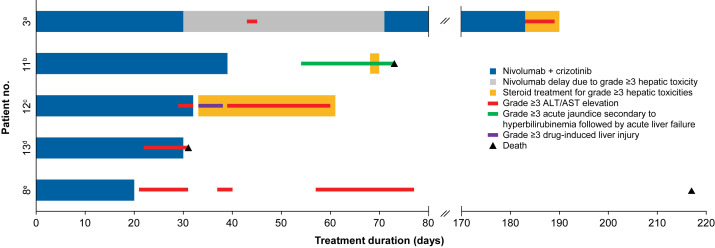
其他组合显示出更可耐受的毒性特征,但几乎没有令人信服的累加或协同益处证据。Ib 期JAVELIN Lung 101 试验在化疗后进展的ALK融合NSCLC患者中评估了 avelumab 联合劳拉替尼,ORR为46.4%,与单独使用劳拉替尼相当。在IMpower150试验中,观察到接受阿替利珠单抗+贝伐珠单抗+化疗(ABCP)的患者的生存期有所改善,在EGFR突变或ALK融合的患者中,ABCP组的PFS为9.7个月,而BCP组为6.1个月。
5
RET、ROS1 和 NTRK 重排
很少有数据评估携带罕见易位(如RET、ROS1或NTRK)的NSCLC患者对免疫疗法的反应。一项回顾性研究评估了9名RET突变NSCLC患者在二线及以上接受纳武利尤单抗或帕博利珠单抗治疗的效果,结果显示ORR为37.5%,mPFS为7.6个月。另一项回顾性研究在16名接受单药抗 PD1/PD-L1 治疗的RET重排NSCLC患者中显示ORR为 25%,mPFS为2.1 个月。对于ROS1重排的肺癌患者,在一项回顾性多中心研究中仅有一名接受ICI治疗并在靶向治疗和化疗中取得进展的ROS1 NSCLC患者,观察到的PFS为1.4 个月和OS为2.8个月。
6
MET ex14突变
MET TKI已在晚期MET ex14 NSCLC患者中表现出持久的反应。与上述其他驱动改变相比,MET ex14可发生在有吸烟史和部METex14肿瘤具有中度至高度的PD-L1表达。一项接受单药抗PD-1/PD-L1治疗的晚期 METex14 NSCLC患者的研究中显示ORR为17%和mPFS为1.9个月。PD-L1表达与TMB之间没有发现关联 ,并且在高PD-L1 (≥50%) 或高TMB肿瘤患者中,生存结果没有改善。两项独立的回顾性分析进一步证实了这种相对较低的反应。一项研究纳入了30名MET突变的转移性NSCLC患者,接受单药纳武利尤单抗或帕博利珠单抗治疗,显示ORR为36%,mPFS为4.9个月和mOS为13.4个月。值得注意的是,本研究中至少 37%的患者PD-L1表达> 50%,并且ICI用于一线和二线治疗。在IMMUNOTARGET分析中,METex14亚组( n = 23)的ORR为15.6%,PFS为4.7个月。综上所述,这些数据表明MET ex14比EGFR/HER2突变或ALK/ROS1/RET 突变更具有临床益处。
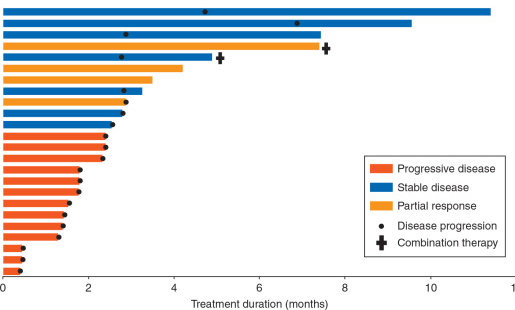
7
BRAF V600E突变
一项回顾性研究证实了BRAF突变NSCLC患者中更高TMB和PD-L1表达的发现。BRAF V600E突变患者与BRAF 非V600E突变患者接受ICI治疗的中位PFS相(3.7 vs 4.1个月)。然而,这项研究没有将接受ICI治疗的WT BRAF NSCLC作为对照组。另一项回顾性分析还发现,与其他驱动癌基因(如EGFR、HER2、KRAS)相比,具有BRAF突变的NSCLC的PFS和OS最长。BRAF V600E与非V600E相比,PFS和OS在数值上有所改善,但未达到统计学差(PFS 9.8 vs 5.4 个月;OS 20.8 vs 14.9 个月)。
8
KRAS G12C突变
一项对Flatiron数据库中PD-L1 > 50%患者的回顾性研究分析表明,与单药治疗的WT患者相比,KRAS突变患者的结局有所改善(mOS 21.1 vs 13.6 个月),但在化免联合治疗中没有改善。尽管没有统计学意义,但KRAS改变的患者受益于ICI或化学免疫疗法。
其他分析表明,KRAS 变患者与联合化学免疫疗法治疗的WT患者的结果相当。KEYNOTE-189试验的回顾性分析评估了帕博利珠单抗与安慰剂联合化疗治疗非鳞状NSCLC的疗效,未发现KRAS突变患者与无突变患者相比在化疗中加入ICI有任何不同的获益。最近的数据还评估了 KRAS 抑制剂与ICI联合使用的安全性和有效性。CodeBreak 100/101 评估了sotorasib 与帕博利珠单抗或阿替利珠单抗的组合,并证明3-4级AE发生率更高,特别是肝酶升高。相反,阿达格拉西与帕博利珠单抗联合使用显示出较少的安全事件。
治疗策略
鉴于许多驱动突变肿瘤对ICIs具有明显的原发性耐药性,增强这些肿瘤的抗肿瘤免疫力的策略仍然是一个重要的未满足的临床需求。迄今为止,大多数努力都依赖于将 ICI 与其他疗法相结合。虽然有充分的理论证据表明化疗、RT 或靶向治疗可以增强抗肿瘤免疫力,事实上模拟实验表明ICI +化疗反应率的提高主要是由于不重叠的治疗敏感性。化疗+ ICIs在驱动突变患者中的增强疗效也很难评估。
在 IMpower150 试验中,最令人信服的获益出现在化疗联合阿替利珠单抗和贝伐珠单抗 (ABCP)与化疗+贝伐珠单抗(BCP)相比,即使在EGFR和ALK改变的患者中也是如此。试验中观察到的获益与其他试验中的类似阴性数据相比表明,VEGF抑制剂可能具有差异性治疗益处,与证明VEGF抑制的免疫调节作用的临床前数据一致。其他组合策略,如抗PD-(L)1联合CTLA-4抑制剂,尚未在EGFR/驱动突变的NSCLC中进行特异性评估,其他合理组合包括IL-10受体激动剂、YAP抑制剂和一种抗CD73化合物,仍处于早期研究阶段。
总结
靶向疗法和免疫疗法的发展彻底改变了NSCLC的治疗格局。了解何时以及如何单独或组合使用靶向治疗、免疫治疗、化疗和放疗变得越来越重要,因为每个驱动因素对每种治疗类别都有其独特的反应模式。EGFR 经典突变和外显子20突变、HER2突变和ALK/ROS1/RET/NTRK融合肺癌具有整体低反应率和短PFS,无论ICI是作为单一疗法还是与化疗一起使用。METex14跳跃和BRAF突变肺癌的临床获益相对增加,但疗效仍低于一般人群的NSCLC患者。KRAS突变的肺癌患者对ICIs有很好的反应,但临床表现是异质的,可能部分是由于KRAS共突变对结果的影响。将ICIs与靶向治疗相结合的努力受到较高毒性率的阻碍,但没有证据表明其获益增加,尽管对新型药物和组合的研究很重要。仍迫切需要未来的研究和临床调查,以将免疫疗法的长期益处带给不同的致癌基因驱动肺癌亚群。
参考文献:
Vokes NI, Pan K, Le X. 免疫疗法在致癌基因驱动的非小细胞肺癌中的疗效。肿瘤内科治疗进展。2023;15。doi: 10.1177/17588359231161409
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言