O+Y、D+T、K+Y一线治疗晚期NSCLC 谁是最佳免疫拍档?
2023-03-13 找药宝典 网络 发表于上海
双免疫O+Y、D+T、K+Y一线治疗晚期NSCLC 谁是最佳免疫拍档?
细胞毒性T淋巴细胞相关抗原4(CTLA-4)是一种T细胞活化的负调控因子,阻断CTLA-4已被证明能够增强T细胞的活化和增殖,包括肿瘤浸润性效应T细胞的活化和增殖。抑制CTLA-4信号传导还可减弱调节性T细胞的功能,这可能有助于T细胞反应性(包括抗肿瘤免疫反应)的普遍提升。其与PD1/PDL1存在协同,使其成为潜在的免疫治疗搭档。其中,纳武利尤单抗(O)+伊匹木单抗(Y)、度伐利尤单抗(D)+Tremelimumab(T)、帕博利珠单抗(K)+伊匹木单抗(Y)等都在肿瘤治疗上进行相应的探索,今天,我们以非小细胞肺癌(NSCLC)为例,看一下这三种方案的疗效:
01
O+Y:CheckMate-227
2020年5月15日,美国药品监督管理局(FDA)基于CheckMate 227研究1a部分,批准纳武利尤单抗联合伊匹木单抗用于转移性NSCLC成人患者(PD-L1≥1%且无EGFR或ALK基因突变)的治疗,成为全球首个肺癌一线治疗的双免疗法。
CheckMate 227是一项开放性III期临床研究,评估以O药为基础的治疗方案对比含铂双药化疗用于晚期NSCLC患者(包括鳞癌和非鳞癌患者)一线治疗的情况。研究第一部分在评估O+Y与化疗比较时共有两个主要终点:一个是具有PD-L1表达的肿瘤患者的总生存期(OS, 在1a部分评估),另一个主要终点是高肿瘤突变负荷(TMB > 10个突变/Mb,无论PD-L1表达状况如何)患者的无进展生存期(PFS,在1a和1b部分评估)。1b部分:在未表达PD-L1(PD-L1<1%)的患者中评估,与化疗(每3周一次,最多4个疗程)相比,O+Y或者O药联合化疗的疗效。

结果显示:在第1部分中,无论患者PD-L1表达状况如何,与化疗相比,O+Y用于高肿瘤突变负荷(TMB≥10个突变/Mb)患者,研究结果达到共同主要终点PFS。此外,相比化疗,O+Y联合治疗用于PD-L1 ≥1%的一线非小细胞肺癌患者,可以带来更高的总生存期(OS)获益。
在PD-L1≥1%患者中,全球人群和亚裔人群均能持续从O+Y双免疫治疗中得到OS获益,在亚裔人群数据中,双免疫组1年、2年、3年OS率分别为79%、56%和53%,过半患者接受双免疫治疗生存超过了3年,而化疗组这一比例仅为37%。双免中位OS仍然未达到,化疗组中位OS为24.8个月(HR=0.72,95% CI 0.47-1.11),即与单纯化疗相比,双免降低了亚裔患者28%的死亡风险。相比在全球数据中,双免疫组63%、40%和33%的1年、2年、3年OS率,及17.1 vs 14.9月的OS(HR=0.79,95%CI 0.67-0.93)。可以说,双免疫治疗在亚裔患者中的数据毫不逊色。
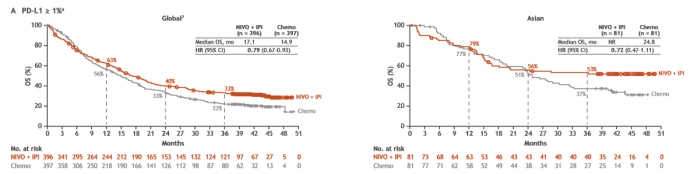
在ITT人群中(PD-L1≥1%和PD-L1<1%),获益仍显著,亚裔双免疫组1年、2年、3年OS率分别为76%、53%和51%,双免对比化疗中位OS为36.2个月vs 22.9个月(HR=0.66,95%CI 0.48-0.92),与单纯化疗相比,双免降低了亚裔患者34%的死亡风险。而全球双免疫组1年、2年、3年OS率分别为62%、40%和34%,双免对比化疗中位OS为17.1个月vs 13.9个月(HR=0.73,95%CI 0.64-0.84)。证实了亚裔患者与全球的整体人群获益旗鼓相当。
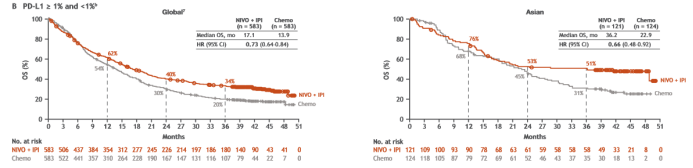
CheckMate-227研究中的安全系数要明显优于化免联合,并优于化疗本身。此次亚裔患者安全性分析再次证实,亚裔患者与全球安全性数据基本一致,尚未发现新的安全信号。
02
D+T:POSEIDON
2022 年 11 月 10 日,FDA已批准tremelimumab(Imjudo)与durvalumab(Imfinzi)和铂类化疗联合用于治疗转移性非小细胞肺癌(NSCLC)患者,且无致敏EGFR突变或ALK畸变。本次批准是基于 POSEIDON 3期试验数据,在随访4年后,总体生存率显著提高,为肺癌患者提供了一种双免疫联合疗法的新选择。
Tremelimumab是一款抗CTLA-4单抗,通过阻断T淋巴细胞表面的CTLA-4的活性,加强T细胞的活化并增强对肿瘤的免疫应答,从而促进癌细胞死亡。Durvalumab则是一款抗PD-L1抗体,此前已在非小细胞肺癌、小细胞肺癌、尿路上皮癌及胆道癌获批适应症。D+T双免组合在许多癌种中展现很好的疗效。
POSEIDON (NCT03164616) 3期临床研究是一项随机、多中心、主动对照、开放标签研究,针对未接受过系统治疗的转移性 NSCLC 患者。患者被随机分配到三个治疗组之一:
(1)tremelimumab、durvalumab 和铂类化疗 4 个周期,然后每 4 周进行一次 durvalumab 和维持化疗。患者在第 16 周接受第五剂曲美木单抗治疗;
(2) durvalumab 加铂类化疗 4 个周期,随后进行 durvalumab 和维持化疗;
(3)以铂类为基础的化疗 6 个周期,然后进行维持化疗。

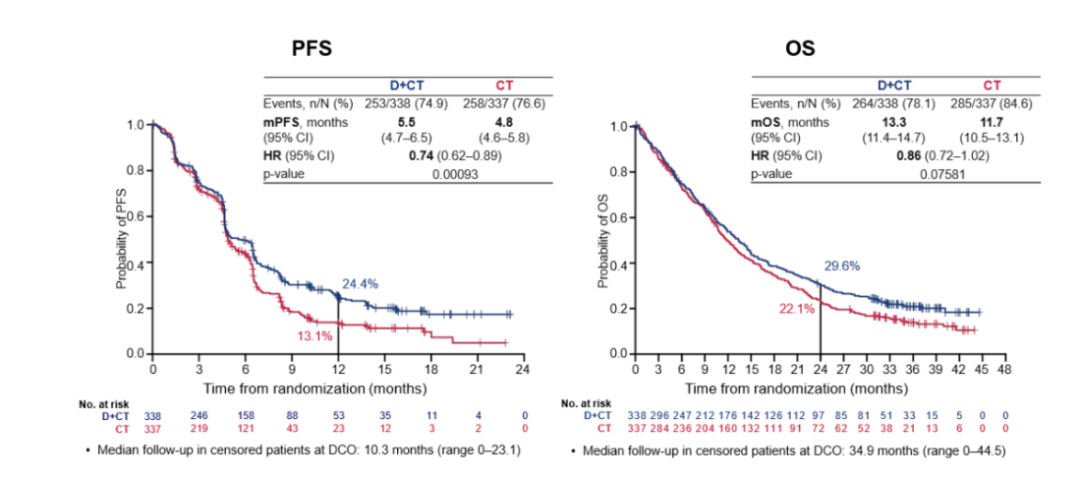
POSEIDON评估无进展生存期(PFS)和总生存期(OS)作为主要终点。与基于铂的化学疗法相比,tremelimumab联合 durvalumab 和基于铂的化学疗法在 OS 方面具有统计学意义和临床意义的改善。
研究结果显示,D+T组中位PFS达5.5个月(95%CI:4.7-6.5),单纯化疗组中位PFS为4.8个月(95%CI:4.6-5.8个月)。D+T组和单纯化疗组中位OS分别为13.3个月(95%CI:11.4-14.7)和11.7个月(95%CI:10.5-13.1个月)。
最常见的不良反应(发生在 ≥ 20% 的患者中)是恶心、疲劳、食欲下降、肌肉骨骼疼痛、皮疹和腹泻。3 级或 4 级实验室异常(≥ 10%)是中性粒细胞减少、贫血、白细胞减少、淋巴细胞减少、脂肪酶升高、低钠血症和血小板减少。
03
K+Y:KEYNOTE-598
2021年1月29日,在第21届世界肺癌大会(WCLC)上, 默沙东首次公布了III期研究KEYNOTE-598的结果。KEYNOTE-598 (NCT03302234)研究是一项随机、双盲、III期临床研究,旨在评估K药联合Y药vs. K药单药一线治疗转移性非小细胞肺癌(EGFR或ALK阴性,且TPS≥50%)患者的疗效。共同主要终点为OS和PFS,次要终点包括客观缓解率(ORR)、缓解持续时间(DOR)和安全性。
与单药治疗相比,联合用药组未能改善OS或PFS,但毒性却在增加。具体数据如下:
结果显示联合治疗组vs.单药治疗组mOS分别为21.4个月和21.9个月(HR=1.08,p=0.74);
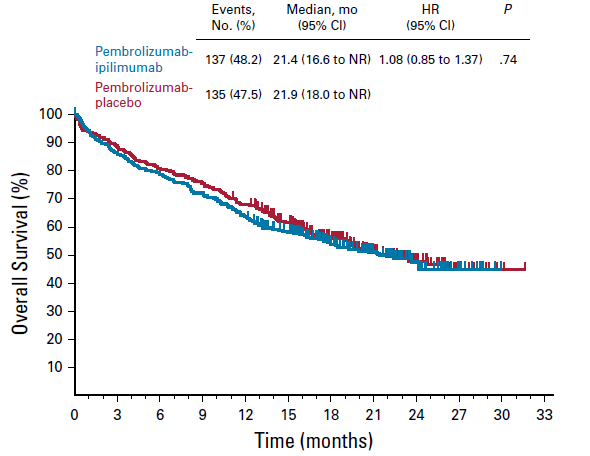
mPFS分别为8.2个月和8.4个月(HR=1.06,p= 0.72);
中位DOR分别为16.1个月和17.3个月;
两组的ORR 均为45.4%。
TRAEs发生率为76.2% 和68.3%;
3~5级TRAEs发生率分别为35.1% 和19.6% 。
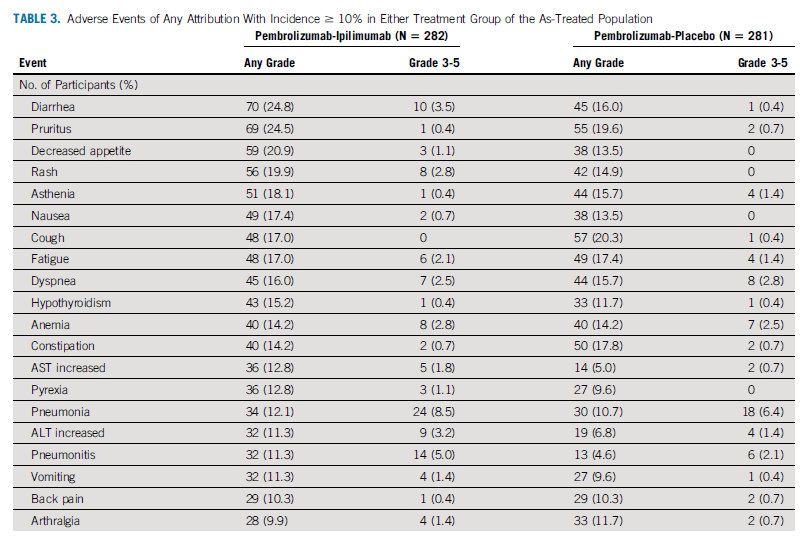
晚期非小细胞肺癌 PD-L1 TPS表达≥50%的人群,是免疫治疗潜在获益极高的人群,Keynote-024的成功为这部分人群的治疗开启新纪元,树立了望尘莫及26.3个月长生存新标准。K药已用在合适的人身上,这时候再做联合以期进一步提高疗效,结果可能差强人意。在CheckMate-227研究Part1中已经发现,“O+Y”的双免联合治疗模式的疗效似乎与PD-L1表达相关性并不明显,无论PD-L1表达如何双免联合治疗均可获益且获益明确。Keynote-598选择了PD-L1≥50%高表达人群,O+Y,D+T则是PD-L1≥1%的人群。Keynote-598的结果只能说明K+Y在PD-L1≥50%高表达人群中不能获益。
对于晚期肺癌一线方案的选择,目前的探索包括 IO 单药疗法、PD-1/PD-L1+CTLA-4、PD-1/PD-L1+化疗、PD-1/PD-L1+CTLA-4+化疗、PD-1/PD-L1+化疗+抗血管生成药物等多种模式,如何进行治疗方案的选择,哪类患者才是优势人群,不同的治疗方案是否具有各自的优势人群等一些列相关问题值得临床思考。
声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。
本文版权归找药宝典所有,任何个人或机构转载需获得找药宝典授权,在授权范围内使用,并标注来源“找药宝典”。
媒体合作请联系:zhaoyaobaodian01


点击“阅读原文”,报名参加临床试验
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言