从RAR介导的信号传递角度 探讨糖尿病心肌病成因
2010-12-02 MedSci原创 MedSci原创
糖尿病心肌病(DCM)是由糖尿病引起的、以左室舒张和(或)收缩功能障碍为表现的心肌病变,且与高血压性心脏病、冠状动脉粥样硬化性心脏病、心脏瓣膜病及其他心脏病变无关。该疾病在代谢紊乱及微血管病变的基础上引发心肌广泛灶性坏死,出现亚临床心功能异常,最终进展为心力衰竭、心律失常及心源性休克,重症患者甚至发生猝死。 潘静, 美国心脏学会(AHA)、美国糖尿病学会(ADA)会员,美国得克萨斯A&
糖尿病心肌病(DCM)是由糖尿病引起的、以左室舒张和(或)收缩功能障碍为表现的心肌病变,且与高血压性心脏病、冠状动脉粥样硬化性心脏病、心脏瓣膜病及其他心脏病变无关。该疾病在代谢紊乱及微血管病变的基础上引发心肌广泛灶性坏死,出现亚临床心功能异常,最终进展为心力衰竭、心律失常及心源性休克,重症患者甚至发生猝死。

潘静, 美国心脏学会(AHA)、美国糖尿病学会(ADA)会员,美国得克萨斯A&M大学医学部助理教授。主要研究方向为病理性心肌肥厚和糖尿病心肌病的分子机制。主要学术贡献包括:①首先发现并阐明了JAK/STAT、 Rho GTPase 和 PKC介导的信号传递通路参与调节血管紧张素和压力负荷引起的心肌肥厚机制;②首次报告维甲酸受体的激活能抑制血管紧张素和压力负荷引起的心肌重构,抑制高血糖诱导的心肌细胞凋亡;③揭示维甲酸受体的活化与负性调节肾素-血管紧张素系统的表达是调节糖尿病心肌病的重要机制。在国际知名期刊上发表论文30 余篇,多项研究项目得到AHA和NIH的资助。
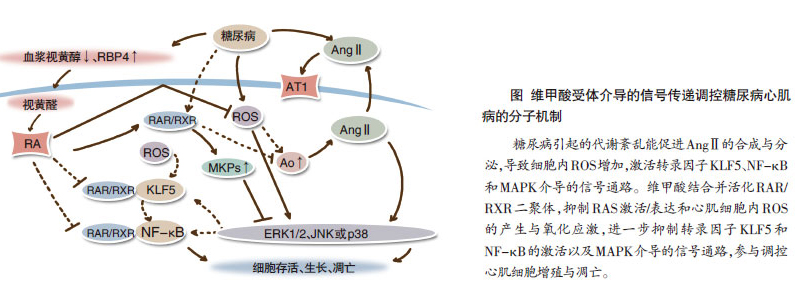
DCM发病机制复杂,目前认为,糖尿病特有的代谢异常(如高血糖、高甘油三脂和高非脂化脂肪酸等),能导致细胞内钙稳态失衡、蛋白激酶 C(PKC)和肾素-血管紧张素系统(RAS)激活、细胞因子(如转化生长因子β1和肿瘤坏死因子等)分泌增加及氧化应激等,在心肌结构与功能改变中发挥重要作用。
RA及其受体介导的信号传递系统
维甲酸(RA)是维生素A的衍生物,也是调节细胞增殖、分化、成熟,维持机体正常发育和各种生理活动必不可少的重要因子。因羧基方向不同,RA 分为两种异构体,即全反式维甲酸(ATRA)和顺式维甲酸(cis-RA)。RA的生物活性由核内可被配体饱和的维甲酸受体(RAR)及维甲酸X受体(RXR)激活来介导。RAR和RXR均属于核配体激活的转录调节因子超家族,这些核受体家族还包括过氧化物酶体增殖物激活受体(PPAR)、甲状腺激素受体(ThR)和维生素D3受体(VD3R)等。两个受体又分为α、β、γ三种受体亚型。ATRA和9-cis RA能激活RAR,但仅有9-cis RA能结合并激活RXR。
RAR及RXR可形成异二聚体、同二聚体,或RXR与其他核受体结合形成异二聚体(如RXR与PPARs,RXR与VD3R)。被激活的二聚体进一步结合于RA靶基因的RA反应元件(RARE),从而调控基因的转录和表达。RA活化的RAR/RXR二聚体正性或负性调节其他信号途径介导的基因激活。
RAR介导的信号传递与心肌病变
通过转基因小鼠的研究证实,RARα和RXRα突变可引起心肌结构及冠状动脉形成异常。虽然RA对胚胎期心脏的正常发育产生非常重要的影响,但是RAR和RXR介导的信号传递在病理刺激下导致心肌细胞增殖、分化和细胞凋亡过程中的作用与机制尚未明 确。
我们的研究利用原代培养的新生大鼠心肌细胞首次提出并证明,ATRA抑制血管紧张素Ⅱ(AngⅡ)和压力负荷诱导的心肌细胞肥大,并进一步阐明了ATRA的作用机制。ATRA活化的RAR/RXR二聚体,可促使丝裂原活化蛋白激酶磷酸酶(MKP)-1和MKP-2在心肌细胞的蛋白表达。MKP- 1和MKP-2通过使活化的丝裂原活化蛋白激酶(MAPKs)去磷酸化来促使MAPKs失活,从而参与对心肌肥大反应的调节。ATRA对AngⅡ和压力负荷诱导的心肌细胞凋亡也有明显抑制作用。ATRA通过抑制心肌细胞内活性氧(ROS)产生,减少氧化应激反应,从而改善心肌细胞线粒体功能,抑制和细胞凋亡相关的调控基因蛋白(如Bcl-2和Bax等)的表达,并阻断细胞凋亡的发生。
我们利用腹主动脉缩窄大鼠心肌肥厚模型,进一步探讨了ATRA对心肌重构的影响,并证实了ATRA能抑制压力负荷引起的心肌重构(心肌肥厚、心肌纤维化和心肌细胞凋亡)和心力衰竭。ATRA通过调控MAPKs(ERK、JNK和p38)的活性和心肌氧化应激反应来抑制心肌重构。
此外,我们还首次证明,ATRA负性调节压力负荷诱导的心肌RAS激活和基因表达。
RAR介导的信号传递与DCM
最初的研究显示,1型糖尿病患者(尤其是血糖控制不理想者)血清RA水平明显降低,2型糖尿病患者血清RA水平虽正常,但血液视黄醇结合蛋白(RBP4)水平明显升高。RBP4是由脂肪细胞释放的蛋白物质,其水平升高可削弱肌肉组织中胰岛素信号通路,阻遏葡萄糖转运,并干扰胰岛素对肝脏葡萄糖生成的抑制作用,从而导致胰岛素抵抗,最终造成血糖升高。此后的研究证实,RXR与PPAR形成的二聚体被配体激活后,能明显增加2型糖尿病患者肌肉内胰岛素受体底物2(IRS-2)和磷脂酰肌醇3(PI3K)的mRNA表达,并增加胰岛素激活的PI3K活性及蛋白激酶B(PKB)的磷酸化,提示骨骼肌中 PPAR/RXR二聚体激活能直接影响骨骼肌胰岛素信号转导通路,改善胰岛素敏感性。这些研究提供了充分证据表明,RAR介导的信号传递在糖尿病发生过程中的重要意义。
我们最近的研究表明,高血糖能减少心肌细胞内RARα和RXRα的基因及蛋白表达。选择性RARα和RXRα激动剂能抑制高血糖诱导的心肌细胞凋亡,并减少氧化应激反应。研究表明,RAR/RXR信号传递系统的激活能抑制高血糖诱导的IκB激酶(IKK)和IκB的磷酸化,以及IκB的降解,从而抑制心肌细胞中核因子(NF)κB的转录活性及其调控的细胞凋亡。高血糖刺激krupple样因子-5(KLF5)在心肌细胞核的蛋白表达,后者是 KLF家族中与胚胎发育、细胞分化和增殖密切相关的转录因子。KLF5参与调控心肌细胞内NF-κB的转录活性,而ATRA能明显抑制KLF5介导的细胞效应。应用siRNA技术沉默RARα和RXRα在心肌细胞的表达,可进一步促进高血糖诱导的心肌细胞凋亡,表明RAR介导的信号传递是调节DCM的重要环节。
RAS激活参与了DCM的发病机制,应用血管紧张素受体拮抗剂(ARB)或ACEI来阻断RAS激活能明显改善DCM病情与预后。我们在研究中发现,激活RARα和RXRα能不同程度负性调节高血糖诱导的心肌RAS的基因表达,提示在糖尿病并发症治疗过程中,RA或能作为糖尿病新药用于控制2型糖尿病进展。此外,RA与ARB或ACEI联合使用,或能改善因RAS激活而诱发的各器官病变。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肌病#
40