全球第三款RNAi疗法lumasiran即将获批,治疗罕见肝病——1型原发性高草酸尿症
2020-10-27 MedSci MedSci
20余年历程,RNAi疗法的时代正在逐步到来。最近,
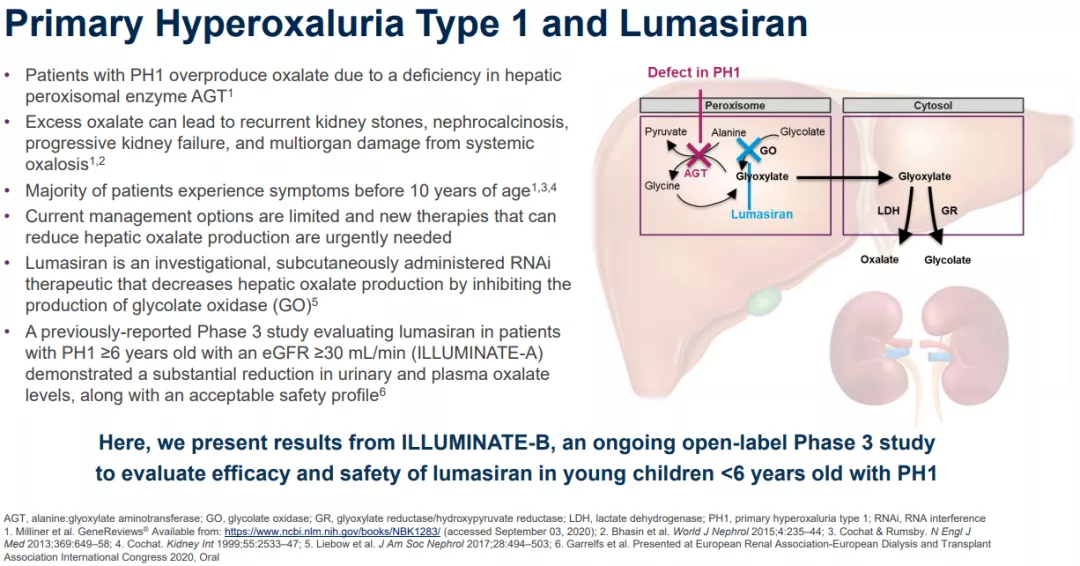
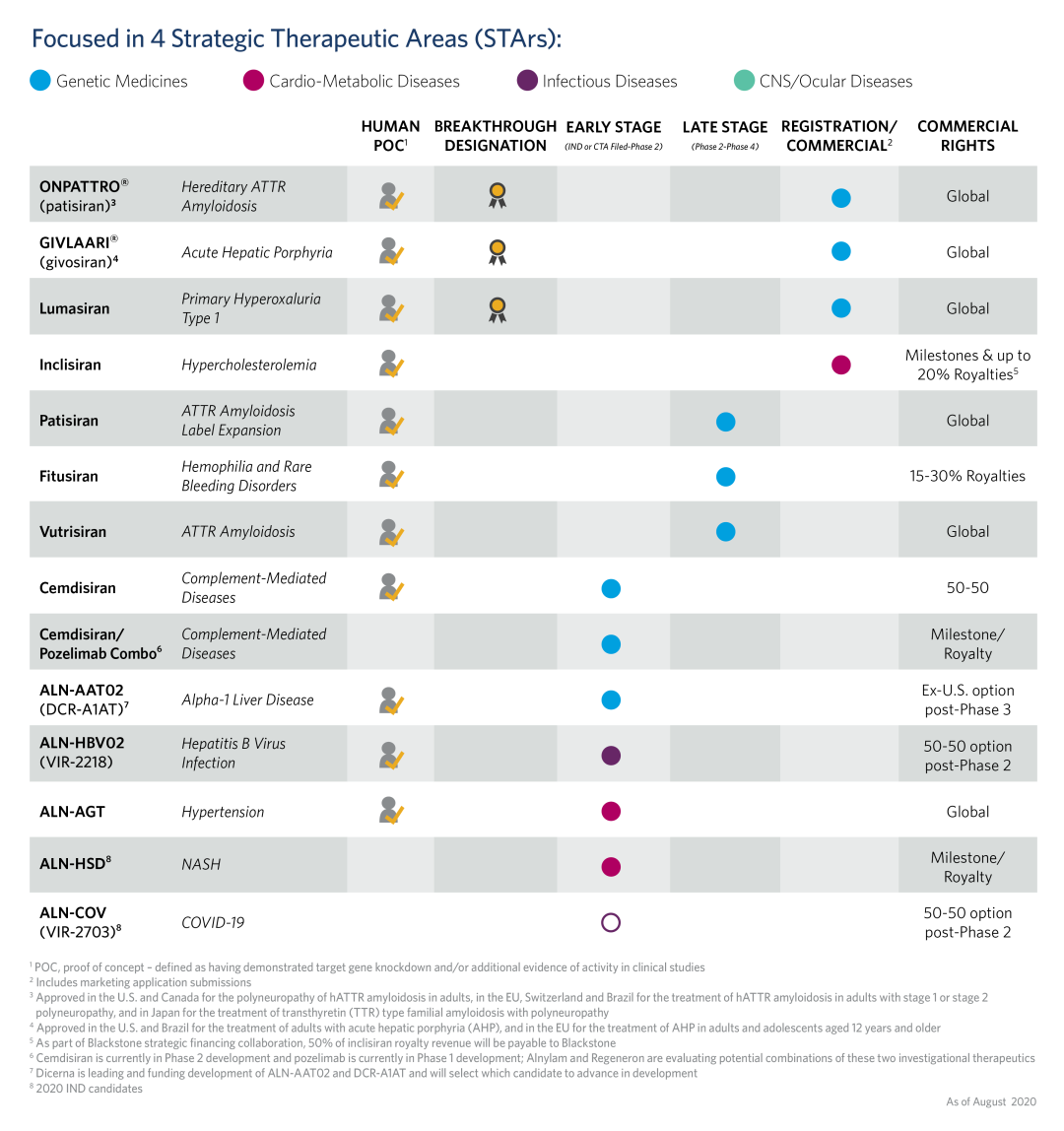
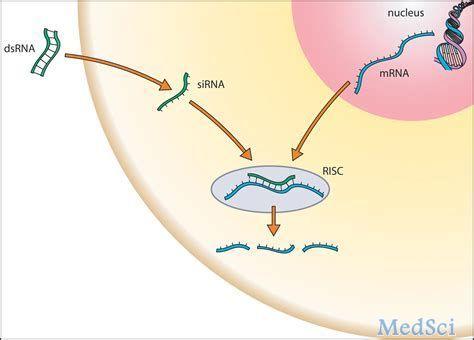
1型原发性高草酸尿症(PH1)是一种罕见肝病,其特征是草酸盐生成过多,可导致晚期肾病(ESRD)和其他系统性并发症。在欧美地区,每百万人口中3.5至4人为PH1。疾病表现的异质性通常会导致诊断延迟,诊断的平均时间约为六年。PH1通常在儿童期发病,会导致进行性和不可预测的肾脏损害、患者面临着反复和痛苦的结石事件,最终导致终末期肾病,需要进行强化透析,直到他们有能力接受肝/肾双重移植。 lumasiran是一种皮下注射的RNAi疗法,靶向羟基酸氧化酶1(HAO1)的mRNA,HAO1基因编码肝脏中乙醇酸氧化酶(GO);通过沉默HAO1基因降低GO酶的表达,lumasiran可抑制肝脏中草酸的产生并使其正常化,从而阻止PH1疾病的进展。 FDA已批准该项NDA的优先审查,并根据《处方药使用者费用法案》(PDUFA)将审批日期定为2020年12月3日。药物亦于10月16日收到了欧洲药品管理局(EMA)的人类药用产品委员会(CHMP)的积极意见。 lumasiran作用机制 △lumasiran(商品名:Oxlumo®)作用机制 Alnylam最新公布的数据显示:lumasiran在对6岁以下3个月以上的儿童进行的LIGNINE-B III期临床研究中,尿草酸平均减少了72%,肾钙沉着症有所改善(8/18,44.4%),研究发现,lumasiran的疗效、结果和安全性与在6岁及以上的成人和儿童中观察到的相似(LIGNINE-A)。 Alnylam还公布了项目LIGNINATE-A的12个月延长期数据更新—关键研究显示了尿草酸水平从基线水平降低并保持稳定,以及患者的肾结石发生率降低的证据; 正在进行的II期开放标签延伸研究的长期结果,为尿草酸水平的持续降低和可接受的安全性提供了额外的证据。 此前两款RNAi类药物,同样是Alnylam Pharmaceuticals (Nasdaq: ALNY)研发的。该公司是RNAi疗法开发领域内公认的领导者;核酸干扰(RNAi)是一种天然的基因沉默现象,是当今生物学和药物开发领域最有前途和发展最迅速的前沿RNA疗法之一。 第一个被审批的药物是Onpattro®(patisiran,静脉制剂),于2018年8月获批,成为RNAi现象被发现整整20年以来获准上市的首款RNAi药物,用于治疗遗传性甲状腺素蛋白淀粉样变性(hATTR)引起的神经性损伤。 △Onpattro® 第二款RNAi药物Givlaari®(givosiran,皮下制剂)于2019年11月获批,治疗成人急性肝卟啉症(AHP),同时也是GalNAc偶联RNAi疗法的全球首次批准,标志着精准基因药物开发的一个重大里程碑。 △Givlaari® RNAi疗法的领导者 △Alnylam首席执行官John Maraganore Alnylam目前已经获得包含诺华、赛诺菲、黑石在内多方的注资与合作。正领导并致力于将核算干扰(RNAi)转化为一类全新的创新药物,有可能改变罹患罕见遗传疾病、心脏代谢疾病、肝脏感染,以及中枢神经系统(CNS)/眼部疾病患者的生活。 到2025年,Alnylam希望成为拥有超过8款获批疗法,十多个后期研发项目的全球五大独立生物技术公司之一。 Alnylam研发管线 信息源: 1、alnylam丨Alnylam Presents Positive Results from ILLUMINATE-B Phase 3 Study in Pediatric Patients with Primary Hyperoxaluria Type 1 at the American Society of Nephrology Kidney Week;Oct 22, 2020 2、fiercepharma丨Alnylam makes case for lumasiran in infants ahead of FDA ruling;Oct 23, 2020 3、Endpts丨With lumasiran on the FDA's doorstep, Alnylam reads out new PhIII data in PH1;Oct 22, 2020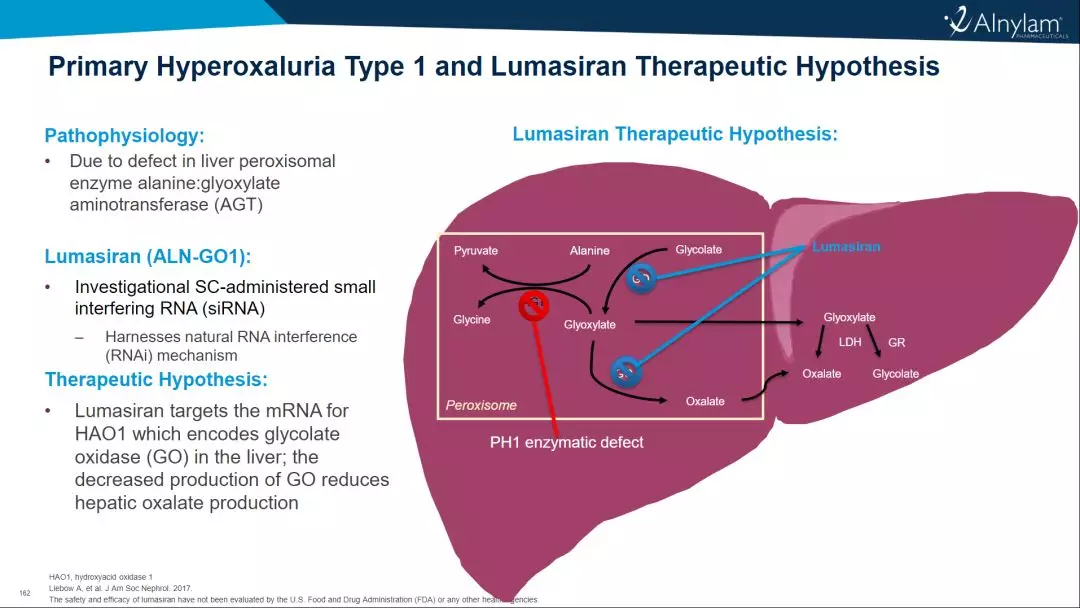


本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#原发性#
36
#RNAi#
43
好文章,为了积分!
77
#罕见#
43
#RNAi疗法Lumasiran#
32
𓀀
74
很重要
80
治疗新方向
87
学习!
92
学习了
27