2011年第三季度FDA批准的部分新药
2011-10-09 网络 中国医学论坛网
2011年第三季度以来,美国食品与药物管理局(FDA)批准的新产品涵盖了肿瘤科、心血管科、疫苗研发以及罕见病治疗等诸多领域。 与前两个季度不同的是,除了新批准的治疗性药物,还包括了与其配套的诊断性试验,如批准了Xalkori (crizotinib)治疗某些有局部晚期或转移性非小细胞肺癌患者,与其配套的诊断性试验Vysis ALK分离FISH探针检测盒一同获准,有助于确定病人
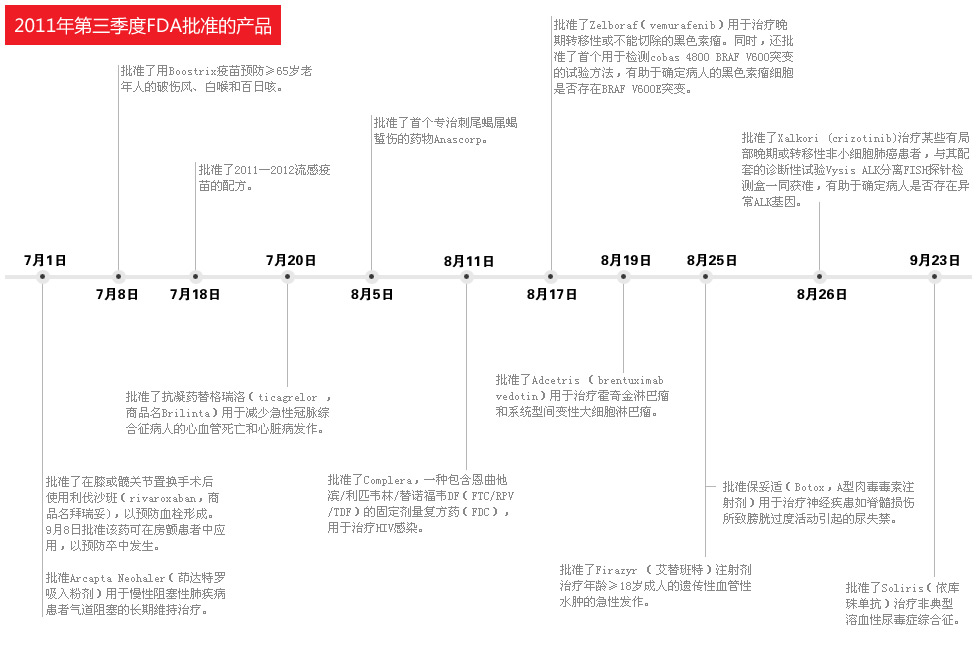
2011年第三季度以来,美国食品与药物管理局(FDA)批准的新产品涵盖了肿瘤科、心血管科、疫苗研发以及罕见病治疗等诸多领域。
与前两个季度不同的是,除了新批准的治疗性药物,还包括了与其配套的诊断性试验,如批准了Xalkori (crizotinib)治疗某些有局部晚期或转移性非小细胞肺癌患者,与其配套的诊断性试验Vysis ALK分离FISH探针检测盒一同获准,有助于确定病人是否存在异常ALK基因;还批准了 Zelboraf(vemurafenib)用于治疗晚期转移性或不能切除的黑色素瘤,相应的首个用于检测cobas 4800 BRAF V600突变的试验方法一同获准,有助于确定病人的黑色素瘤细胞是否存在BRAF V600E突变。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#FDA批准#
27