胎儿宫内巨细胞病毒感染1例报道
2020-03-30 陈晓旭 高劲松 宋英娜 生殖医学杂志
胎儿巨细胞病毒(Cytomegalovirus,CMV)感染是最常见的先天性感染。孕早期感染的致畸率及致残率高,给家庭及社会带来严重的心理、经济负担。
胎儿巨细胞病毒(Cytomegalovirus,CMV)感染是最常见的先天性感染。孕早期感染的致畸率及致残率高,给家庭及社会带来严重的心理、经济负担。2008年至2015年北京地区巨细胞病毒IgG抗体阳性率89.1%~94.9%,IgM抗体阳性率0.7%~1.7%。TORCH筛查应用范围较广,但有时由于IgM持续久等原因使得筛查结果难以判断,导致误诊和漏诊。同时CMV感染胎儿的临床表现缺乏特异性,超声异常时往往仅行遗传学分析而忽略胎儿宫内感染的排查。因此目前在我国,对胎儿宫内CMV感染的临床认识普遍不足,临床医生对胎儿宫内感染的诊治缺乏经验。现将我院诊断的1例胎儿宫内感染CMV病例进行报道和分析。
一、病例资料
患者女,28岁,G1P0。自然怀孕,既往体健,无家族遗传病史,孕期无发热等不适,血压、血尿常规、肝肾功、血糖均正常,无创胎儿DNA筛查(NIPT)低风险。孕22周外院系统超声提示胎儿宫内生长受限(FGR,<10%),转来我院会诊。24周+5我院超声显示:胎儿各径线均小于正常胎龄儿,相当于22周+3,估计胎儿体重485g(<1%),胎儿各脏器及羊水量未见异常,脐动脉S/D3.8。母血抗核抗体(ANA)、dsDNA、抗磷脂抗体谱(ACL、LA、B2GP1)均正常。于孕28周+3因FGR行脐血穿刺,染色核型分析及SNP-array(Cytoscan750K)均未见异常,脐带血TORCH检测CMVIgM可疑,RV、TOX、HSV均阴性。查母血CMVIgG(+),IgM(-),母血及尿CMV-DNA(-)(<500copies/ml)。孕31周+4复查B超提示:胎儿均小,相当于26周+6(估计体重1040g,<1%),可见颅内大小不等的强回声,心脏及肝脏增大,羊水4.5cm,脐动脉S/D4.0(图1)。因考虑宫内感染可能性大,再次行羊水穿刺,羊水CMV-DNA:6.6×107copies/ml。诊断胎儿宫内CMV感染。孕32周回外院引产,胎盘病理提示:胎膜中度急性炎症,胎盘绒毛膜板下可见中等量中性粒细胞浸润,底板蜕膜层可见淋巴细胞、浆细胞浸润。颅内见多个大小不等的强回声,无声影,主要沿脑室壁分布,最大位于近场右侧侧脑前角旁,直径0.48cm(左图箭头所示),胎儿心脏增大,横径3.1cm,肝脏增大,上下径5.58cm(右图),胎龄相当于26周+6。羊水穿刺确诊胎儿宫内CMV感染。
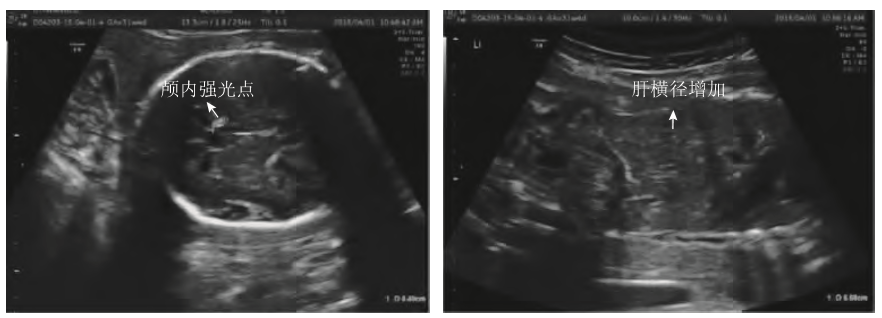
图1孕妇孕31周+4B超检查所示
二、讨论
CMV是一种广泛存在的双链DNA病毒,主要是通过性接触或者直接接触感染者的血液、尿液或者唾液传播,平均潜伏期是28~60d。妊娠期孕妇的免疫力下降,增加了孕妇感染CMV的可能性。有研究表明,妊娠期间机体CMV反应细胞的免疫力下降,从而增加了CMV主动复制及传播的风险[1]。据统计,2016年北京地区2887例孕妇中,血清CMVIgG的阳性率为94.70%,CMVIgM的阳性率为1.28%,IgG阳性率随年龄的增长而升高,而IgM无显著差异;农村比城市多见,秋季发生率最高,CMV垂直传播率为35.71%(5/14)[2]。胎儿宫内垂直传播是CMV母婴传播的主要方式,导致新生儿出现后遗症的风险最大[3]。孕妇原发性CMV感染后,宫内胎儿感染率高达30%~40%,而非原发性CMV感染宫内垂直传播率仅为0.15%~2%,导致胎儿畸形的情况极为少见[4]。胎儿宫内感染CMV,可导致胎儿畸形、早产、死产,出生后也可能夭折或患严重的并发症,其中先天性听力丧失是最严重的后遗症[5]。CMV在妊娠的任何时刻都可以发生,妊娠晚期发生率最高(40%~70%),但妊娠早期发生CMV感染更容易导致胎儿的严重并发症[6]。CMV感染通常无明显症状,小部分原发感染患者可表现为轻度发热和其他非特异性症状(鼻炎、咽炎、肌痛、关节痛、头痛和乏力)。妊娠期母体CMV感染主要借助于血清学诊断,以往血清学阴性的孕妇出现特异性抗体IgM和IgG或IgG抗体滴度4倍以上增加可诊断,也可通过IgG亲和力区分原发性感染和继发性感染。除了以上血清学方法外,还可以通过感染者的血液、尿液、唾液、宫颈分泌物或乳汁进行病毒培养或者聚合酶链反应(PCR)进行诊断。当诊断母体存在CMV感染或B超提示可疑胎儿异常后,需进一步评估是否存在胎儿宫内感染。胎儿宫内感染的超声表现包括:胎儿腹部及肝脏钙化、肝脾肿大、肠管及肾脏回声增强、腹水、脑室增宽、颅内钙化、小头畸形、胎儿水肿及生长受限等,但都不具有特异性[7]。羊水病毒检查是诊断胎儿先天性感染最准确的方法,由于病毒感染胎盘胎儿并在胎儿体内复制经肾脏排出需要约5~7周时间,因此应在妊娠21周后或孕妇确定感染7周后行羊水穿刺,利用羊水培养CMV病毒或者PCR检测CMVDNA。不推荐经脐血检测CMV,因为脐血IgM及PCR的灵敏度降低[8]。回顾本文病例,该患者孕中期行B超检查,胎儿各径线均小于正常胎龄儿,余指标无明显异常,后密切随诊,脐血CMV-DNA(-),母血CMVIgG(+),而后复查B超胎儿仍为均小儿,且肝脏及心脏异常,羊水穿刺发现CMV-DNA(+),而后终止妊娠。因此明确CMV宫内感染需要密切观察,比如B超提示异常、母体血或脐带血检验结果异常,后需要进一步羊水穿刺,明确诊断,从而尽快决定是否终止妊娠。当诊断出胎儿先天性感染CMV病毒后,如何选择下一步治疗方案始终没有统一的结论。B超或MRI提示胎儿严重脑损伤对选择是否继续妊娠有重要意义,也是临床医生评价胎儿预后的重要指标,但超声正常也不能保证胎儿一定正常,尤其是远期结局。国外1篇多中心14年的回顾性分析,纳入了15名经羊穿确诊的胎儿先天性CMV感染的孕妇,终止妊娠组中B超或MRI显示胎儿脑损伤的占比更大,继续妊娠组中有4名孕妇脐带血CMV阳性,其中2名有严重的脑部及听力损伤[9]。目前还没有治疗先天性CMV感染的有效手段。有研究表明抗病毒药物有可能治疗胎儿宫内感染,4名孕妇确诊原发性CMV感染后给予更昔洛韦治疗,新生儿均未表现后遗症;5例确诊新生儿先天性感染后给予缬昔洛韦,后代无明显后遗症[10],但因病例报道数量较少,仍需更大规模的研究来评估这种治疗干预和长期效果。对于出生后发现听力障碍的新生儿使用更昔洛韦连续治疗6周,6个月内症状改善,但随着时间的推移,效果逐渐减弱[11]。而用缬昔洛韦治疗症状性先天性CMV感染6个月,与治疗6周者相比,短期内没有改善听力,但在较长时间内听力和发育结果似乎略有改善[12]。还有研究指出可以使用免疫球蛋白被动免疫治疗孕妇原发性CMV感染。2005年一项在意大利进行的前瞻性研究中,共45名羊水中检测出CMV的孕妇为治疗组,其中31名静脉使用超免疫球蛋白200U/kg治疗,14名选择保守观察;84名血清学显示CMV原发性感染的孕妇为预防组,其中37名静脉给予超免疫球蛋白100U/kg,47名选择保守观察。结局显示:两组中使用超免疫球蛋白治疗或预防的新生儿中患先天性CMV感染的比例小于未接受治疗组,差异具有统计学意义,说明超免疫球蛋白可以增加体内IgG的浓度和亲和力,降低自然杀伤细胞及HLA-DR+的数量,且无明显不良反应[13]。但2014年同样在意大利进行的一项前瞻性双盲随机实验却推翻了这一结论,共有124名(期间1名孕妇退出)满足5~26周原发性感染CMV的孕妇纳入了该研究,随机分为治疗组和对照组,治疗组一旦确诊后每4周给予超免疫球蛋白直至36周或羊水中监测出CMV,而对照组给予安慰剂,结果显示两组新生儿患先天性CMV感染的概率无明显统计学差异[14]。因此仍需要大规模的临床试验去验证免疫球蛋白的安全性及有效性。目前专家共识不推荐常规进行孕妇血清学CMV筛查,也不推荐使用抗病毒治疗以及免疫球蛋白预防或治疗CMV感染。当母体确诊CMV感染时,推荐转诊至有产前诊断资质的医疗机构进行进一步评估,并应充分告知患者及家属病情及继续妊娠的利与弊,以决定下一步诊疗方案[6]。对于CMV感染的预防,也是目前产前宣教的重点。有研究表明,长期进行儿童保健工作或者经常在家照顾幼童的孕妇、文化教育程度低、低收入、不是本地居民的孕妇在孕期容易出现血清转化,应将这类人群视为高危人群,孕期密切随访[15-16]。也有专家建议,应该进行孕妇手卫生的教育,接触婴儿尿布、唾液或其他体液时及时洗手,当幼儿确诊CMV感染时,应避免与其共用餐具[6]。目前已有CMV特异性高免疫球蛋白(HIG)预防先天性CMV感染及疾病的动物及人类妊娠研究,商用HIG是由具有高抗CMV抗体活性和滴度的供体血浆制造的,但尚需要多中心大规模的临床试验进一步证实它的作用,当超声提示胎儿有严重的颅脑或躯体部位损伤,羊水可检测出CMV,那么注射免疫球蛋白治疗可以作为一种选择[17-18]。我国孕产妇基数大,各地医疗水平、卫生条件及经济状况也不尽相同,感染巨细胞病毒的孕妇数量不容小觑,临床医生及医务工作者应及时发现孕妇及胎儿的巨细胞病毒感染,有针对性地进行产前筛查及诊断,以减少胎儿不良结局的发生。
参考文献略。
原始出处:
陈晓旭,高劲松,宋英娜,欧阳云淑等,胎儿宫内巨细胞病毒感染1例报道及文献复习[J],生殖医学杂志,2020,29(3).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#巨细胞#
42