Science:特刊综述:工程化细菌,癌症新疗法
2022-12-06 精准药物 精准药物 发表于上海
越来越多的证据表明,微生物具有肿瘤定植能力。因此,合成生物学工具被人们用来改造细菌,将其用作新的肿瘤特异性递送系统。

越来越多的证据表明,微生物具有肿瘤定植能力。因此,合成生物学工具被人们用来改造细菌,将其用作新的肿瘤特异性递送系统。工程化细菌可以通过自身固有的免疫原性以及局部释放有效载荷,来调节肿瘤的免疫微环境。在此,本文主要综述了增强治疗性细菌的空间和时间控制的遗传回路,以提高其安全性和有效性。作者描述了细菌、肿瘤细胞和免疫细胞之间相互作用极其工程化改造,以及以细菌作为治疗手段的进展,包括从细菌作为单一制剂到其与各种组分之间的合理结合。总之,研究人员正在建立一个新兴的治疗性概念,将推动建立利用合成生物学在可编程药物之间进行工程化交互作用的新领域。
早在 19世纪,细菌就被确定为潜在的癌症治疗方法。当时,免疫治疗先驱 William Coley 在注射化脓性链球菌(Streptococcus pyogenes)和黏质沙雷氏菌(Serratia marcescens)的患者中,观察到了肿瘤消退的证据。尽管当时还不知道,细菌是通过其固有的免疫刺激作用,引发了针对肿瘤的免疫反应。此外,细菌也倾向于在缺氧和免疫抑制肿瘤微环境 (TMEs) 中生存。一些属的细菌已被证明具有上述特征,如沙门氏菌(Salmonella),埃希氏菌(Escherichia),梭状芽胞杆菌(Clostridium),双歧杆菌(Bifidobacterium),变形杆菌(Proteus)和乳酸菌(Lactobacillus),因此它们可以被用作肿瘤靶向的运载工具。
经过基因工程化改造,细菌可以编码并局部递送多种有效载荷,包括小分子、毒素、免疫调节剂、前药物转换酶、小干扰 RNA 和纳米颗粒。细菌释放的这些物质可以在肿瘤微环境(TME)中影响肿瘤、免疫、基质、微生物和其他多种细胞类型。此外,细菌及其有效载荷还可以与外部成像技术联合,从而实现细菌的动态检测和实时驱动,例如核磁共振成像 (MRI) 和聚焦超声 (FUS)。
合成生物学让我们能够精确调节细菌与其他细胞的相互作用,从而提高细菌治疗癌症的有效性和安全性。感知-反应基因回路的发展,让细菌可以自主控制其行为,调节其生长的位置和时间,并释放其有效载荷。在这篇综述中,作者重点介绍了鼠伤寒沙门氏菌(Salmonella typhimurium)和大肠杆菌(Escherichia coli)模型系统的工程化进展,并探索如何利用合成基因回路将让细菌更有效地与其他生物和非生物工具相互作用。
01
工程化细菌-肿瘤的交互作用
1.1 肿瘤定位
由于肿瘤具有缺氧和低免疫监视等特性,因此细菌在肿瘤中的富集相比于其他组织可以高出约 10,000 倍。然而,一些菌株也可以在健康的器官中存活或生长,因此需要对细菌进行遗传操作来降低其固有的毒性和内毒素。一个有名的例子是减毒的斑疹伤寒杆菌(S. typhimurium)VNP20009株,它包括 purI 和 msbB 基因的缺失,而这两个基因的缺失分别导致嘌呤营养不良和脂多糖修饰 (LPS)。通过测定 TNF-α 的水平,研究者发现这些修饰显著降低了小鼠体内的全身性炎症反应。在转移性黑色素瘤患者中进行临床评估时,静脉给予 VNP20009 表现出良好的耐受性。但 VNP20009 不能有效定植到肿瘤部位,因为没有提供治疗效益。该案例证明,同时保证细菌疗法的安全性和有效性还面临着严峻的挑战。
提高细菌肿瘤特异性的策略主要是诱变和定向进化。通过这些手段,我们可以筛选出能够在肿瘤中表现出相对生长优势的营养缺陷型菌株,或者与癌细胞黏附增加的菌株。另外,我们也可以改造细菌,让其细胞膜表面展示肿瘤靶向的分子成分,如粘附肽和肿瘤相关抗原。例如,通过将一个减毒的沙门氏菌菌株的精氨酸-甘氨酸-天冬氨酸肽 (RGD)与细菌外膜蛋白A (OmpA) 融合,从而展示出肿瘤归巢肽,通过与肿瘤细胞中广泛高表达的 αvβ3 整合素结合,对肿瘤细胞表现出更强的的粘附效应。
改善细菌的肿瘤趋向性的另一种方法,是利用细菌的生长特性与肿瘤的环境特征 (如高浓度乳酸、低量氧气和低pH值) ,建立两者互相耦合的遗传回路。在这种遗传回路中,细菌生长所必需的基因转录,将由响应肿瘤环境线索的细菌启动子加以控制,从而将细菌的生长限制在肿瘤内部。鉴于其他组织可能也会包含其中的一些信号,因此通过“AND”逻辑门控相结合,遗传回路可以进一步提高了细菌的肿瘤靶向特异性,从而减少细菌突变株的逃逸,实现了更长期的生物遏制。
当细菌进入到肿瘤内部之后,它们可以在肿瘤局部释放靶向特定靶点的多种有效载荷至较高浓度。一些小分子通过微生物和哺乳动物的膜被动扩散或运输到达它们的目标,而其他一些有效载荷(如核酸)则需要在细胞内递送到细胞质或细胞核。此外,一些作用于细胞外受体的蛋白质,则需要被释放到细胞外空间 (图1.A到D)。
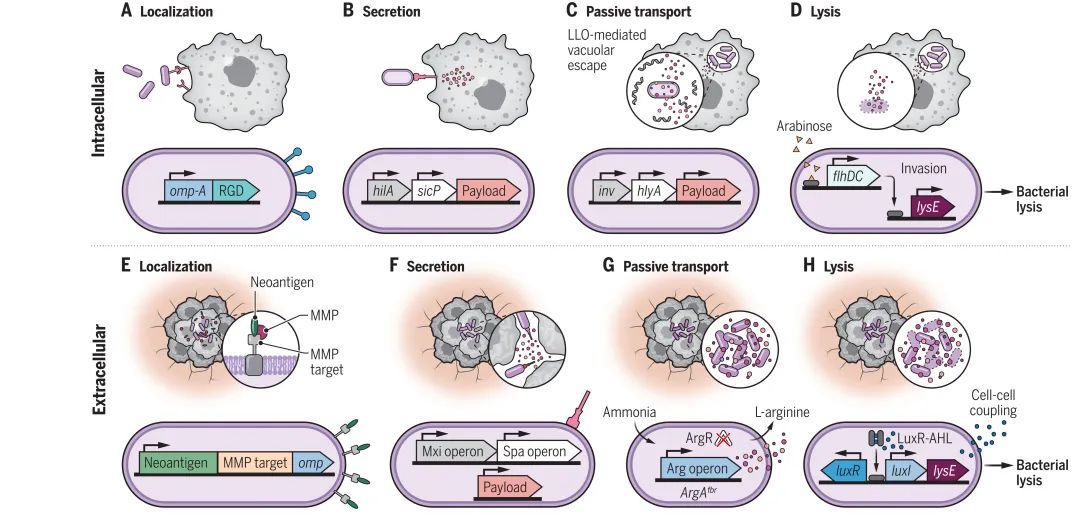
▲图1 || 工程化细菌-肿瘤互作界面
1.2 靶向细胞内空间
长期以来,细胞内递送始终是一个充满挑战的设想。近来,研究者已经开发了多种正交方法来靶向细胞内的靶点,例如病毒和纳米颗粒传递平台。作为一种活的药物,细菌可以实现自主控制,感知和响应内化过程,并随之释放出其内部的载荷。此外,细胞内传递的好处包括,它允许靶向蛋白质和信号通路,而这在传统上是非常具有挑战性的。
鼠伤寒沙门氏菌(S. typhimurium)等具有细胞内生命周期的细菌,已被用于将一系列货物通过其 3型分泌系统 (T3SS) 释放到肿瘤细胞中。T3SS 是革兰氏阴性菌中发现的多种分泌系统之一,其针状复合体使外部细菌的效应蛋白可以直接注入宿主细胞的细胞质中。研究者已经提高了基于 T3SS的大分子胞质传递的效率,包括合成的结合蛋白,如设计锚蛋白重复蛋白 (Designed Ankyrin Repeat Proteins,DARPins ) 和单体(Monobody)。该细菌系统将抑制 RAS 信号通路的多个 DARPins 和单体递送到了人结肠癌细胞的细胞质中,并在体外证实了对 RAS 信号通路功能的抑制。
鼠伤寒沙门氏菌也可被宿主细胞内吞噬到含沙门菌液泡(SCV)中,并 SCV 内进行复制。事实上,沙门氏菌的 T3SS 针状复合体可以穿透 SCV 膜,使细菌蛋白质分泌到宿主细胞质中。然而,一旦细菌被宿主肿瘤细胞内化,这种屏障也限制了额外的细菌内容物通过 SCV 的运输,这就促使我们研究主动裂解细菌和分解 SCV 的新策略。单核增生李斯特菌(Listeriamonocytogenes)和福氏志贺氏菌(Shigella flexneri)等细胞内物种的逃逸策略被调整之后,可使其从液泡的逃逸变得更加高效。具体来说,hlyA 基因编码 listeriolysin-O (LLO),这是一种在单核增生乳杆菌中发现的形成孔的细胞溶解素,它能使细菌质粒和内容物逃逸。此外,由假结核耶尔森菌的 inv 基因编码 的 invasin 可以与存在于许多细胞系上的 β1-整合素结合,并促进细菌被吞噬体摄入。
合成生物学方法的快速发展,让我们可以在空间和时间上进行更好地控制细菌行为,并调整细菌从液泡的释放。例如,诱导回路可以暂时控制由内化的伤寒链球菌编码的噬菌体衍生的裂解基因的转录,从而导致 SCV 内的细菌细胞裂解。另外,一种减毒的伤寒链球菌菌株 (Δasd VNP20009) 被改造后,可以在感知到肿瘤细胞内环境时自毁。通过将操纵子 flhDC 置于阿拉伯糖诱导回路下调节细菌的运动和入侵。此外,将细菌裂解基因置于一个 SPI-2 启动子的控制下,该启动子在侵入宿主细胞后被激活,并调节其裂解行为。
1.3 靶向细胞外空间
对于肿瘤细胞受体等许多胞外治疗靶点而言,则需要使用细胞外递送方法。一般而言,靶向细胞外分子是比较容易实现的,因为这些传递策略并不特别依赖于细菌与肿瘤细胞的物理接近程度。此外,在肿瘤细胞外的有限空间中,细菌能够生长到较高的密度。随着细菌变得越来越多,它们的有效载荷可以被释放并扩散到整个肿瘤空间,从而有效作用于靶标分子 (图1,E到H)。
细胞外递送策略可以利用非侵入性细菌,如益生菌菌株 E. coli Nissle 1917 (EcN)。EcN 和其他固有的胞外细菌不容易分泌多数蛋白质,因此从细胞质中转移重组蛋白质的就需要依赖信号肽和分泌标签。为了将货物直接输送到哺乳动物细胞中,大肠杆菌也可以被改造成编码志贺菌衍生的3型分泌系统。当在结肠炎的临床前小鼠模型中进行评估时,prot3ect 分泌的抗 TNF-α 纳米抗体与系统输送的抗TNF-α抗体在减轻炎症方面具有类似的疗效。
使用群体感应 (QS) 的遗传回路,可以协调细菌在细胞外肿瘤环境中的行为。因为细菌只能在 TME 中达到较高密度,所以 QS 可以有效地发挥出肿瘤特异性的作用,进而触发重组蛋白的表达。此外,这些系统还可以提供时间控制,其中 QS 参数可以被设置为达到特定密度时才启动特定基因的表达。例如,设计了一个同步裂解回路,使细菌生长并产生 QS 分子酰基高丝氨酸内酯 (AHL)。随着时间的推移,AHL积累到一个阈值浓度并触发裂解事件,进而释放细菌内容物达到一个临界密度。裂解后,少量残留的细菌开始重新产生 AHL,这个过程以循环的方式继续进行,允许在肿瘤内重复递送药物。这种回路已用于释放各种毒素和免疫疗法,包括溶血素E(hlyE)、细胞死亡域RGD整合素肽(CDD-iRGD)、CCL-21和靶向CD47 的纳米抗体、CTLA-4和 PD-L1。此外,在结直肠、黑色素瘤、乳腺和淋巴瘤皮下肿瘤的小鼠中已证实其治疗效果,表明 QS 策略作为释放机制的多功能性。
QS 方法提供了细菌自主性的空间和时间控制,可以将细菌的作用限制在肿瘤内部,并允许持续的治疗性递送。此外,这些回路被调整之后可以让多个有效载荷可以按照预定的剂量方案顺序释放。尽管这还没有在细菌中实现,但在哺乳动物细胞中已经探索了类似的重组回路。当然,基于 QS 的策略也有一定的局限性,例如 QS 依赖于临界细菌密度,而这可能又是依赖于肿瘤体积大小的。
02
重编程免疫系统
将工程化细菌引入宿主所引发的免疫反应是可以预测的,因此我们可以建立细菌-免疫细胞相互作用的反应时间表。细菌具有固有的免疫原性,因为它们对免疫系统而言是外源性的,通过表达激活固有免疫细胞表面的受体和细胞内生物分子,分泌免疫刺激代谢物,以及某些物种注射效应蛋白的能力,使它们能够入侵肿瘤和局部免疫细胞。当细菌的裂解产物在坏死的肿瘤核心释放,或当细胞和体液免疫成分杀死和吞噬细菌时,细菌的免疫刺激效应就会增强。除了这些固有的免疫刺激特性外,合成生物学技术还可以用于工程化细菌,使其能够靶向抗肿瘤免疫反应的特定步骤,从而与细菌诱导的固有免疫激活产生协同效应,进而提高细菌癌症治疗在多种肿瘤类型中的疗效 (图2)。
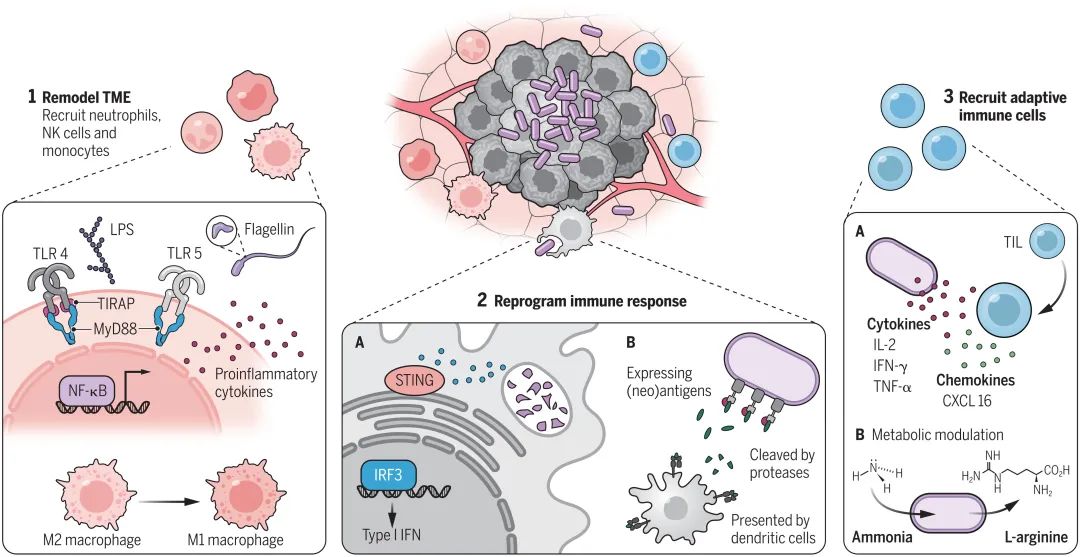
▲图2 || 工程化细菌-免疫交互界面
2.1 重编程固有免疫系统
在细菌定植及进行瘤内增殖的早期阶段,细菌的衍生物可以作为免疫佐剂,刺激单核细胞、巨噬细胞和中性粒细胞的招募和激活。这些固有免疫细胞参与肿瘤定植菌的裂解和清除(通过吞噬作用),当它们通过 TLRs 检测到细菌成分时,就会产生炎症细胞因子。经过工程化改造,一种减毒的斑疹伤寒杆菌可以产生并分泌来自创伤弧菌的鞭毛蛋白 FlaB,创伤弧菌的 FlaB 在激活固有免疫方面比沙门氏菌原生的鞭毛蛋白更有效。这种工程化鼠伤寒杆菌菌株可以协同激活 TLR4 和 TLR5 以刺激固有免疫反应,其中 TLR4 识别鼠伤寒杆菌 LPS,而 TLR5 则识别分泌的 flaB。识别斑疹伤寒杆菌的 LPS 诱导单核细胞、巨噬细胞和中性粒细胞渗入TME,这些细胞与它们通过 TLR4 识别 LPS 结合,可能通过 TLR5 检测 FlaB,并支持观察到的 M2 样巨噬细胞(原体) 转变为 M1样巨噬细胞 (抗肿瘤) ,同时增加了抗肿瘤细胞因子 IL-1β 和 TNF-α 的分泌。该系统在小鼠和人类结肠癌模型中的测试表明,只有当细菌被改造为分泌 FlaB 时,才会延迟原发肿瘤的生长和抑制转移。这两种成分的效应表明,细菌通过编码特定的有效载荷,可以对免疫系统功能产生独特而有效的影响。
随着固有免疫反应的持续激活,抗原递呈细胞 (APCs) 将进入肿瘤,并可能吞噬死亡的肿瘤细胞和瘤内细菌,从而提供进一步的相互作用,并可以精确调节增强抗肿瘤反应。例如,EcN可以被设计用于递送 STING 激动剂,如产生循环二磷酸腺苷 (CDA) 的酶,并在肿瘤内的 APCs 中被动释放其负载。SYNB1891 菌株被 APC 吞噬后可将其编码的 CDA直接传递到 APC,并诱导 I 型干扰素 (IFN-I) 反应。结合细菌介导的促炎细胞因子所产生的益处,STING 激动剂的递送在多种小鼠肿瘤模型中诱导了持久的抗肿瘤免疫和肿瘤消退。目前,SYNB1891 正在晚期实体瘤和淋巴瘤患者的 1期临床试验评估 (NCT04167137) 。类似地,另一种处于临床开发中的菌株 STACT (鼠伤寒杆菌减毒癌症疗法) 被设计为编码一种三素修复外切酶1(TREX-1)抑制剂。通过类似的机制,STACT 菌株可在被肿瘤驻留 APCs 摄取后激活 STING 通路。
2.2 重编程适应性免疫
当 APC 吞噬细胞碎片时,它们可以递呈新抗原并刺激适应性免疫反应。基于李斯特菌的方法通常用于递送细胞内的有效载荷,包括肿瘤抗原。单核增生乳杆菌因其对 APC 的偏好而常用于抗原递送,但减毒鼠伤寒乳杆菌已被用作新抗原肽递送的替代工具。一项研究表明,多个新抗原肽可以通过基质金属蛋白酶 (MMP) 靶序列被固定在鼠伤寒杆菌外膜上。一旦工程化细菌侵入肿瘤微环境,新抗原就可以被肿瘤中的大量存在 MMP 从细菌表面分离下来,并被释放到 TME 中,从而定点招募和激活淋巴细胞。当研究人员用工程化新抗原菌株治疗小鼠结直肠肿瘤时,他们观察到促炎细胞因子 IL-2、TNF-α 和 INF-γ 的显著增加,以及肿瘤浸润淋巴细胞 (TILs) 的大量募集。
除了作为免疫调节剂,瘤内细菌还可以重塑 TME,并通过代谢调节间接增强适应性免疫反应。例如,EcN 被设计成将氨 (肿瘤中的代谢废物) 转化为 L-精氨酸。对 EcN 基因组进行进一步的修饰以增加 L-精氨酸的产量,例如删除精氨酸抑制因子 (ArgR) 以阻止生物合成途径中的基因负调控回路。此外,一种拮抗负反馈回路的显性突变ArgA (ArgAfbr) 被整合到细菌基因组时,可以防止高水平的 L-精氨酸对该途径的抑制。同时使用检查点封锁疗法时,这种产生 L-精氨酸菌株的瘤内注射,可以增加 TILs 的积累,并提高了整体的疗效。
工程化细菌也可以同时编码多种有效载荷,例如阻断免疫检查点的纳米抗体、细胞因子和趋化因子等,进一步激活和招募免疫细胞,增强适应性抗肿瘤免疫反应。对于缺乏CTL 浸润的肿瘤,在瘤内产生细胞因子和趋化因子可以提高其对免疫治疗的敏感性。这些因子包括但不限于 IL-2、IL-18 和 CCL-21,将其重组到细菌中都能有效刺激抗肿瘤免疫效应。IL-2 是其中研究最广泛的一种,产生 IL-2 的斑疹伤寒沙疹菌株展示了抗癌和防癌特性。EcN 也可以被编码产生 CXCL16,并促进 CTL 向肿瘤的趋化及归巢效应。总之,这些研究表明我们可以利用免疫反应固有的时间结构来调节细菌-免疫细胞的相互作用。在反应的不同阶段,通过控制细菌产生的有效载荷与特定的免疫细胞进行通信,重编程的细菌将有助于产生更有效的抗肿瘤免疫反应。
03
工程化微生物的其他应用
除了在 TME 内与肿瘤和免疫细胞结合外,细菌还可以与肿瘤外的材料和技术结合工作。利用超声和 MRI 等技术操纵细菌的行为,允许我们对肿瘤进行可视化和细菌进行远程控制,从而精确调整细菌的位置和肿瘤内治疗分子的释放时间。此外,纳米颗粒及其载体、放疗等疗法可以重塑 TME,并调节细菌与免疫系统的相互作用。当我们将这些技术结合在一起时,就可以创造出生物和非生物系统的复合模式,其中的各种单一疗法都有助于补充其他疗法的不足之处,从而改善整体的治疗结果 (图3)。
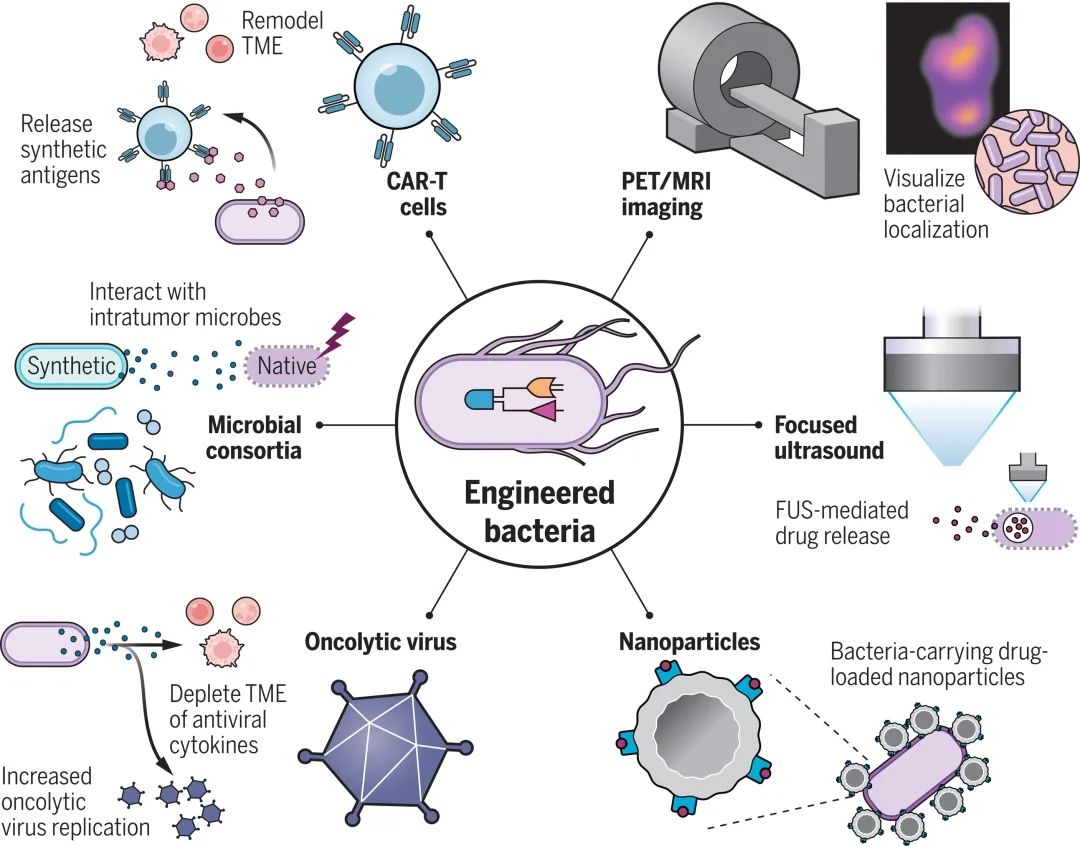
▲图3 || 工程细菌与其他非生物工具的相互作用
3.1 与非生物技术对接
正电子发射断层扫描 (PET) 和磁共振成像 (MRI) 等成像手段已被广泛用于癌症的检测和可视化。这些成像技术还可以与原始细菌或工程化细菌相结合,从而增强肿瘤的可视化和细菌的定位。除了基于图像的检测,细菌产生的分子还可以在尿液、血液和粪便中检测到,这种现象可用于实现非侵入性诊断。一旦细菌进入肿瘤内部,利用整合到细菌内部的传感器和基因回路,工程化细菌就可以报告肿瘤的存在与否、体积大小等参数,甚至还可以报告肿瘤的微环境信息。
此外,外部驱动手段也可以直接作用于进入体内的细菌,聚焦超声 (FUS) 就是这样一种手段。FUS 能够以很高的空间分辨率深入组织,使工程化细菌在精确的位置被可视化和被操纵。为了便于细菌的可视化,大肠杆菌和斑疹伤寒杆菌等细菌经过改造,可以表达自其他微生物的功能性报告基因,而这些基因簇的表达使得 FUS 能够检测到细菌。更具体地说,FUS 可以对它们在胃肠道和 TME 中的位置进行可视化定位。这些细菌也可以使用温度驱动的基因开关,以响应 FUS 热疗的方式释放免疫检查点抑制剂或细胞因子。最后,FUS 还可以作为一种机械疗法与细菌结合使用,细菌编码微米级的空化气泡,释放强烈的局部机械效应,破坏和杀死组织和细胞;而同时,细菌的溶解还会释放治疗性物质。
与此同时,许多研究团队正在努力将微生物与磁引导相结合,以增强工程化菌株对低氧肿瘤核心的外显性。有研究利用海洋磁球菌的磁动特性,证明外部磁矩可以驱动和控制携带脂质体货物的细菌,并增强细菌在 TME 深处的积累。在大肠杆菌表面涂上磁性纳米颗粒和化疗包封的纳米脂质体,也允许细菌通过三维材料的磁性引导。
放疗等外部治疗方式也可以通过促进细菌-免疫细胞的相互作用,与细菌和纳米颗粒治疗进行很好的联合应用。弱化的斑疹伤寒杆菌 (VNP20009) 被带正电的聚氨基胺树突状纳米颗粒包裹后,可以通过静电相互作用与带负电的抗原结合。当免疫抑制性的肿瘤被放疗辐照时,肿瘤抗原会被释放出来,然后工程化细菌可以将抗原运输到肿瘤周围的功能性树突状细胞,引发对肿瘤的强烈全身性免疫反应。
3.2 可编程药物的工程化
细菌除了可与外部技术及非生物材料的结合使用之外,还可以与其他活细胞相结合。最简单的例子是利用细菌重塑 TME,使其更有利于其他微生物和细胞疗法。例如,编码了IFN-I拮抗剂B18R的非致病性大肠杆菌,通过有效地保护泡状体病毒(VSV)免受免疫介导的清除,增强其瘤内复制。当作为单一疗法使用时,这两种微生物都没有明显的抗肿瘤疗效,但在小鼠癌症模型中联合使用两种微生物时,就可以观察到更好的抗肿瘤反应和生存数据。这种效果的基础是这两种微生物的工程化,如细菌耗尽 TME 中的抗病毒细胞因子 ,使环境适合随后到来的 VSV。在这项研究中,细菌被用来限制而不是激发免疫反应,并且可以有目的地选择特定的菌种和免疫效应载荷来补充溶瘤病毒疗法。同样地,细菌可以与 CAR-T 细胞疗法联合。一种叫做布鲁氏菌的减毒菌株可以促进肿瘤巨噬细胞的促炎性 M1 样极化,并增加肿瘤内 CD8+T细胞的浸润率。当它与 CAR-T 细胞一起注射到结肠癌小鼠模型中时,小鼠表现出较低的肿瘤负担和较长的生存时间。
在工程化细菌和细胞疗法 (如 CAR-T 细胞) 之间建立直接通信,是提高治疗效果的另一种联合策略。将工程化细菌编码的合成抗原可以被 CAR-T 细胞识别时,就可以实现细菌引导的 CAR-T 疗法 (ProCARs) 。在上述研究中,合成抗原作为工程细菌和ProCARs之间的通信介质,在肿瘤定植的细菌释放的合成抗原可以在肿瘤空间内对 CAR-T 的活化进行时空控制。当在携带人类肿瘤异种移植的小鼠中进行评估时,ProCAR 系统在多个肿瘤模型中显著延缓了肿瘤生长的效果,并且其效果优于细菌载体和 CAR-T 的单独治疗。对治疗反应的进一步分析表明,合成抗原的存在和细菌对 TLRs 的刺激,都增加了 ProCAR 的激活,充分证明了可编程药物工程的潜力。
除了细胞疗法外,人体还含有大量的微生物可用于治疗目的。肿瘤内细菌将吉西他滨代谢为非活性形式的现象与化疗耐药有关,而其他研究表明梭杆菌也可能与癌症进展有关。针对这些情况,我们可以设计工程化细菌来感知促进肿瘤的微生物,并通过产生抗菌载体来清除它们。此外,无害的肿瘤定植细菌也可以被转化为有助于抗肿瘤免疫的微生物。另一种方法则是利用小型微生物群作为治疗手段,研究人员在肠道微生物组中发现了一种 11株共生菌群,并被证明可以介导 CTL 介导的细胞免疫反应,在免疫检查点阻断疗法中增强 IFNγ+ CD8+T细胞的抑瘤效果。最后,使用合成生物学方法设计具有合作或拮抗共生关系的健壮合成群落,有望改善这种新型疗法的治疗效果。
04
总结与展望
细菌是一种多功能的平台,既可以单独使用,也可以与其他工具结合来改善肿瘤的检测和治疗。单独而言,细菌本身具有免疫刺激作用,能够引导靶向肿瘤的免疫反应。它们也可以进一步被设计,成为在细胞外和细胞内递送各种有效载荷的载体。由于细菌具有在肿瘤内部聚集的偏好,因此其药物释放的时空曲线也不同于传统的全身性疗法,从而有助于减轻脱靶毒性,并有助于靶向其他疗法难以触及的治疗靶点。
尽管近年来我们在细菌癌症治疗进展方面取得了许多重大进展,但在临床转化过程中仍然需要严格评估其生物污染和安全问题。卡介苗 (BCG) 是一种减毒的牛分枝杆菌菌株,临床上已被用于膀胱癌的治疗,为FDA批准细菌癌症疗法提供了基准。除卡介苗外,单独减毒菌株或与有效载荷工程化菌株也在患者中进行临床评估。随着用于癌症治疗的细菌系统持续不断地进入临床试验,这些试验结果也将回过头来指导未来的工程化方法,以提高其安全性和有效性。除了作为单一药物使用外,细菌疗法还可以与其他细胞疗法或体外工具进行联合。此时需要就双方的相互作用进行合理化的设计,从而提高其联合应用的效果。
参考文献:Engineering bacteria as interactive cancer therapies
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言