Enhertu在DESTINY-Breast03中延长HER2阳性转移性乳腺癌统计学意义上总生存,比T-DM1降低死亡风险36%
2022-12-12 网络 网络 发表于上海
Enhertu在DESTINY-Breast02 III期研究中,与化疗相比在HER2阳性患者的后线治疗中显示出显著的无进展和总生存期改善。
DESTINY-Breast03 III期临床试验最新结果显示,与恩美曲妥珠单抗(T-DM1)相比,Enhertu(通用名:德曲妥珠单抗)在既往接受过曲妥珠单抗和紫杉烷治疗的不可切除和/或转移性HER2阳性乳腺癌患者的总生存期(OS)方面表现出统计学意义上显著且具有临床意义的改善。这些结果和DESTINY-Breast02 III期临床试验的主要结果在2022年圣安东尼奥乳腺癌大会(SABCS)上公布,DESTINY-Breast03试验的最新结果同期发表在《柳叶刀》杂志上。
德曲妥珠单抗是由阿斯利康和日本第一三共联合开发和商业化的一款独特设计靶向HER2的抗体偶联药物(ADC)。在DESTINY-Breast03试验的关键次要终点OS分析中,德曲妥珠单抗与T-DM1相比,死亡风险降低了36%(基于风险比[HR]0.64;95%置信区间[CI]0.47-0.87;P=0.0037)。在两个治疗组中,德曲妥珠单抗组的中位随访时间为28.4个月,T-DM1组为26.5个月,但尚未达到中位OS(德曲妥珠单抗组[40.5-NE],T-DM1组[34.0-NE])。结果显示:德曲妥珠单抗组两年生存率为77.4%,而T-DM1组则为69.9%。在所有亚组中均观察到一致的生存获益趋势,包括有或没有基线脑转移的患者,有或没有基线内脏疾病的患者,激素受体(HR)阳性或阴性的患者,以及无论之前是否使用过帕妥珠单抗以及既往治疗线数。
加州大学洛杉矶分校大卫格芬医学院肿瘤内科医生、医学教授、血液肿瘤科乳腺癌临床试验项目主任,加州大学洛杉矶分校圣莫尼卡综合癌症中心临床研究部的医学主任Sara Hurvitz表示:“晚期乳腺癌治疗的主要目标是控制病情和提高生存率,因此继续改进现有的治疗方案,特别是在转移性治疗中至关重要。对于HER2阳性乳腺癌患者,如果在转移阶段初始治疗情况下出现疾病进展,德曲妥珠单抗治疗与T-DM1相比,生存率有明显改善,进一步证实这种药物是新的治疗标准。"
阿斯利康全球执行副总裁,肿瘤治疗领域研发负责人Susan Galbraith表示:“DESTINY-Breast03试验的最新结果显示,德曲妥珠单抗延长患者生命,还将疾病进展时间延缓了近两年,这使我们更加相信,这种药物有可能建立转移性HER2阳性乳腺癌患者二线治疗的新标准。加上DESTINY-Breast02研究,现在有两项针对转移性HER2阳性乳腺癌的III期临床研究都表明,与以前的治疗标准相比,患者在接受德曲妥珠单抗治疗时无进展生存时间更多,总生存期更长。”
第一三共公司研发部全球负责人Ken Takeshita表示:“DESTINY-Breast03和DESTINY-Breast02试验中显示的总生存获益进一步证实了德曲妥珠单抗在延长既往接受过治疗的HER2阳性乳腺癌患者生存方面的作用。此外,在DESTINY-Breast03试验中,与T-DM1相比,使用德曲妥珠单抗治疗患者中位无进展生存期延长了4倍,1/5的患者实现肿瘤完全缓解,这在转移性HER2阳性乳腺癌治疗中尤其让人印象深刻。“
在DESTINY-Breast03试验进一步随访中,德曲妥珠单抗也持续在无进展生存期(PFS)上显示出具有临床意义的改善,与T-DM1相比,中位PFS改善了22个月,再次证实了之前中期分析结果的统计学意义。新的探索性分析没有就统计学意义进行考察,数据也没有显示治疗组之间的差异。在本次事后分析中,经盲法独立中心评审委员会(BICR)评估,德曲妥珠单抗治疗组患者的中位PFS为28.8个月,而T-DM1组为6.8个月。德曲妥珠单抗组确认的客观反应率(ORR)为78.5%,其中21.1%的患者表现为完全缓解(CR),而T-DM1组的ORR为35.0%,其中9.5%的患者达到CR。德曲妥珠单抗组的中位持续缓解时间(DoR)为36.6个月,T-DM1组为23.8个月。
更新结果摘要:DESTINY-Breast03试验
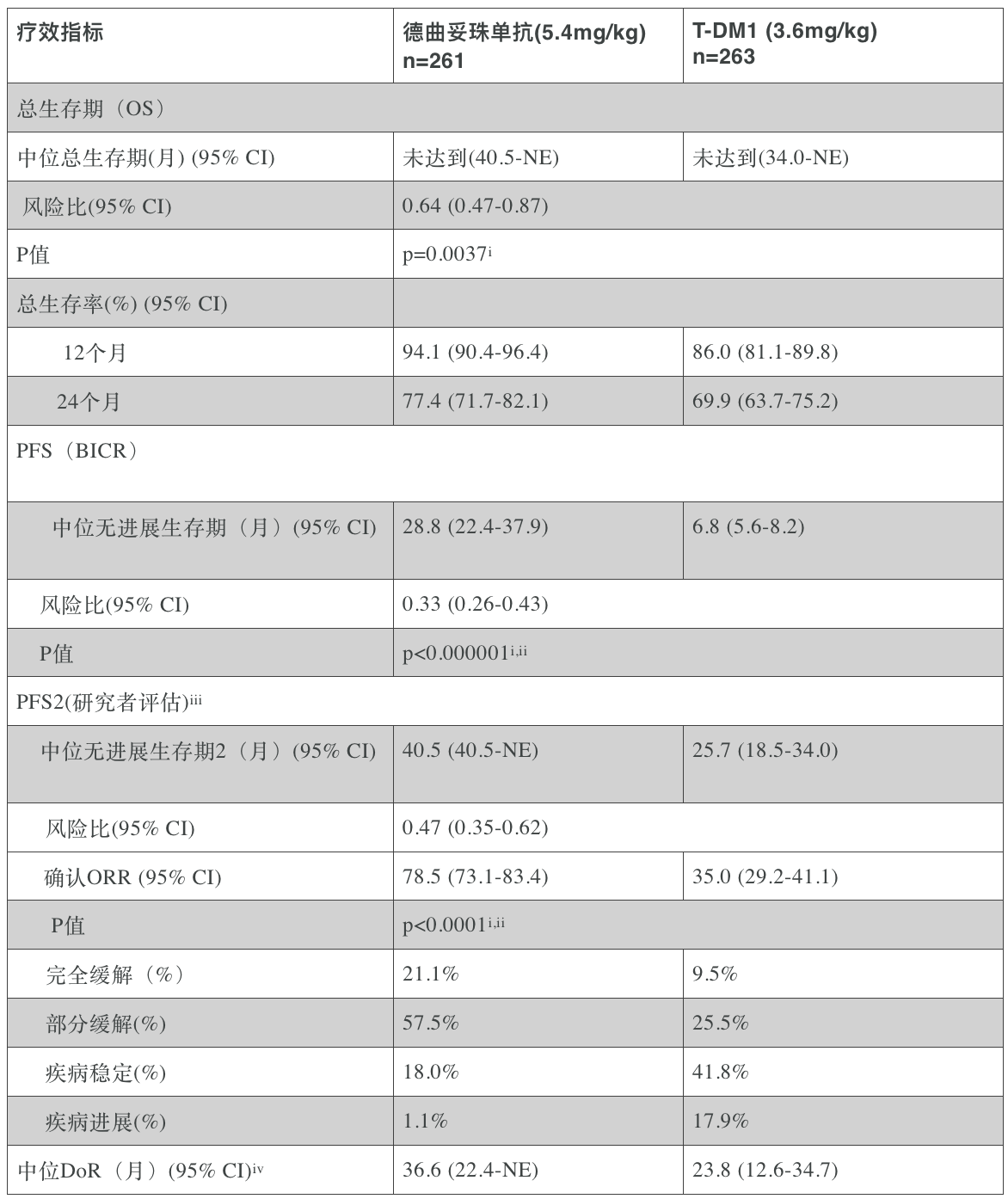
OS,总生存期;CI,置信区间;PFS,无进展生存期;PFS2,第二无进展生存期;BICR,盲法独立中心评审委员会;ORR,客观反应率;DoR,持续缓解时间
i 双边
ii 名义P值。最新的探索性分析没有进行统计学意义的考察,也没有显示治疗组之间的差异。
iii 从随机分组到第二次进展的时间
iv基于盲法独立中心评审委员会评估
在DESTINY-Breast03试验中观察到的德曲妥珠单抗的安全性与之前的临床试验一致,没有发现新的安全性信号。德曲妥珠单抗治疗组最常见的3级或以上治疗相关不良事件(TEAEs)是中性粒细胞计数减少(16.0%)、贫血(9.3%)、血小板计数减少(7.8%)和恶心(7.0%)。由独立评审委员会确定有39例(15.2%)与治疗相关的间质性肺病(ILD)或肺炎的报告,大多数(14.4%)是低级别(1级或2级),有两个3级(0.8%),没有发生4级或5级ILD或肺炎事件。
DESTINY-Breast02试验结果显示,与化疗相比德曲妥珠单抗在转移性HER2阳性乳腺癌的后续治疗中明显改善PFS和OS
DESTINY-Breast02 III期试验的主要结果显示,在既往接受过T-DM1治疗的不可切除和/或转移性HER2阳性乳腺癌患者中,与医生选择的治疗方法(曲妥珠单抗+卡培他滨或拉帕替尼+卡培他滨)相比,德曲妥珠单抗降低疾病进展或死亡风险64%[HR=0.36;95% CI 0.28-0.45;p<0.000001]。根据BICR评估,德曲妥珠单抗治疗组患者的中位PFS为17.8个月,而医生选择治疗组患者的PFS为6.9个月。与医生选择治疗组相比,德曲妥珠单抗的死亡风险也降低了34%(HR=0.66;95% CI 0.50-0.86;P=0.0021),中位OS为39.2个月,而医生选择治疗组为26.5个月。
DESTINY-Breast02试验数据证实了DESTINY-Breast01 II期试验中的数据,支持德曲妥珠单抗首次获批用于转移性HER2阳性乳腺癌患者,这些患者之前接受过两种或更多抗HER2治疗。
DESTINY-Breast02试验中德曲妥珠单抗的安全性与之前的临床试验一致,没有发现新的安全性信号。德曲妥珠单抗治疗组最常见的3级或以上治疗相关的TEAEs是中性粒细胞计数减少(10.6%)、贫血(7.9%)、中性粒细胞减少(7.7%)和恶心(6.7%)。由独立评审委员会确定有42例(10.4%)与治疗相关的ILD或肺炎的报告,大多数(9.1%)是低级别(1级或2级),发生3个3级(0.7%)事件,没有4级事件,有2个(0.5%)5级ILD或肺炎事件。
关于乳腺癌和HER2表达
乳腺癌是最常见的癌症,也是全球和美国癌症相关死亡的主要原因之一。2020年全球确诊乳腺癌病例超过200万,导致近68.5万人死亡1 。大约五分之一的乳腺癌患者被确诊为HER2阳性2。
HER2是一种酪氨酸激酶受体促生长蛋白,在多种肿瘤表面表达,包括乳腺癌、胃癌、肺癌和结直肠癌3 。HER2蛋白过度表达可能是HER2基因扩增的结果,并且通常与乳腺癌侵袭性强和不良预后有关4。
尽管使用曲妥珠单抗和紫杉烷进行初始治疗,但HER2阳性转移性乳腺癌患者通常还是会出现疾病进展 。需要更有效的治疗选择来进一步延缓进展并延长生存期5,6。
关于DESTINY-Breast03
DESTINY-Breast03是一项全球、随机、开放标签、注册III期临床试验,旨在头对头评估德曲妥珠单抗(5.4mg/kg)相较于T-DM1对于HER2阳性、既往接受过曲妥珠单抗和紫杉类药物治疗的不可切除和/或转移性乳腺癌患者的安全性和有效性。
DESTINY-Breast03主要疗效终点是基于盲法独立中心评审委员会评估的PFS。次要疗效终点包括 总生存期、客观缓解率、缓解持续时间、临床获益率、基于研究者评估的 PFS 和安全性。
DESTINY-Breast03 在亚洲、欧洲、北美洲、大洋洲和南美洲的多个研究中心招募了524 名患者,主要研究结果发表于《新英格兰医学杂志》7 。有关该试验的更多信息,请访问 ClinicalTrials.gov。
关于DESTINY-Breast02
DESTINY-Breast02是一项全球、随机、开放标签的III期临床试验,评估德曲妥珠单抗(5.4mg/kg)与医生选择的治疗方法(曲妥珠单抗/卡培他滨或拉帕替尼/卡培他滨)在曾接受过T-DM1治疗的HER2阳性不可切除和/或转移性乳腺癌患者中的疗效和安全性。患者以2:1的比例随机接受德曲妥珠单抗或医生选择的治疗。
DESTINY-Breast02试验的主要终点是基于BICR的PFS,关键次要终点是OS。其他次要终点包括基于BICR和研究者评估的ORR、基于BICR的DoR、基于研究者评估的PFS和安全性。
DESTINY-Breast02试验在亚洲、欧洲、北美洲、大洋洲和南美洲的多个地点招募了约600名患者。有关该试验的更多信息,请访问ClinicalTrials.gov。
关于德曲妥珠单抗
德曲妥珠单抗是一款靶向HER2的ADC,采用第一三共专有的DXd ADC技术设计,是第一三共肿瘤产品组合中的领先ADC,也是阿斯利康ADC科学平台中最先进的项目。德曲妥珠单抗由人源化抗HER2单克隆抗体通过稳定的可裂解四肽连接子与拓扑异构酶-I抑制剂(喜树碱类衍生物DXd)连接组成。
基于DESTINY-Breast03试验结果,德曲妥珠单抗(5.4mg/kg)在超过35个国家被批准用于治疗不可切除或转移性HER2阳性乳腺癌成年患者,这些患者之前接受过一种(或一种或多种)抗HER2的治疗方案,并且在新辅助或辅助疗法期间以及之后六个月内疾病复发。
基于DESTINY-Breast01试验结果,德曲妥珠单抗还在多个国家被批准用于治疗接受过两种或两种以上抗HER2治疗方案后的不可切除或转移性HER2阳性乳腺癌成年患者。
基于DESTINY-Preast04试验结果,德曲妥珠单抗(5.4mg/kg)在巴西和美国被批准用于治疗不可切除或转移性HER2-low(IHC 1+ 或 IHC 2+/ISH 阴性)乳腺癌的成年患者,这些患者之前接受过转移性系统治疗,或在完成辅助化疗期间或六个月内出现疾病复发。
基于DESTINY-Lung02试验的结果,德曲妥珠单抗(5.4mg/kg)在美国被以加速审批方式获准用于治疗不可切除或转移性NSCLC的成年患者,以FDA批准的测试方法检测,这些患者的肿瘤有激活的HER2(ERBB2)突变,而且这些患者以前接受过系统治疗。该适应症的继续批准可能取决于确认性试验中对临床获益的验证和描述。
基于DESTINY-Gastric01试验的结果,德曲妥珠单抗(6.4mg/kg)在多个国家被批准用于治疗接受过以曲妥珠单抗为基础治疗后进展的HER2阳性局部晚期或转移性胃癌或胃食管交界处腺癌成人患者。
注:本文涉及研究中的药品用法尚未在中国获批适应症,阿斯利康不推荐任何未被批准的药品使用。
参考资料
1. Sung H, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 10.3322/caac.21660.
2. Ahn S, et al. HER2 status in breast cancer: changes in guidelines and complicating factors for interpretation. J Pathol Transl Med. 2020; 54(1): 34-44.
3. Iqbal N, et al. Human Epidermal Growth Factor Receptor 2 (HER2) in Cancers: Overexpression and Therapeutic Implications. Mol Biol Int. 2014; 852748.
4. Pillai R, et al. HER2 mutations in lung adenocarcinomas: A report from the Lung Cancer Mutation Consortium. Cancer. 2017;1;123(21):4099-4105.
5. Barok M, et al. Trastuzumab emtansine: mechanism of action and drug resistance. Breast Cancer Res. 2014; 16(2):209.
6. Nader-Marta G, et al. How we treat patients with metastatic HER2-positive breast cancer. ESMO Open. 2022; 7:1.
7. Cortes J, et al. Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Engl J Med. 2022; 386:1143-1154.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







