Nature Cancer:EZH2抑制重塑炎症性衰老相关的分泌表型从而增强胰腺癌的免疫检测
2023-05-08 Jenny Ou MedSci原创 发表于上海
EZH2抑制促炎SASP,EZH2抑制与衰老诱导治疗相结合,可能是在PDAC中实现免疫介导的肿瘤控制的有力手段。

胰腺导管腺癌(PDAC)是一种毁灭性疾病,几乎没有有效的治疗选择,是第三大癌症相关死亡的原因。常规化疗方案在PDAC中的疗效有限,部分原因是其纤维化和脱塑性肿瘤微环境(TME)导致血管功能障碍以及肿瘤药物输送和活性差。
目前的研究和临床试验都专注于克服免疫抑制作为PDAC的治疗策略包括:(1)通过嵌合抗原受体(CAR)T细胞治疗、CTLA-4免疫检查点阻断(ICB)疗法或新抗原疫苗方法重新设计T细胞反应(2)针对抑制性成纤维细胞群体和功能(3)消除或重新编程抑制性骨髓细胞。
KRAS中的点突变是PDAC中的致癌性驱动因素,在>90%的患者中发现。增加肿瘤免疫原性和刺激抗肿瘤免疫的一个策略是针对驱动免疫抑制的致癌途径,包括RAS信号本身。RAS通路靶向疗法已被证明,不仅通过上调抗原呈现和处理基因来增加肿瘤免疫原性,还可以导致免疫刺激微环境,激活抗肿瘤NK细胞和T细胞免疫以及ICB治疗功效。
2023年5月4日发表在Nature Cancer上的文章研究了如何直接重塑肿瘤分泌瘤,作为提高肿瘤免疫原性和转化免疫抑制性PDAC TME的策略。
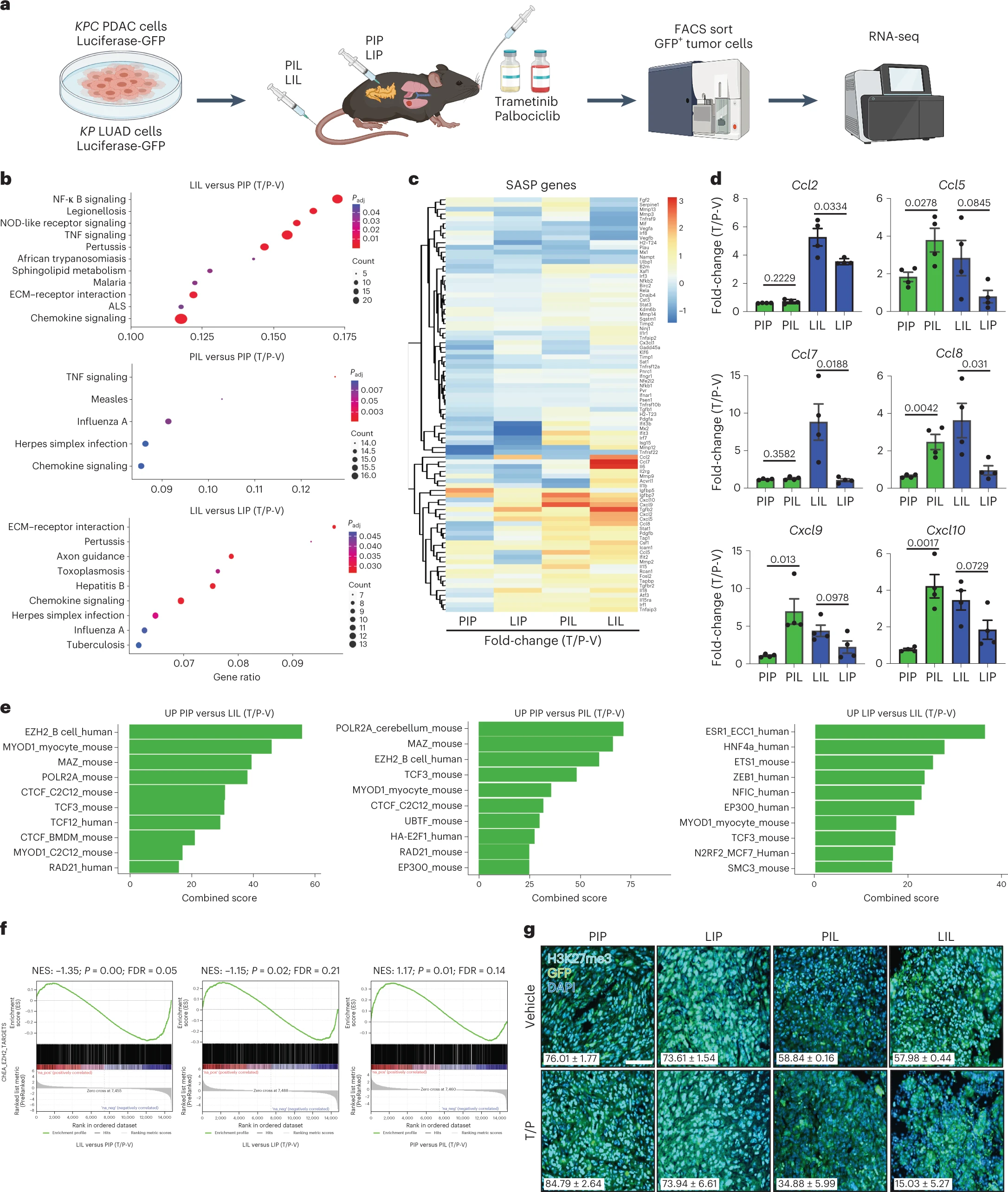
促炎SASP在胰腺TEM中被转录和表观遗传抑制
通过比较KRAS突变LUAD和PDAC肿瘤中治疗诱导的衰老效果,研究人员发现了一种表观遗传机制,该机制抑制了PDAC中的促炎SASP隐形体,该隐形体由PRC2成分zeste同源2(EZH2)及其甲基转移酶活性介导。EZH2抑制与治疗诱导的衰老相结合,释放出促炎SASP趋化因子,如CCL2和CXCL9/10,并诱导MHC-I和NK细胞配体表达,通过细胞毒性NK和T淋巴细胞协调先天和适应性免疫攻击,在某些情况下,这导致临床前PDAC模型的完全反应。
EZH2已被证明有助于在其他癌症环境中免疫规避和抗ICB治疗,EZH2通过抑制与SASP相关的促炎转录组、分泌组和表面组来介导PDAC免疫抑制。从机械上讲,EZH2甲基转移酶活性直接负责抑制许多与SASP相关的趋化因子和细胞因子基因,因此,在T/P治疗后,肿瘤细胞中对EZH2的遗传或药理抑制导致这些位点的H3K37me3水平明显下降,并从血管生成到促炎SASP计划的表型转换。临床上,EZH2通常在分化不良的PDAC中过度表达,并与化学抵抗有关。此外,对患者样本的分析显示,EZH2不仅与抑制人类PDAC中的炎症趋化因子、NK细胞和T细胞免疫力有关,而且患者总体存活率低下。
但是,SASP通常被认为是一把“双刃剑”。PDAC TME中丰富的SMA+肌成纤维细胞通过促进ESH2介导的肿瘤细胞中促炎SASP基因的抑制,有助于NK细胞和T细胞免疫抑制。值得注意的是,与p53为零的LUAD细胞不同,移植的PDAC细胞含有一个突变的p53R172H等位基因,可以发挥额外的免疫抑制表型,因此,不能排除肿瘤细胞内在因素也可能导致衰老诱导后炎症信号通路的差异的可能性。尽管如此,衰老诱导后产生的SASP的数量和质量部分受到TME及其对癌细胞表观遗传状态的影响。
与此同时,通过SASP诱导趋化因子,推动NK细胞和T细胞渗透到TMEs,可能是使PDAC等免疫学上寒冷的肿瘤变热的有力方法。Chemokines CCL7和CCL8在EZH2抑制后在衰老的PDAC细胞中也高度诱导,并与CCL2(CCR2)相同的受体结合,这表明它们可以在NK细胞贩运到PDAC中发挥作用。其他SASP趋化因子,如CXCL9/10,与CXCR3结合,与其他癌症环境中的T细胞招募和热TME有关,是CD8+ T细胞在治疗诱导的衰老后招募到PDAC所必需的。值得注意的是,在我们的系统中,通过SASP趋化因子增加的细胞毒性NK细胞和CD8+ T细胞贩运与增强衰老细胞的免疫原性相结合,即使没有ICB治疗,也足以增强PDAC中的抗肿瘤免疫监测。
虽然遗传性EZH2抑制剂和药理学EZH2甲基转移酶抑制导致NK细胞和T细胞激活,并在治疗诱导的衰老后增强PDAC肿瘤控制,但与遗传敲除相比,小分子EZH2抑制的抗肿瘤作用没有那么强大或持久。系统性EZH2抑制对CD8+ T细胞功能和增殖的有害影响,以及EZH2的支架功能独立于其甲基转移酶活性,可能有助于降低Tazemetostat的抗肿瘤活性。破坏PRC2复合物稳定性的抑制剂,例如通过瞄准核心亚基EED或EZH2降解者,可以提供更有效的PRC2复合物和EZH2抑制。
Tazemetostat和其他EZH2甲基转移酶抑制剂已证明其有效性,并已应用于血液恶性肿瘤和肉瘤的临床护理中,为将EZH2抑制剂与衰老诱导疗法(由MEK和CDK4/6抑制剂组合产生)相结合提供了理由,通过促炎SASP诱导促进NK细胞和T细胞介导的PDAC根除。由于放射和化疗在某些情况下也可以诱导衰老,因此有趣的是,看看EZH2抑制剂是否也表现出与这些药物的组合活性。总的来说,我们的工作提供了一个策略,利用EZH2抑制剂作为免疫肿瘤学方法,结合衰老诱导剂,重塑炎症性肿瘤隐形体,以进行免疫介导的PDAC控制。
原文出处
Chibaya, L., Murphy, K.C., DeMarco, K.D. et al. EZH2 inhibition remodels the inflammatory senescence-associated secretory phenotype to potentiate pancreatic cancer immune surveillance. Nat Cancer (2023). https://doi-org.7sup.top/10.1038/s43018-023-00553-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言