《科学》子刊:抗癌明星PD-L1竟然还是“减重大师”!科学家发现,脂肪DC细胞通过PD-L1调控体重
2022-04-18 奇点网 奇点网
通过对临床数据的分析发现,肥胖的肿瘤患者在接受免疫检查点抑制剂治疗后响应率更高,总体生存期更长。
和你们一样,只要有人提起PD-1/PD-L1通路,我第一个想到的肯定是癌症免疫治疗。
都柏林大学圣三一学院的这个研究可能要刷新我们的认知了。
近日,由都柏林大学圣三一学院的Christian Schwartz和Padraic G. Fallon领衔的研究团队,在《科学·转化医学》上发表一项重要研究成果[1]。
他们发现树突状细胞(DC)可以通过PD-L1调控脂肪组织的适应性免疫,限制饮食引起的肥胖。也就是说,PD-1/PD-L1这条不仅涉及人体免疫反应,还调节着我们的体重。
值得注意的是,由于PD-1/PD-L1在调节脂肪组织稳态中有重要作用,这或许能解释免疫检查点抑制剂的某些免疫相关不良反应。

论文首页截图
如今,肥胖在世界范围内变得越来越普遍,预防和治疗肥胖及其相关疾病的需求也变得越来越迫切。了解脂肪组织从健康状态向肥胖状态转变的机制有助于我们预防过度肥胖。
近些年的研究显示,脂肪组织的代谢稳态与其中浸润的免疫细胞有密切的关系。在非肥胖者的脂肪组织中浸润较多的2型固有淋巴细胞(ILC2)、嗜酸性粒细胞、抗炎表型的巨噬细胞(M2)、Treg以及CD4+辅助型T细胞2(Th2)细胞[2-5];在发展为肥胖的过程中,脂肪组织中炎性细胞逐渐增加,例如促炎表型的巨噬细胞(M1)、中性粒细胞、CD8+T细胞、Th1细胞和Th17细胞显著增加[6,7]。
脂肪组织中浸润的炎性细胞,尤其是Th1、Th17和CD8+T细胞,会促进脂肪组织中的慢性炎症,从而促进肥胖以及机体的代谢紊乱,如胰岛素抵抗[8]。但是我们对脂肪组织中T细胞应答的调控机制还不是很了解。
已有的研究显示PD-L1是参与调节适应性免疫系统的关键分子,并且PD-L1可以影响CD4+T细胞的极化并抑制炎症反应[9]。因此,Fallon教授团队想知道PD-L1是否也会影响脂肪组织炎症。
他们发现PD-L1缺陷小鼠在高脂饮食后体重增加更多,有更多的白色脂肪,并且糖耐量与胰岛素敏感性受损。这些数据说明PD-L1在控制肥胖以及代谢稳态中发挥了重要作用。
随后,Fallon教授团队检测了脂肪组织中抗炎的ILC2细胞、嗜酸性细胞以及M2型巨噬细胞的比例,发现它们在PD-L1缺陷后均有显著减少。对Th亚群的检测则发现,PD-L1缺陷小鼠脂肪组织中促炎性的Th1亚群显著增加,而抗炎的Th2以及Treg显著减少。这些数据表明,PD-L1可以在饮食诱导肥胖过程中调节脂肪组织内适应性免疫反应。
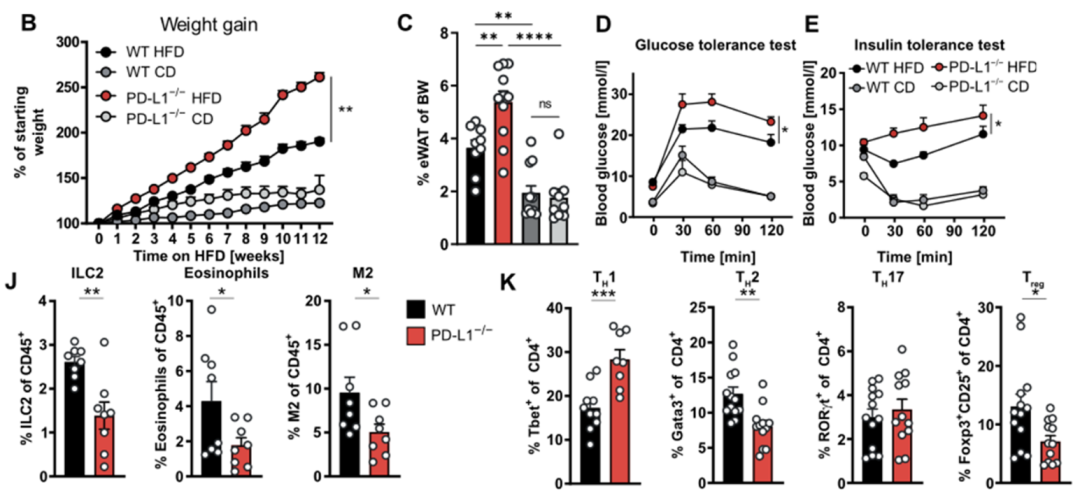
高脂饲喂下,相比于WT小鼠,PD-L1-/-小鼠脂肪增加更多,糖耐量与胰岛素敏感性受损更为严重,同时PD-L1-/-小鼠脂肪组织中促炎性细胞更多
不过,PD-L1在脂肪组织的多种免疫细胞上均有表达,包括ILC2细胞、CD4+T细胞、巨噬细胞和DC细胞。那么到底是哪种细胞上表达的PD-L1发挥调控作用呢?
Fallon教授团队使用多种条件敲除PD-L1小鼠证明,ILC2、CD4+T以及巨噬细胞上PD-L1缺陷并不会影响肥胖进程以及机体代谢稳态。而敲除DC细胞上的PD-L1则会导致小鼠的肥胖更加严重,并且糖耐量与胰岛素敏感性受损。对脂肪组织免疫细胞组成进行检测发现:敲除DC细胞上的PD-L1会使脂肪组织中Th1增加而Treg减少。这些数据表明DC细胞上表达的PD-L1可以限制脂肪组织炎症与肥胖。
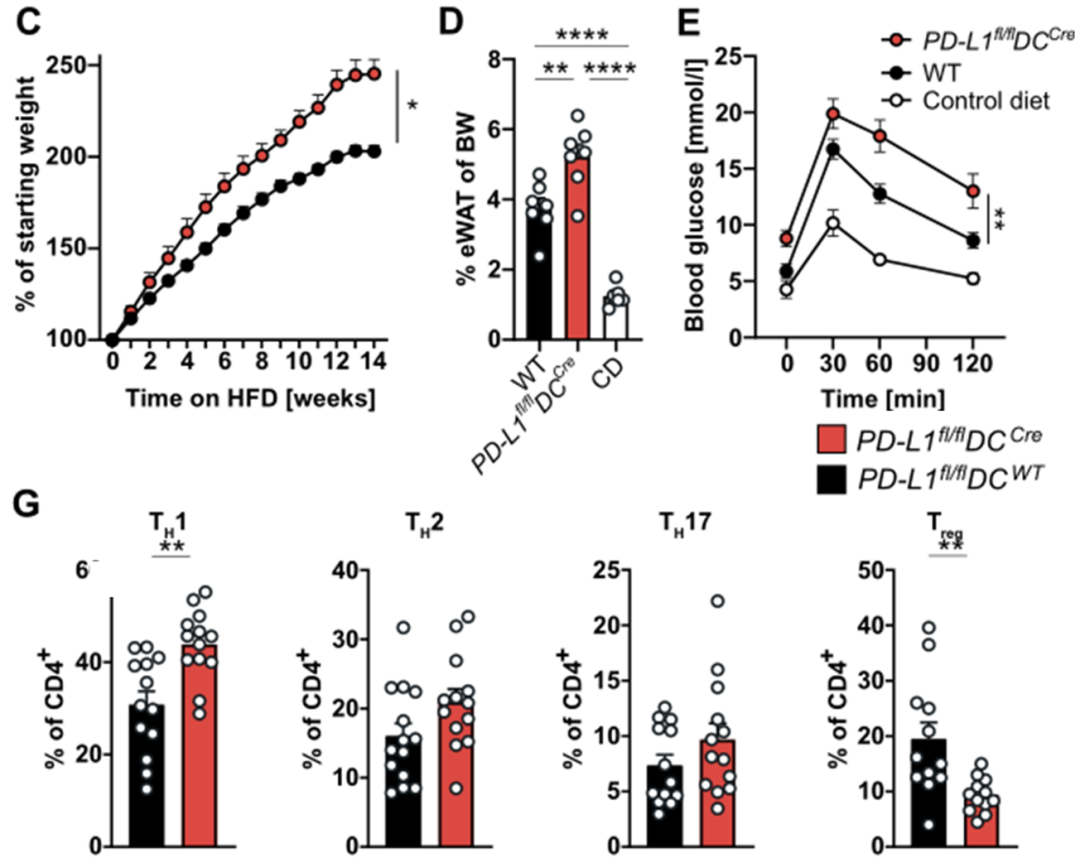
敲除cDC上的PD-L1导致小鼠更加肥胖,并且导致脂肪组织中促炎性细胞增加
鉴于DC细胞PD-L1对脂肪组织炎症的调控,Fallon教授团队的研究人员想知道DC是否通过PD-1/PD-L1轴调控了CD4+T细胞的极化。因此,他们将骨髓来源的DC细胞与幼稚CD4+T细胞共培养,发现阻断PD-1/PD-L1后Th2细胞极化显著减少;在培养体系中加入IL-12后,阻断PD-1/PD-L1显著增强了Th1的极化。这些数据说明DC细胞上的PD-L1可以抑制Th1极化。
考虑到ILC2细胞是维持脂肪组织稳态的重要调控者[2],研究团队想知道DC上的PD-L1是否会影响ILC2的功能。因此,研究人员将脂肪组织来源的ILC2与DC细胞共培养,发现阻断PD-L1后ILC2分泌IL-13的能力显著下降。这说明DC可以通过PD-L1增强ILC2的抗炎功能。
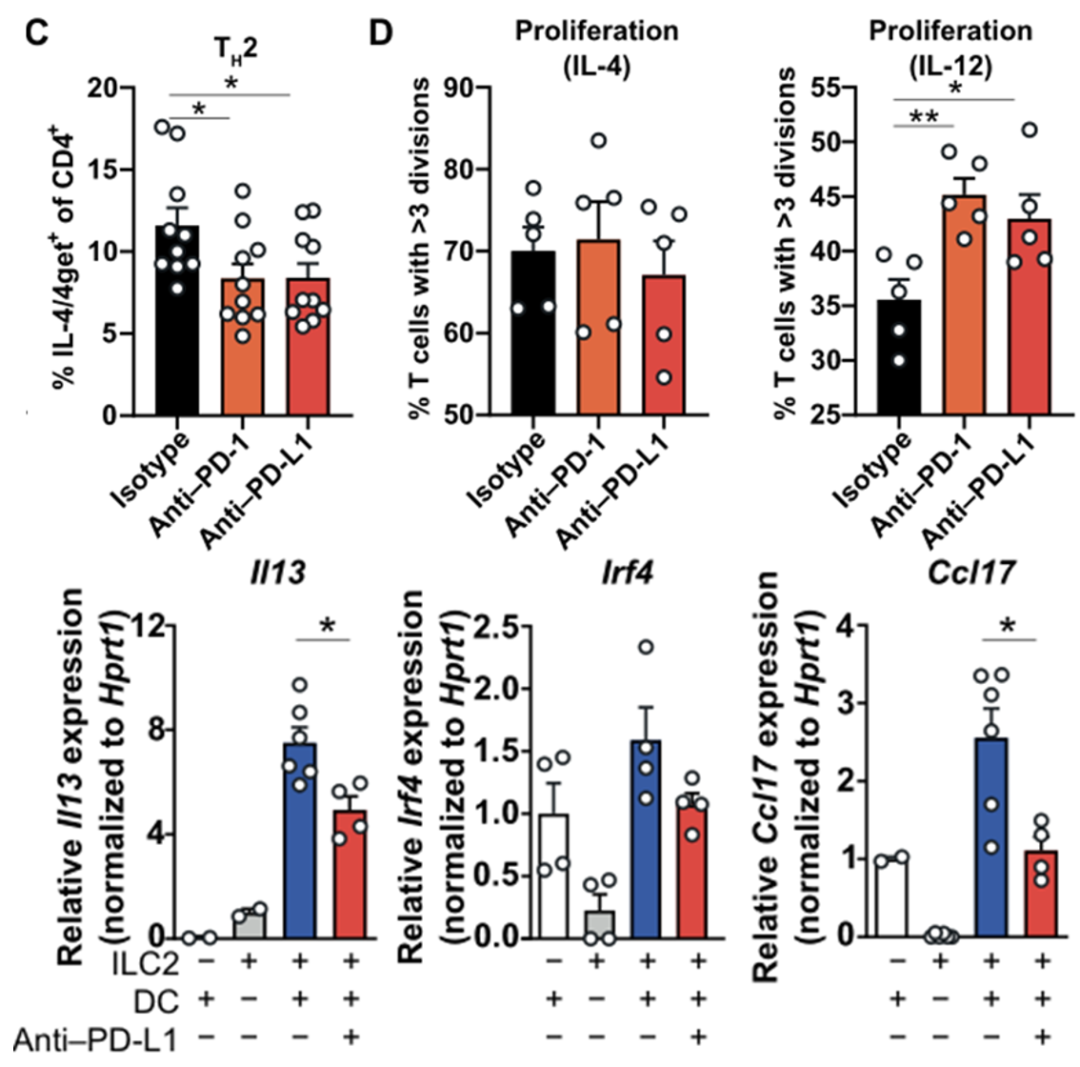
DC细胞通过PD-L1抑制Th1极化并增强ILC2的抗炎功能
获得以上结果后,Fallon教授团队想知道使用PD-L1抑制剂进行体内治疗会不会影响小鼠的代谢。因此,研究团队给予高脂饮食10周的小鼠PD-L1抑制剂治疗,发现接受治疗的小鼠糖耐量受损更加严重,体重也显著增加,脂肪组织中有更多的Th1与Th17细胞。这说明在高脂饮食期间阻断PD-L1会促进脂肪组织炎症以及机体代谢紊乱。
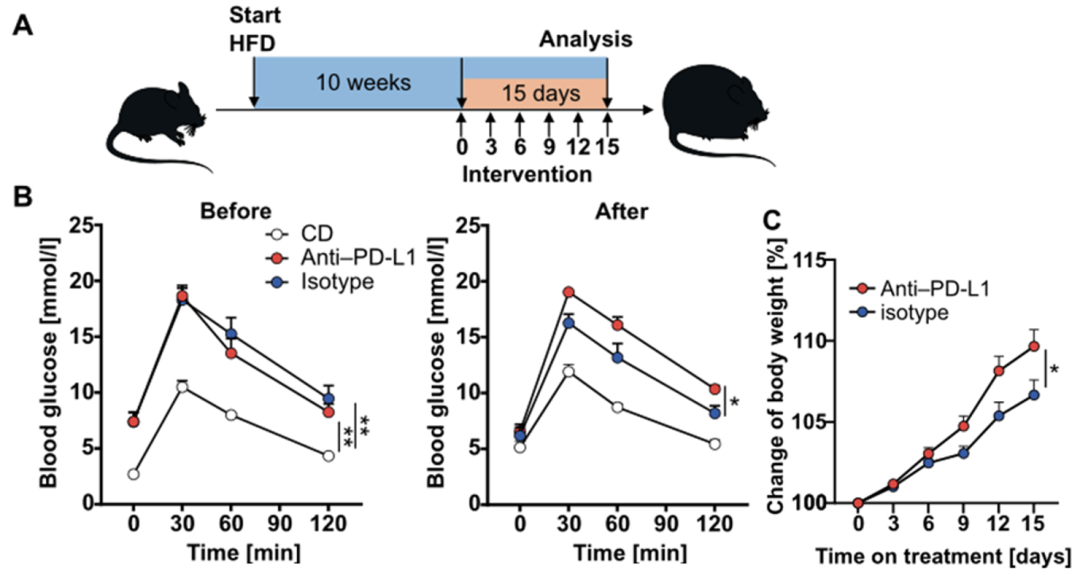
使用PD-L1抑制剂处理后,肥胖小鼠的代谢进一步紊乱,体重增长也更加迅速
临床上有一部分肿瘤患者也有肥胖的状况,Fallon教授团队想知道接受PD-L1抑制剂治疗是否会对他们的代谢状态产生影响。考虑到接受治疗的肿瘤患者通常会因疾病改变饮食,研究团队决定在使用PD-L1抑制剂治疗期间让小鼠恢复正常饮食。结果显示,恢复正常饮食的肥胖小鼠在接受PD-L1抑制剂治疗后,体重下降更为明显,但是血糖控制能力受损更加严重。
与此一致的是,有报道显示部分接受PD-1/PD-L1抑制剂治疗的肿瘤患者出现糖尿病[10]。这些数据提示我们,在正常饮食期间接受PD-L1抑制剂治疗虽然可能有助于减轻肥胖患者体重,但是却可能加重代谢紊乱。
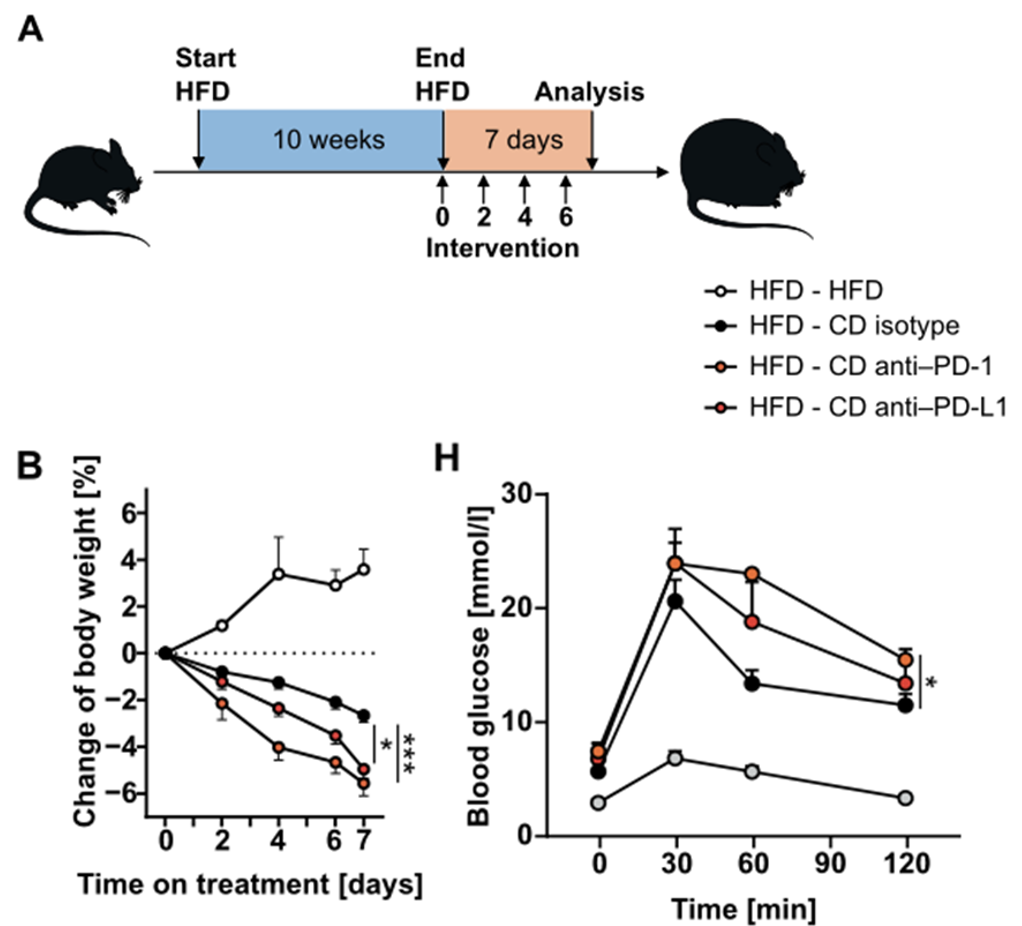
肥胖小鼠在正常饮食期间接受PD-L1抑制剂治疗,体重下降更迅速,但是血糖控制能力受训
以上的研究结果已经说明,在小鼠脂肪组织中存在由DC细胞主导的抗炎调控轴,那么同样的机制在人类中是否存在?
Fallon教授团队分析了健康人以及肥胖患者脂肪组织中PD-L1 mRNA水平,发现肥胖患者的PD-L1表达显著上调,并且PD-L1水平与肥胖程度呈现正相关。流式细胞术分析表明,上调表达PD-L1的细胞主要是ILC2和cDC1细胞。这些数据暗示,在过度肥胖患者会代偿性上调PD-L1的表达水平,以限制脂肪组织炎症的加重。
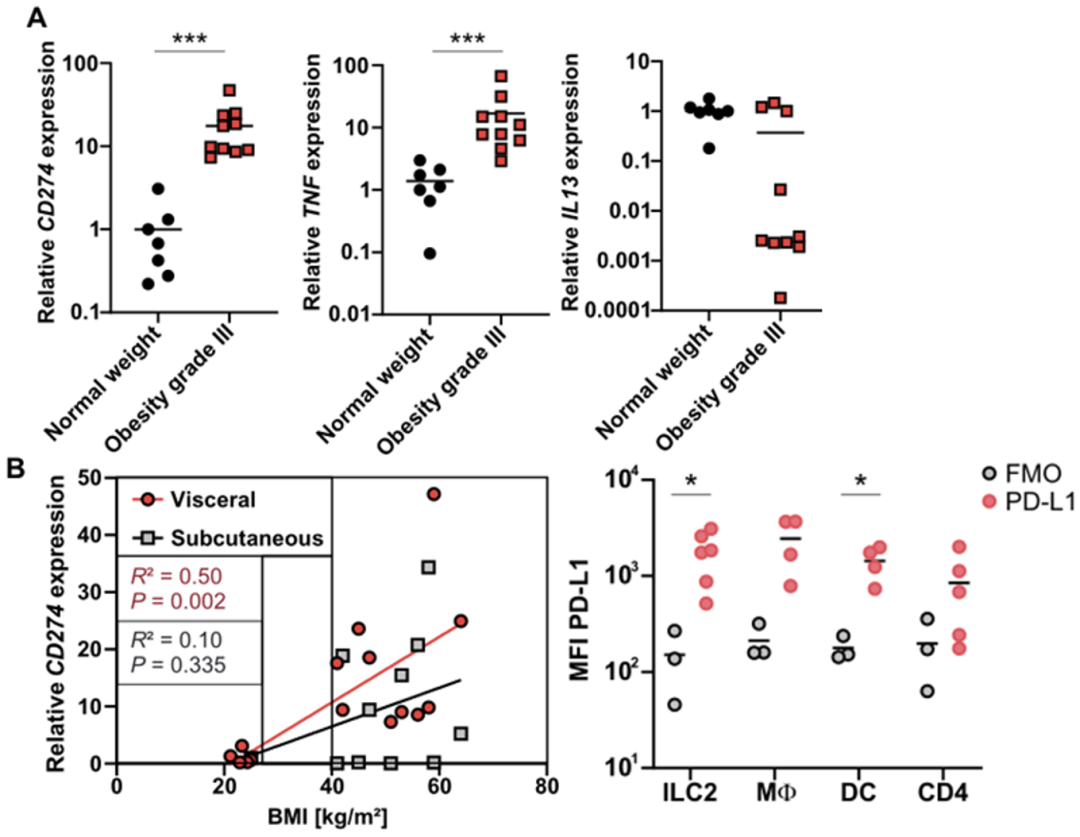
人类肥胖患者脂肪组织ILC2和cDC1细胞高表达PD-L1
总的来说,这项研究揭示了DC上PD-L1在限制脂肪组织炎症与机体代谢紊乱中的重要作用。并且,该研究的结果也提醒我们应该注意肥胖的肿瘤患者在接受PD-1/PD-L1抑制剂治疗后的代谢变化,防止引起代谢相关疾病。
同时本研究也与肿瘤免疫学有一些奇妙的联系。
有充分的证据表明肥胖可以增加罹患肿瘤的风险[11,12]。有研究认为这可能与肥胖带来的持续慢性炎症有关[13],这与本研究的结果一致。此外,本研究还揭示了肥胖患者脂肪组织中DC细胞显著上调表达PD-L1,这有可能会损害免疫系统的免疫监视功能,促进肿瘤发生。
另一方面,通过对临床数据的分析发现,肥胖的肿瘤患者在接受免疫检查点抑制剂治疗后响应率更高,总体生存期更长[14,15]。这也许是因为肥胖会引起T细胞高表达PD-1,而PD-1抑制剂则解除了这些T细胞的抑制信号,使其发挥抗肿瘤作用[16]。此外,脂肪组织分泌的炎性介质,如IL-6和TNF-α等也塑造了一种促炎的微环境[13],这可能在一定程度上减轻了肿瘤引起的免疫抑制。
参考文献:
1.Schwartz C, Schmidt V, Deinzer A, et al. Innate PD-L1 limits T cell-mediated adipose tissue inflammation and ameliorates diet-induced obesity. Sci Transl Med. 2022;14(635):eabj6879. doi:10.1126/scitranslmed.abj6879
2.Hams E, Locksley RM, McKenzie AN, Fallon PG. Cutting edge: IL-25 elicits innate lymphoid type 2 and type II NKT cells that regulate obesity in mice. J Immunol. 2013;191(11):5349-5353. doi:10.4049/jimmunol.1301176
3.Molofsky AB, Nussbaum JC, Liang HE, et al. Innate lymphoid type 2 cells sustain visceral adipose tissue eosinophils and alternatively activated macrophages. J Exp Med. 2013;210(3):535-549. doi:10.1084/jem.20121964
4.Feuerer M, Herrero L, Cipolletta D, et al. Lean, but not obese, fat is enriched for a unique population of regulatory T cells that affect metabolic parameters. Nat Med. 2009;15(8):930-939. doi:10.1038/nm.2002
5. Wu D, Molofsky AB, Liang HE, et al. Eosinophils sustain adipose alternatively activated macrophages associated with glucose homeostasis. Science. 2011;332(6026):243-247. doi:10.1126/science.1201475
6.Nishimura S, Manabe I, Nagasaki M, et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat Med. 2009;15(8):914-920. doi:10.1038/nm.1964
7.Yang H, Youm YH, Vandanmagsar B, et al. Obesity increases the production of proinflammatory mediators from adipose tissue T cells and compromises TCR repertoire diversity: implications for systemic inflammation and insulin resistance. J Immunol. 2010;185(3):1836-1845. doi:10.4049/jimmunol.1000021
8.Kanneganti TD, Dixit VD. Immunological complications of obesity. Nat Immunol. 2012;13(8):707-712. Published 2012 Jul 19. doi:10.1038/ni.2343
9. Schwartz C, Khan AR, Floudas A, et al. ILC2s regulate adaptive Th2 cell functions via PD-L1 checkpoint control. J Exp Med. 2017;214(9):2507-2521. doi:10.1084/jem.20170051
10. Stamatouli AM, Quandt Z, Perdigoto AL, et al. Collateral Damage: Insulin-Dependent Diabetes Induced With Checkpoint Inhibitors. Diabetes. 2018;67(8):1471-1480. doi:10.2337/dbi18-0002
11. Avgerinos KI, Spyrou N, Mantzoros CS, Dalamaga M. Obesity and cancer risk: Emerging biological mechanisms and perspectives. Metabolism. 2019;92:121-135. doi:10.1016/j.metabol.2018.11.001
12. Bull CJ, Bell JA, Murphy N, et al. Adiposity, metabolites, and colorectal cancer risk: Mendelian randomization study. BMC Med. 2020;18(1):396. Published 2020 Dec 17. doi:10.1186/s12916-020-01855-9
13. Deng T, Lyon CJ, Bergin S, Caligiuri MA, Hsueh WA. Obesity, Inflammation, and Cancer. Annu Rev Pathol. 2016;11:421-449. doi:10.1146/annurev-pathol-012615-044359
14. Baumann BC, Mitra N, Harton JG, et al. Comparative Effectiveness of Proton vs Photon Therapy as Part of Concurrent Chemoradiotherapy for Locally Advanced Cancer. JAMA Oncol. 2020;6(2):237-246. doi:10.1001/jamaoncol.2019.4889
15.Sanchez A, Furberg H, Kuo F, et al. Transcriptomic signatures related to the obesity paradox in patients with clear cell renal cell carcinoma: a cohort study. Lancet Oncol. 2020;21(2):283-293. doi:10.1016/S1470-2045(19)30797-1
16. Wang Z, Aguilar EG, Luna JI, et al. Paradoxical effects of obesity on T cell function during tumor progression and PD-1 checkpoint blockade. Nat Med. 2019;25(1):141-151. doi:10.1038/s41591-018-0221-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#科学家发现#
57
#PD-L1#
41
#DC细胞#
52