引用本文
王笑笑,陈 曦,李敏敏,等. NOL8对口腔鳞状细胞癌细胞增殖、迁移及侵袭的影响[J]. 中国癌症杂志, 2023, 33(1): 45-53.
基金项目:山东省自然科学基金(ZR2020MH192);潍坊医学院博士启动基金(04103801);2021年山东省高等学校“青创人才引育计划”(基于多组学口腔癌分子流行病学研究创新团队)。
第一作者:王笑笑(ORCID: 0000-0001-7555-7477),学士,硕士在读。
通信作者:蒋英英(ORCID: 0000-0001-9671-7548),博士,教授。
NOL8对口腔鳞状细胞癌细胞增殖、迁移及侵袭的影响
王笑笑1,陈 曦1,李敏敏1,宋 宁1,孙冬瑗1,蒋英英1, 2
1.潍坊医学院口腔医学院,山东 潍坊 261053;
2.潍坊医学院附属医院口腔科,山东 潍坊 261035
[摘要] 背景与目的:口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部鳞状细胞癌中最普遍的亚型,其发病机制尚不清楚。核仁蛋白8(nucleolar protein 8,NOL8)作为RNA结合蛋白(RNA-binding protein,RBP),在多种肿瘤的发生、发展中发挥关键作用,但其在OSCC中的作用尚不清楚,本研究旨在探讨NOL8在OSCC中的表达水平,并研究其对OSCC细胞增殖、迁移、侵袭和上皮-间充质转化(epithelial-mesenchymal transition,EMT)的影响。方法:利用基因表达谱交互分析2(gene expression profiling interactive analysis 2,GEPIA2)、肿瘤免疫评估资源(tumor immune estimation resource,TIMER)、阿拉巴马大学伯明翰分校癌症数据分析(the University of Alabama at Birmingham cancer data analysis portal,UALCAN)及RNA相互作用数据库(the encyclopedia of RNA interactomes,ENCORI)在线分析NOL8在头颈鳞癌组织中的表达;采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测NOL8在OSCC细胞中的mRNA表达水平。利用siRNA干扰技术下调NOL8在CAL-27细胞中的表达,形成NOL8敲低组(si-NOL8-1,si-NOL8-2)及阴性对照组;通过慢病毒转染技术感染CAL-27及HN6细胞过表达NOL8,形成NOL8过表达组及阴性对照组。分别通过细胞计数试剂盒-8(cell counting kit-8,CCK-8)实验、划痕愈合试验及transwell实验检测NOL8表达水平变化后对OSCC细胞增殖、迁移和侵袭的影响;采用蛋白质印迹法(Western blot)检测NOL8表达水平改变后对EMT相关基因E-钙黏蛋白(E-cadherin)、波形蛋白(vimentin)和N-钙黏蛋白(N-cadherin)表达的影响。利用裸鼠皮下移植瘤模型探究NOL8在体内对OSCC细胞增殖的影响。结果:GEPIA2、TIMER、UALCAN及ENCORI在线分析显示,与头颈鳞癌的癌旁正常组织相比,NOL8在头颈鳞癌组织中表达升高;RTFQ-PCR结果显示,与正常对照细胞相比,NOL8在OSCC细胞系中的mRNA表达显著上调。转染si-NOL8-1及si-NOL8-2的CAL-27细胞中NOL8的相对表达量显著低于阴性对照组;敲低NOL8表达后,CCK-8实验、划痕愈合试验及transwell实验结果显示,CAL-27细胞增殖能力、细胞迁移率和细胞侵袭数明显降低。NOL8过表达的CAL-27及HN6细胞中NOL8的相对表达量显著高于对照组;NOL8过表达组中CAL-27及HN6细胞增殖能力、细胞迁移率和细胞侵袭数均显著高于阴性对照组。Western blot结果显示,在CAL-27细胞中,与敲低对照组相比,敲低NOL8后E-cadherin表达升高,N-cadherin和vimentin表达降低;在CAL-27及HN6细胞中,与过表达对照组相比,过表达NOL8后E-cadherin表达下降,N-cadherin和vimentin表达升高。裸鼠皮下移植瘤模型实验发现,与NOL8对照组相比,NOL8过表达组的皮下移植瘤重量显著升高。结论:NOL8在OSCC中高表达,可促进OSCC细胞的增殖、迁移和侵袭,该作用可能与EMT过程有关。
[关键词] 口腔鳞状细胞癌;核仁蛋白8;增殖;迁移;侵袭
[Abstract]Background and purpose: Oral squamous cell carcinoma (OSCC) is the most common subtype of head and neck squamous cell carcinoma (HNSCC), and its pathogenesis is unclear. Nucleolar protein 8 (NOL8), as one of the RNA-binding protein (RBP), plays a key role in the occurrence and development of many kinds of tumors, however its role in OSCC is not clear. This study aimed to investigate the expression level of NOL8 in OSCC and its effects on the proliferation, migration, invasion and epithelial-mesenchymal transition (EMT) of OSCC. Methods: The expression of NOL8 in HNSCC was analyzed online by gene expression profiling interactive analysis 2 (GEPIA2), tumor immune estimation resource (TIMER), the University of Alabama at Birmingham cancer data analysis portal (UALCAN) and the encyclopedia of RNA interactomes (ENCORI). The mRNA expression level of NOL8 in OSCC cells was detected by real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR). siRNA interference technique was used to knock down the expression of NOL8 in CAL-27 cells to form NOL8 knockdown group (si-NOL8-1, si-NOL8-2) and negative control group. CAL-27 and HN6 cells were overexpressed with NOL8 by lentivirus transfection technique to form NOL8 overexpression group and negative control group. Cell counting kit-8 (CCK-8) assay, scratch healing assay and transwell assay were used to detect the effect of NOL8 expression on the proliferation, migration and invasion of OSCC cells. Western blot assay was used to detect the effect of NOL8 on the expression of EMT-related genes including E-cadherin, vimentin and N-cadherin. The effect of NOL8 on the proliferation of OSCC cells in vivo was examed by xenograft formation assays. Results: The online analysis of GEPIA2, TIMER, UALCAN and ENCORI showed that the expression of NOL8 was higher in HNSCC than in normal tissues, and the expression of NOL8 in OSCC was significantly higher than in normal control cells. The relative expression of NOL8 in CAL-27 cells transfected with si-NOL8-1 and si-NOL8-2 was significantly lower compared with the negative control group. The results of CCK-8 assay, scratch healing assay and transwell assay showed that the proliferative ability, cell migration rate and invasion number of CAL-27 cells were significantly decreased after knockdown of NOL8 expression. The relative expression of NOL8 in CAL-27 and HN6 cells transfected with NOL8 was significantly higher compared with the control group. The proliferative ability, cell migration rate and invasion number of CAL-27 and HN6 cells in the overexpression NOL8 group were significantly higher compared with the negative control group. The results of Western blot showed that in CAL-27 cells, the expression of E-cadherin increased and the expressions of N-cadherin and vimentin decreased after NOL8 knockdown, while in CAL-27 and HN6 cells, the expression of E-cadherin decreased and the expressions of N-cadherin and vimentin increased after NOL8 overexpression. The xenograft formation assays showed that the weight of tumor was significantly higher in NOL8 overexpression group than in NOL8 control group. Conclusion: NOL8 is highly expressed in OSCC and can promote the proliferation, migration and invasion of OSCC, which may be related to the process of EMT.
[Key words] Oral squamous cell carcinoma; Nucleolar protein 8; Proliferation; Migration; Invasion
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部常见的鳞状细胞癌,其病因包括吸烟、饮酒及人乳头状瘤病毒(human papilloma virus,HPV)感染等[1-2]。对于早期OSCC患者,手术和放疗是肿瘤根治的两种主要方法[3]。而对于晚期患者,由于OSCC复发率高,5年生存率仅58%[4-5]。因此,了解OSCC的分子特征,寻找有希望的治疗靶点,对早期发现OSCC、改善患者预后具有重要意义。
核仁蛋白8(nucleolar protein 8,NOL8)是一种基因编码蛋白质,与胃癌、结直肠癌、前列腺癌的发生密切相关[6-8]。作为RNA结合蛋白(RNA-binding protein,RBP),可能参与肿瘤细胞转录后水平的基因表达调控和核糖体的生物发生[9-11]。然而NOL8在OSCC中的作用及其机制目前仍不清楚。
本研究主要探究NOL8在OSCC细胞中的表达情况,观察NOL8表达水平变化后对OSCC细胞增殖、迁移、侵袭和上皮-间充质转化(epithelial-mesenchymal transition,EMT)的影响,旨在为OSCC机制的研究和诊断治疗提供新的线索。
1
材料和方法
1.1 细胞培养和主要试剂
OSCC细胞系HN6和CAL-27由上海交通大学医学院附属第九人民医院赠予,正常对照细胞由口腔黏膜上皮细胞原代培养。HN6和CAL-27培养于DMEM高糖培养基,含10%胎牛血清、2%青霉素-链霉素,细胞置于37℃、CO2体积分数为5%、相对饱和湿度的培养箱中培养。DMEM高糖培养基、胎牛血清、青霉素-链霉素双抗溶液均购自天津市灏洋生物制品科技有限责任公司,0.25%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)胰蛋白酶溶液购自苏州新赛美生物科技有限公司,TRIzol试剂购自武汉艾瑞科生物科技有限公司;反转录试剂盒、实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自日本TaKaRa公司,Lipo8000TM转染试剂购自上海碧云天生物技术有限公司,脱脂奶粉购自广州赛国生物科技有限公司,matrigel基质胶购自美国Corning公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本株式会社同仁化学研究所,二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、NOL8均购自美国Thermo Fisher Scientific公司,磷酸缓冲盐溶液(phosphate-buffered saline,PBS)、含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline with Tween-20,TBST)均购自北京索莱宝科技有限公司,Ki-67、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)及β-actin抗体均购自英国Abcam公司,波形蛋白(vimentin)、HRP Goat Anti-Rabbit IgG二抗均购自美国Cell Signaling Technology公司。
1.2 实验方法
1.2.1 数据库在线分析
应用基因表达谱交互分析2(gene expression profiling interactive analysis 2,GEPIA2)(gepia2.cancer-pku.cn)[12]、肿瘤免疫评估资源(tumor immune estimation resource,TIMER)(https://cistrome.shinyapps.io/timer/)[13]、阿拉巴马大学伯明翰分校癌症数据分析(the University of Alabama at Birmingham cancer data analysis portal,UALCAN)(http://ualcan.path. uab.edu)[14]及RNA相互作用数据库(the encyclopedia of RNA interactomes,ENCORI)(http://starbase.sysu.edu.cn)[15]在线分析NOL8在头颈部鳞癌组织中的表达情况。GEPIA2数据库使用“Expression DIY”下的“Box plot” 进行检索,设置条件为:① Gene:NOL8;② Cancer:HNSC。TIMER数据库使用“Diff Exp” 进行检索,设置条件为:① Gene Symbol:NOL8;② Cancer:HNSC。UALCAN数据库使用“TCGA”进行检索,设置条件为:① Gene:NOL8;② Cancer:HNSC;③ Analysis:Expression。ENCORI数据库使用“Pan-Cancer” 下的“Gene Differential Expression”进行检索,设置条件为:① Gene:NOL8;② Cancer:HNSC;③ Chart type:Box plot;④ Data scale:log2-scale。
1.2.2 RNA提取、反转录及RTFQ-PCR实验
用TRIzol法提取细胞的总RNA,使用反转录试剂盒进行反转录。使用RTFQ-PCR试剂盒进行目的基因扩增,反应条件为:预变性(循环数1次):95℃ 30 s;PCR(循环数40次):95℃ 3 s,60℃ 30 s。NOL8引物正向序列为5’-GTCAGCCCTCAGTCATGGATT-3’,反向序列为5’-CACACGAAGGCAGTTTTTCATC-3’;β-actin正向序列为5’-CATGTACGTTGCTA TCCAGGC-3’,反向序列为5’-CTCCTTAATGT CACGCACGAT-3’。
1.2.3 细胞转染实验
由广州锐博生物科技有限公司设计合成NOL8小干扰RNA,分别为实验组(si-NOL8-1,si-NOL8-2)和阴性对照组,si-NOL8-1靶序列为5’-GCAACAGGCTGCACAAAAA-3’,si-NOL8-2靶序列为5’-GGAGTGGATTTCCATATGA-3’。将细胞放于6孔板中,细胞密度为60%~80%,24 h后应用Lipo8000TM试剂配制转染体系,混合后静置20 min,轻滴入6孔板中,放于37℃、CO2体积分数为5%的培养箱中培养24 h后,采用RTFQ-PCR进行敲低效率检测,并进行后续实验。
由汉尹生物科技(上海)有限公司设计合成NOL8慢病毒过表达载体,分为实验组(NOL8)和阴性对照组。将细胞放于6孔板中,细胞密度为20%~30%,24 h后每孔加入10 mg/mL聚凝胺进行NOL8过表达慢病毒转染。于37℃、CO2体积分数为5%的培养箱中培养72 h后更换含10 μg/mL嘌呤霉素的培养基,筛选2~3次建立NOL8过表达慢病毒稳定表达的细胞株。
1.2.4 CCK-8实验
将转染的细胞计数后以1×103个细胞/孔的密度接种于96孔板中,每组3个复孔,置于37℃、CO2体积分数为5%的培养箱中,每天定时加入CCK-8试剂,再置于培养箱中培养2 h后,使用多功能酶标仪测定450 nm处的吸光度(D)值,连续检测5 d。
1.2.5 划痕愈合实验
将细胞接种于6孔板中,转染后待细胞密度达到100%后,行划痕操作,1×PBS冲洗后,在显微镜下于0、24及48 h观察记录划痕愈合情况。
1.2.6 Transwell实验
将matrigel基质胶均匀铺于transwell上室中,用于细胞侵袭实验。细胞转染后,用无血清DMEM高糖培养基重悬并计数,在transwell上室内接种5×104个细胞/200 μL,下室内加入600 μL含10%胎牛血清的培养基,放入37℃、CO2体积分数为5%的培养箱中培养24~48 h后,4%多聚甲醛溶液固定,0.5%结晶紫染色,擦去未侵袭的细胞,随机选取5个视野在显微镜下观察拍照。
1.2.7 蛋白质印迹法(Western blot)实验
细胞转染48 h后,PBS冲洗细胞3次,加入全细胞裂解液裂解细胞,收集裂解液后于105℃金属浴中煮10 min,使用BCA试剂盒测定蛋白浓度,根据蛋白浓度加入十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液。然后进行配胶,上样,10%SDS-PAGE转膜。5%脱脂奶粉封闭后,一抗[E-cadherin(1∶1 000)、N-cadherin (1∶1 000)、vimentin(1∶1 000)、β-actin(1∶1 000)]4℃温育过夜。第2天二抗室温温育1 h,最后用电化学发光(electrochemical luminescence,ECL)超敏发光液在凝胶成像系统上显影,成像后用Image J软件进行灰度值分析。
1.2.8 裸鼠皮下移植瘤模型
选用BALB/c 4周龄裸鼠构建皮下移植瘤模型。分别收集NOL8过表达及对照组CAL-27细胞2×107个/mL,于裸鼠下肢两侧背部皮下注射100 μL细胞悬液,每3~5 d观察移植瘤的生长。3周后结束观察并将裸鼠安乐死,取肿瘤组织拍照并称重。此外,将瘤体于4%多聚甲醛溶液中固定24 h,经脱水、石蜡包埋、切片后进行H-E染色,并使用Ki-67抗体进行免疫组织化学(immunohistochemistry,IHC)染色,在显微镜下观察并拍照。
1.3 统计学处理
使用GraphPad Prism 8.0软件对所有数据进行统计,计量资料均以x±s表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2
结 果
2.1 NOL8在OSCC组织及细胞系中的表达情况
TIMER、GEPIA2、ENCORI及UALCAN数据库在线分析显示,在头颈部鳞癌中,与癌旁正常组织相比,NOL8在头颈部鳞癌组织中的表达明显上调(图1A~1D)。RTFQ-PCR实验检测NOL8在3种细胞系中的表达情况,与正常口腔黏膜细胞相比,NOL8在OSCC细胞系HN6、CAL-27中的表达水平较高(图1E)。

图1 NOL8在OSCC组织及细胞系的表达情况
Fig. 1 The relative expression of NOL8 in OSCC tissues and cell lines
A: TIMER database showed the expression of NOL8 in head and neck squamous cell carcinoma and adjacent normal tissues from green box. B: Expression of NOL8 in HNSC shown in GEPIA2 database; T: Tumor; N: Nornal. C: NOL8 expression in HNSC shown from ENCORI database. D: UALCAN database showed the expression of NOL8 in HNSC. E: RTFQ-PCR assay was used to detect the expression of NOL8 in HN6, CAL-27 and normal cell. *: P<0.05; **:P<0.01; ***: P<0.001.
2.2 敲低NOL8表达对OSCC细胞增殖能力的影响
RTFQ-PCR实验结果显示,si-NOL8-1、si-NOL8-2的相对表达量明显低于阴性对照组(图2A)。CCK-8实验检测结果显示,转染NOL8小干扰RNA后CAL-27细胞增殖能力显著降低(图2B)。
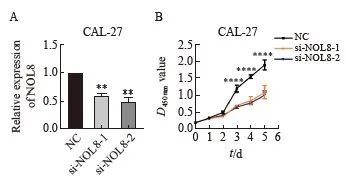
图2 敲低NOL8表达对OSCC细胞增殖能力的影响
Fig. 2 Effect of knocking down NOL8 expression on the cell proliferation of OSCC
A: The relative expression of NOL8 in the CAL-27 cells was detected by RTFQ-PCR after knocking down NOL8. B: CCK-8 assays were used to detect the proliferation ability of CAL-27 cells after NOL8 knockdown. **: P<0.01, compared with NC; ****:P<0.000 1, compared with si-NOL8-1 and si-NOL8-2.
2.3 敲低NOL8表达对OSCC细胞迁移及侵袭能力的影响
划痕愈合实验结果显示,48 h时si-NOL8-1、si-NOL8-2与阴性对照组细胞相比,敲低NOL8的表达可限制CAL-27细胞迁移能力(图3A)。Transwell实验结果显示,敲低NOL8表达后,CAL-27细胞的体外侵袭能力同样被抑制(图3B)。

图3 敲低NOL8表达对OSCC细胞的迁移及侵袭能力的影响
Fig. 3 Effect of knocking down NOL8 expression on cell migration and invasion of OSCC
A: Scratch healing assay showed that the migration ability of CAL-27 cells after NOL8 was inhibited. B: Transwell assay showed that the invasion ability of CAL-27 cells after NOL8 was inhibited. **:P <0.01, compared with NC; ****: P<0.0001, compared with NC; ***:P<0.001, compared with NC.
2.4 过表达NOL8对OSCC细胞增殖能力的影响
RTFQ-PCR实验结果显示,在CAL-27和HN6细胞中,NOL8过表达组(NOL8)的相对表达量明显高于阴性对照组(图4A);CCK-8实验检测结果显示,过表达NOL8组的CAL-27和HN6细胞增殖能力显著高于阴性对照组(图4B)。
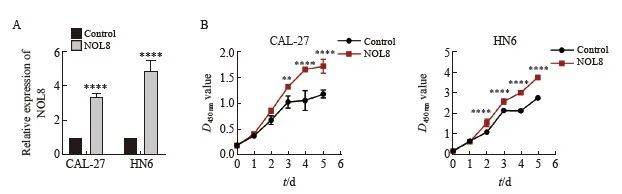
图4 过表达NOL8对OSCC细胞增殖能力的影响
Fig. 4 Effect of overexpression of NOL8 on cell proliferation of OSCC
A: The relative expression of NOL8 in the CAL-27 and HN6 cells was detected by RTFQ-PCR after over-expressing NOL8. B: CCK-8 assays were used to detect the proliferation ability of CAL-27 and HN6 cell after NOL8 was overexpressed. **:P<0.01, ****:P<0.000 1.
2.5 过表达NOL8对OSCC细胞迁移及侵袭能力的影响
划痕愈合实验结果显示,24 h时CAL-27及HN6细胞中NOL8过表达组的愈合率均高于阴性对照组(图5A)。Transwell实验结果显示,在过表达NOL8后,CAL-27及HN6细胞的体外侵袭能力增强(图5B)。
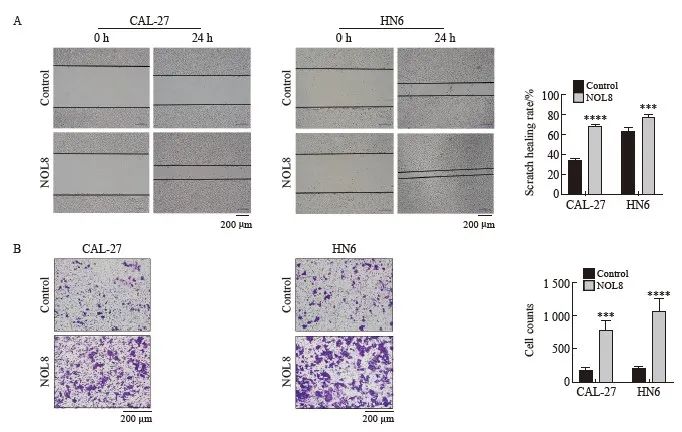
图5 过表达NOL8对OSCC细胞迁移及侵袭能力的影响
Fig. 5 Effect of overexpression of NOL8 on cell migration and invasion of OSCC
A: Scratch healing assay showed that the migration ability of CAL-27 and HN6 cells after overexpression of NOL8. B: Transwell assay showed that the invasion ability of CAL-27 and HN6 cells after overexpression of NOL8. ***: P<0.001, compared with control; ****: P<0.000 1, compared with control.
2.6 NOL8表达改变对OSCC细胞EMT的影响
Western blot实验结果显示,在CAL-27细胞中敲低NOL8表达后,E-cadherin蛋白的表达水平升高,而N-cadherin和vimentin蛋白的表达水平降低;在CAL-27及HN6细胞中过表达NOL8后, E-cadherin蛋白的表达水平降低,而N-cadherin和vimentin蛋白的表达水平升高(图6)。
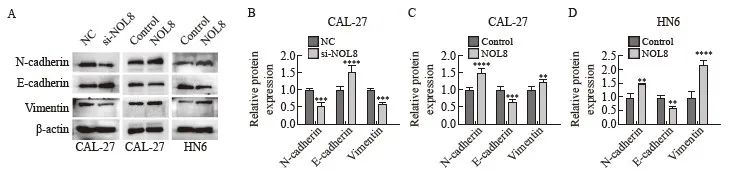
图6 NOL8表达改变对CAL-27和HN6细胞EMT相关蛋白的影响
Fig. 6 Effect of the change of NOL8 expression on EMT-related proteins in CAL-27 and HN6 cells
Western blot assay showed the protein level of N-cadherin, E-cadherin and vimentin after inhibition of NOL8 expression in CAL-27 cells and overexpression of NOL8 in CAL-27 and HN6 cells. **: P <0.01, compared with control; ***:P<0.001, compared with NC or control; ****: P<0.000 1, compared with NC or control.
2.7 NOL8表达改变对裸鼠皮下移植瘤生长的影响
裸鼠皮下移植瘤模型实验结果显示,NOL8过表达的CAL-27细胞形成的皮下移植瘤瘤体体积(图7A)及瘤重(图7B)均显著大于阴性对照组。通过瘤体组织H-E和Ki-67免疫染色进一步观察瘤体组织学形态,发现NOL8过表达CAL-27细胞的移植瘤生长较阴性对照组更迅速(图7C)。
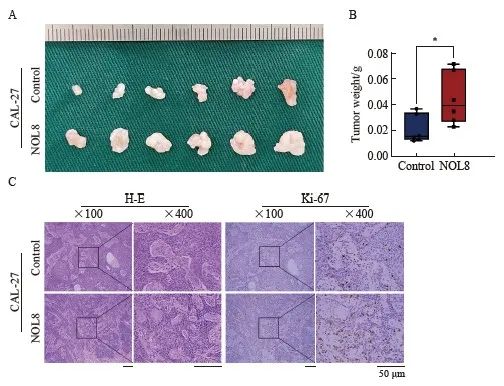
图7 NOL8表达改变对裸鼠皮下移植瘤生长的影响
Fig. 7 Effect of NOL8 expression on the growth of subcutaneously xenograft tumor in nude mice
A: OSCC xenograft tumor formed by CAL-27 cells after overexpression of NOL8. B: The weight of OSCC xenograft tumor. C: H-E and Ki-67 staining of OSCC xenograft tumor tissue of CAL-27 cells after overexpression of NOL8. *:P<0.05, compared with control.
3
讨 论
OSCC是世界范围内常见的人类恶性肿瘤,目前采用的手术、放疗、生物免疫等联合治疗取得了显著进展,但由于肿瘤复发率高,患者5年生存率低,寻找新的OSCC预后预测标志物和治疗靶点对改善患者的诊断、治疗和预后至关重要[3,16]。
NOL8含有RNA识别基序,是一种RBP,能够在转录后水平调控基因表达,包括对mRNA前体的剪接和加工、mRNA的稳定性及其降解等过程[9,17]。既往研究表明,NOL8与多种类型癌症的生物学行为密切相关,如前列腺癌、胃癌和结直肠癌[6-8]。在前列腺癌中,NOL8高表达与前列腺癌低生存率相关,并且可以通过激活β-catenin/TCF信号通路促进EMT,进而促进前列腺癌细胞迁移和侵袭[6]。此外,NOL8与结直肠癌的临床预后也有关[7,18]。NOL8不仅通过促进细胞迁移和侵袭发挥促癌作用,还可以通过促进细胞凋亡从而发挥在弥漫性胃癌中的抑癌作用[8]。本研究通过数据库分析发现,NOL8在OSCC组织及细胞系中表达显著上调,表明其可能与肿瘤的发生、发展进程具有密切联系。通过体内外功能实验发现,NOL8高表达可以显著提高OSCC细胞增殖、迁移及侵袭能力。
OSCC转移率高,其转移往往与肿瘤迁移和侵袭有关,进一步探究OSCC转移的相关机制至关重要[16]。研究[19-20]发现,EMT在OSCC侵袭和转移中发挥关键作用,能够诱导恶性肿瘤细胞侵袭,EMT过程的癌细胞的外形及内部分子都发生了变化,其中上皮性标志物(E-cadherin)表达减少和间质标志物(N-cadherin、vimentin)表达增加能够促进肿瘤的侵袭及转移。有研究[19]发现,Wnt/β-catenin和Notch通路等可以通过诱导EMT来促进癌症转移。此外,NOL8可以调控转录后水平的基因表达,如对mRNA前体hnRNA的剪接加工和mRNA的稳定性及其降解等过程[17]。进一步研究显示,敲低NOL8可以上调E-cadherin的表达水平和下调N-cadherin、 vimentin的表达水平,而过表达NOL8则结果相反,表明NOL8可促进OSCC细胞EMT的发生。初步判断NOL8可以通过诱导EMT发生进而影响OSCC细胞迁移及侵袭能力,但其参与和调控这一过程的具体机制有待进一步研究。
综上所述,NOL8在OSCC组织及细胞中表达上调,并可以促进OSCC细胞增殖、迁移和侵袭,NOL8还能够诱导OSCC细胞EMT的发生。本研究证实,NOL8作为OSCC的致癌因子,可能为OSCC的发生、发展机制研究提供新的思路,为OSCC的防治提供新的线索。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言