Am J Clin Dermatol:Dupilumab治疗青少年中重度特应性皮炎的长期有效性和安全性研究
2022-12-10 医路坦克 MedSci原创 发表于上海
本研究报道了在参加过dupilumab试验的中重度AD青少年患者中dupilumab的长期安全性、有效性和药代动力学。

背景:对于患有未得到控制的中到重度特应性皮炎(AD)的青少年患者(年龄在≥12岁至18岁之间),与安慰剂相比,使用dupilumab 16周的治疗产生了显著的临床益处,且安全性可接受。然而,关于Dupilumab单抗在青少年AD患者中批准的剂量方案的长期数据缺乏。
目的:这项开放标签扩展研究(Liberty AD PED-OLE,NCT02612454)报道了在参加过dupilumab试验的中重度AD青少年患者中dupilumab的长期安全性、有效性和药代动力学。方法:按原研究方案入选的患者按体重为基础的方案(每周2 mg/kg或4 mg/kg)皮下注射Dupilumab单抗。修改方案后,患者每4周皮下注射杜匹单抗300毫克(Q4W),无论体重如何,新入选的患者开始服用杜匹单抗300 mg,Q4W。对Q4W方案临床反应不佳的患者(调查者的总体评估没有达到0/1),可以将其提高到批准的每2周200或300 mg的Duplumab剂量方案(体重<60或≥分别为60 kg)。免疫球蛋白A评分为0/1的患者在40周后持续维持12周,停用dupilumab,监测复发,如果需要,重新开始使用dupilumab。
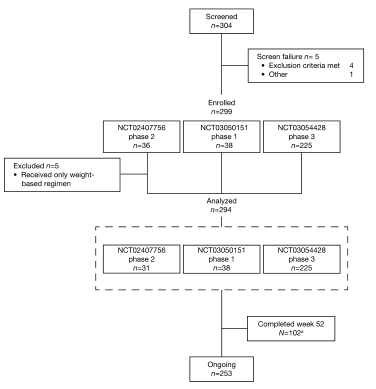
病人的情况。虽然102名患者完成了第52周的访问,但另有一名患者的部分数据(例如,IGA数据)可用于另一名未被正式视为完成52周的患者;103名患者的IGA数据已被纳入疗效分析。IGA调查员的全球评估
结果:分析了294例患者(平均年龄14.7岁)的资料,其中102例(34.7%)完成了52周的数据库访问。Dupiumab的长期安全性与成人相似,并与已知的安全性相一致。大多数治疗中出现的不良事件都是轻度/中度的。52周时,42.7%的患者IGA评分为0/1(清晰/几乎清晰),93.1%、81.2%和56.4%的患者湿疹面积和严重程度指数(EASI)至少有50%、75%或90%的改善。大多数(70.9%)的患者需要在批准的dupiumab剂量方案的基础上增加滴度。随着时间的推移,IGA评分为0/1或EASI改善75%的升高患者的比例增加,在第一次上调治疗48周后,分别达到35.7%和51.9%。到52周时,29.4%的患者皮肤透明/几乎透明,持续12周,并已停止服药;56.7%的患者复发,随后在治疗时再次启动,平均重新启动时间为17.5(±标准差17.3)周。

开放标签扩展基线时的患者人口统计学和临床特征
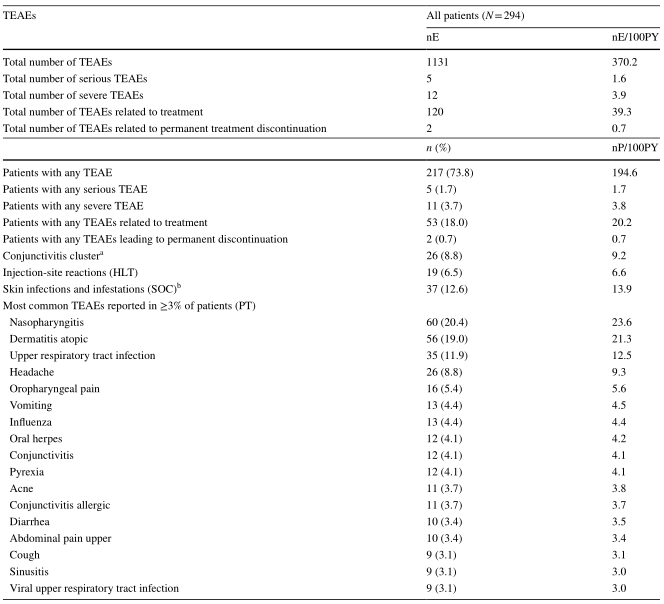
安全评估
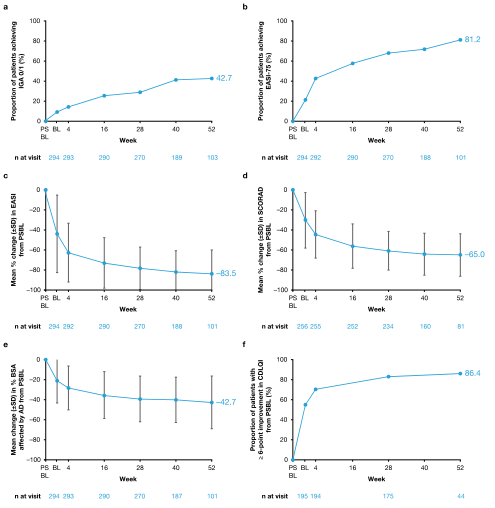
从PSBL到第52周的疗效结果。A达到(A)IGA0/1或(B)EASI-75的患者的比例,(C)EASI中从BL值到第52周的平均百分比变化,(D)总SCORAD和(E)BSA受影响,以及(F)CDLQIb从BL值改善6点的≥患者的比例。A102例患者在数据库锁定时完成了52周的访视。部分数据(例如,IGA数据)可用于另一名未被正式认为已完成52周的单一患者;103名患者的IGA数据被包括在疗效分析中。在52周时,101、101、81和44名患者分别接受了EASI、BSA、SCORAD和CDLQI评估。在R668-AD-1607中没有收集SCO RAD数据。R668-AD-1412和R668-AD-1607没有收集CDLQI数据。对于中到重度AD的青少年来说,CDLQI在患者内部6-8分的变化被认为是最小的临床有意义的差异。AD特应性皮炎,BL基线,BSA体表面积,CDLQI儿童皮肤病生活质量指数(范围0-30),EASI湿疹面积和严重程度指数,EASI-75,与PSBL相比EASI降低75%的患者,IGA调查者的全球评估,PSBL父母研究基线,≥评分特应性皮炎,SD标准差
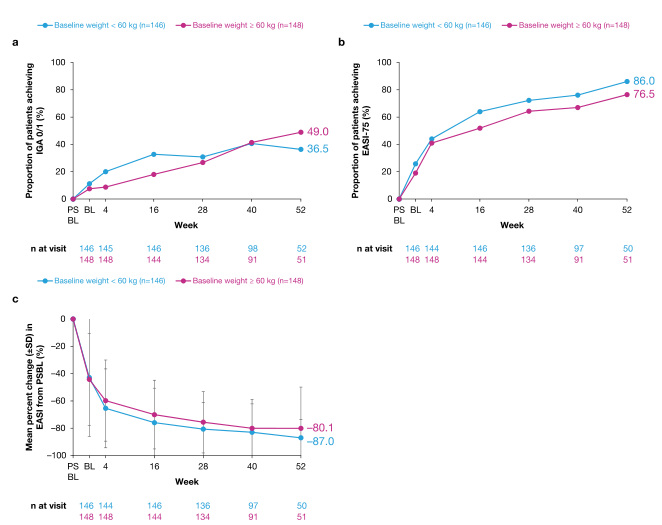
根据患者基线体重,从PSBL到第52周的疗效结果。达到(A)IGA 0/1或(B)EASI-75的患者比例,以及(C)EASI的平均变化百分比。≥基线、EASI湿疹面积和严重程度指数、EASI-75患者EASI与PSBL相比EASI降低75%、IGA研究人员全球评估、PSBL父母研究基线、SD标准差

(A)达到(A)IGA 0/1或(B)EASI-75的升高患者的比例,以及(C)在升高的患者中,EASI从PSBL变化的平均百分比。BL基线,EASI湿疹面积和严重程度指数,EASI 75名患者从PSBL获得EASI减少75%,IGA研究人员的全球评估,PSBL父母研究基线,SD标准差,U向上滴定时间
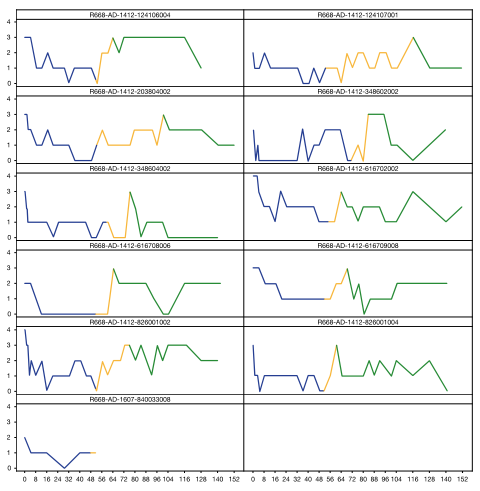
免疫球蛋白A评估复发的11a患者和重新开始使用dupiumabb。有17名患者复发,并在接受dupilumab治疗后重新启动;图中的数据是在重新启动后进行另一次IGA评估的11名患者的数据。B蓝色部分描绘了从基线到记录持续超过12周的免疫球蛋白0/1之前的最后一次dupilumab治疗的时间段;橙色部分描绘了从最后一次治疗在达到免疫球蛋白0/1水平之前持续超过12周的时间段,绿色部分描述了从重新开始dupilumab治疗到最后一次IGA评估的时间段。IGA调查员的全球评估
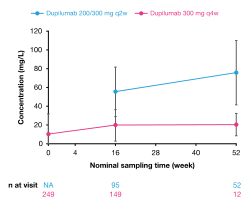
在0、16和52周时,血清中功能性DUPILUMA的平均浓度(±标准差)。低于定量下限的浓度被设置为0。来自父母研究R668-AD-1526或R668-AD-1607的患者如图所示。在研究期间,患者可能有资格接受向上滴定。治疗组由研究R668-AD-1434中第0周的初始给药剂量和在为后续访问收集样本之前接受的最后一次剂量来定义。NA不适用,Q2W每2周,Q4W每4周
结论:与短期治疗的结果一致,长期服用Dupilumab单抗显示出可接受的安全性,同时随着时间的推移,继续治疗可提供递增的临床益处。由于对Q4W剂量反应不佳而需要补血的患者比例很高,这支持Q2W剂量方案是该年龄段的最佳方案。最后,大多数患者在皮肤干净/几乎干净后停止服药超过12周,出现了疾病复发,这表明需要继续服用dupiumab以维持疗效。
文献来源:
Blauvelt A,Guttman-Yassky E,Paller AS,Long-Term Efficacy and Safety of Dupilumab in Adolescents with Moderate-to-Severe Atopic Dermatitis:Results Through Week 52 from a Phase III Open-Label Extension Trial(LIBERTY AD PED-OLE).Am J Clin Dermatol 2022 May;23(3)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言