FDA指南:以电子方式提交来自IND豁免BA / BE研究行业指南的快速安全报告
本指南为支持简化新药申请(ANDA)2而进行的研究性新药(IND)豁免生物利用度(BA)/生物等效性(BE)研究向FDA不良事件报告系统(FAERS)提交了快速个案安全报告(ICSR)的说明。
JAMA评论:FDA 成为科学、政治焦点
在当前任期内,美国最高法院将决定食品药品监督管理局(FDA)诉希波克拉底医学联盟(AHM)一案,该案挑战FDA对米非司酮的监管,这是美国一半以上堕胎中所涉及的药物。许多人已经注意到该案对生殖正义的明显
FDA“通过1项充分和良好对照的临床研究和确证性证据证明有效性的实质性证据的供企业用的指导原则”介绍
该指导原则描述了在评估1项充分且良好对照的临床研究和确证性证据是否足以证明有效性的实质性证据时,需要考虑的因素,还提供了确证性证据的数据类型的示例。
FDA批准伊立替康脂质体获批用于一线治疗转移性胰腺癌
2月13日,Ipsen(益普生)宣布FDA已批准Onivyde(伊立替康脂质体注射液)的补充新药申请(sNDA),用于与5-氟尿嘧啶/亚叶酸+奥沙利铂联用(NALIRIFOX方案),作为转移性胰腺导管
FDA“药物、生物制品和器械去中心化临床试验供企业、研究者和其他利益相关者用的指导原则”介绍
去中心化临床试验(DCT)是指在传统临床试验场所以外的场所进行部分或全部与试验相关活动的临床试验。详细介绍FDA该指导原则草案,期待对中国开展DCT及其监管有所益处。
FDA 指南:关于已批准/已批准医疗产品的未批准用途的科学信息,公司与医疗保健提供者的通信行业问答指南
本修订后的指南草案定稿后,将提供FDA目前对公司向医疗保健提供者(HCPs)通报已批准/已批准医疗产品未批准用途(SIUU)的19项科学信息的18个常见问题的看法。
美国FDA批准Livmarli治疗Alagille综合征(ALGS)相关胆汁淤积性瘙痒的药物!
Mirum Pharma是一家致力于开发创新疗法治疗罕见肝脏疾病的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已批准Livmarli(maralixibat)口服液,该药每日口服一次
2023上半年FDA批准肿瘤药物分析
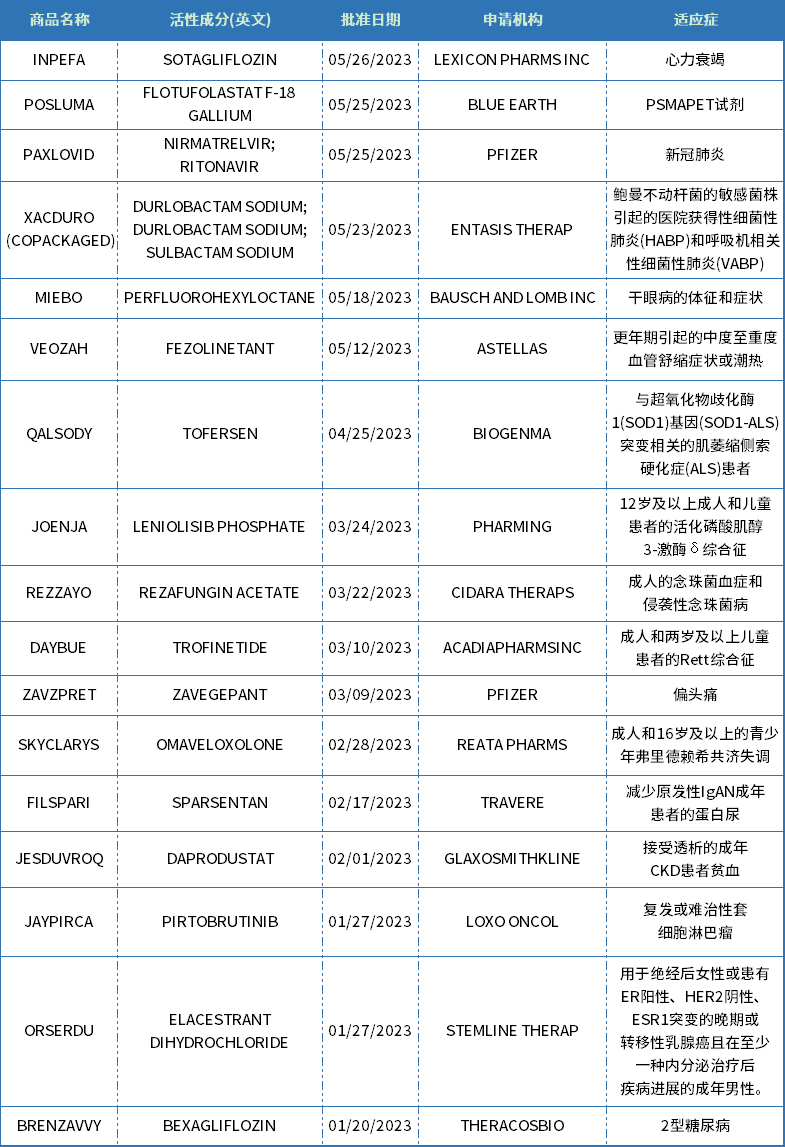
2023上半年,FDA共批准了26款新分子实体药物,其中针对肿瘤的共有6款(包括诊断试剂flotufolastat F 18,表1),占据了23%的份额。
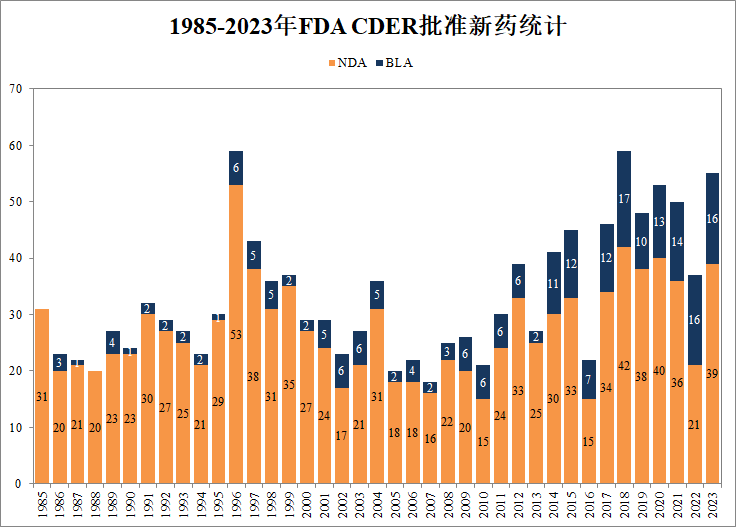
2023上半年,美国FDA批准了26款新分子实体上市
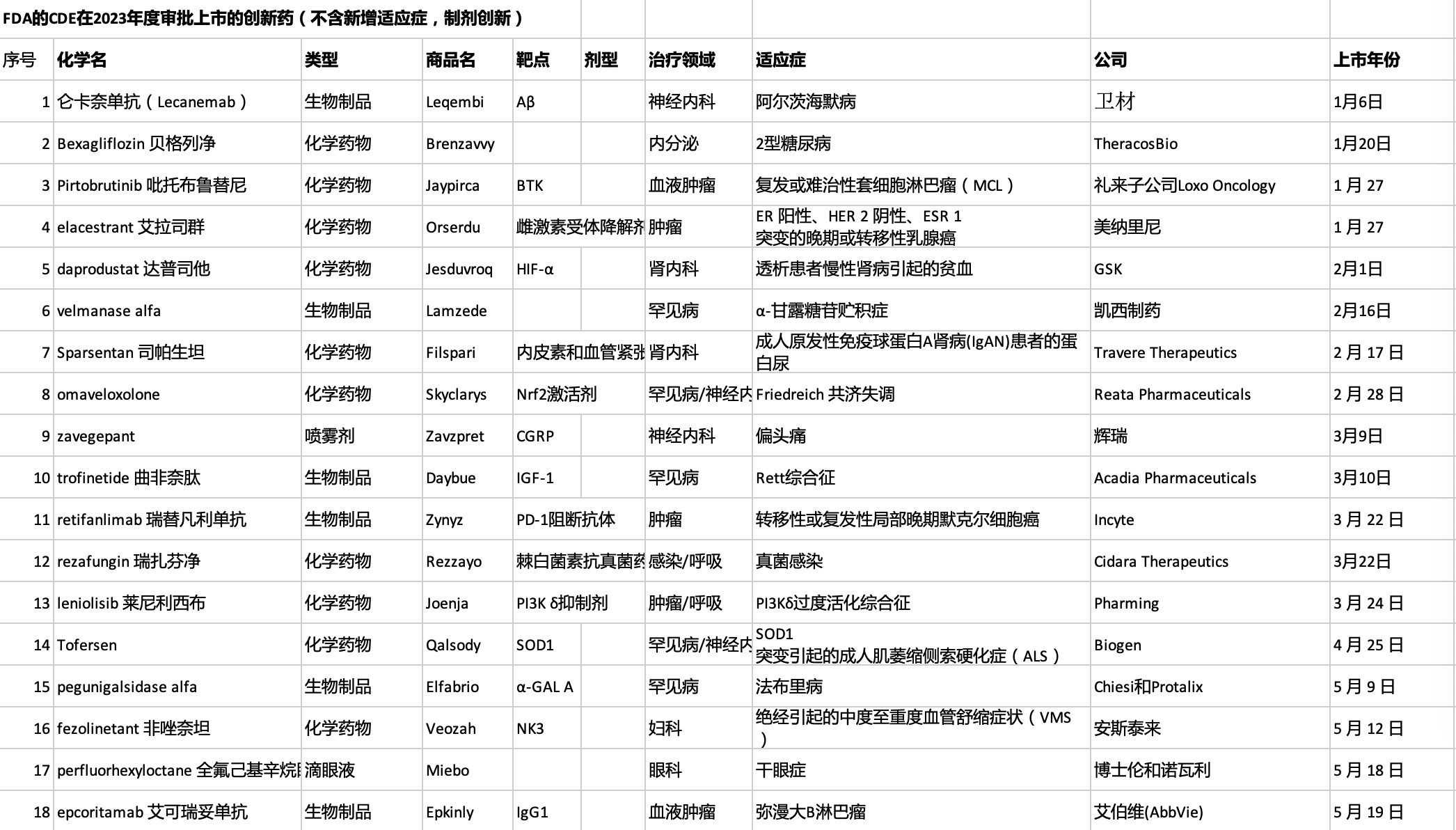
2023年,新药上市很抢眼,仅上半年美国FDA已批准26款新分子实体,此外还批准了多款细胞与基因疗法。截至7月1日,2023年美国药品审评中心(CDER)总计批准57项NDA申请和8项BLA申请,其中
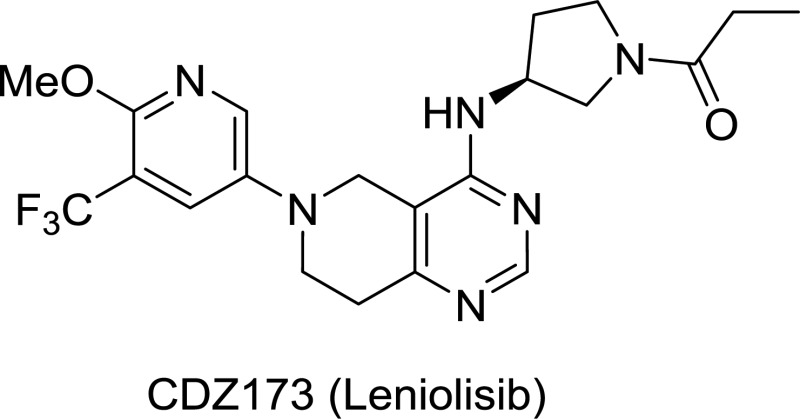
FDA已经批准PI3K抑制剂leniolisib上市,用于磷脂酰肌醇3-激酶δ综合征
3月24日,Pharming宣布FDA已经批准Joenja(leniolisib)上市,用于治疗12岁及以上患有磷脂酰肌醇3-激酶δ综合征(APDS)的成人/青少年患者。Joenja是一款