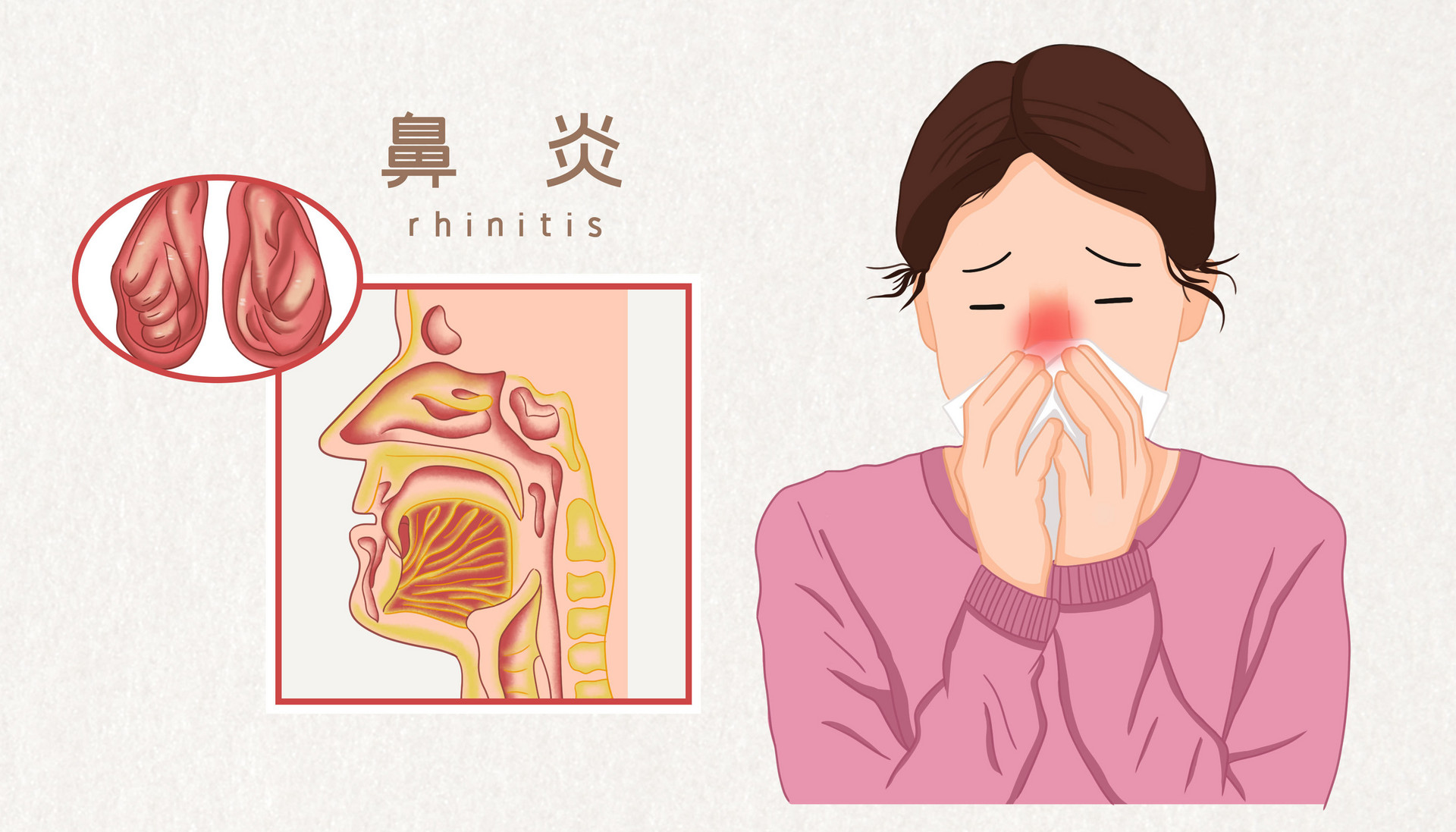
过敏性鼻炎治疗药物的研发【英文版】
本指南旨在帮助申办方研发治疗儿童和成人过敏性鼻炎治疗药物。指南内容包括在研发治疗季节性过敏性鼻炎(SAR)和常年性过敏性鼻炎(PAR)中试验设计,有效性,新药安全性的有关事项,安全性的定义。
慢性丙肝病毒感染:直接抗病毒治疗药物的研发【英文版】
本项指导原则旨在治疗慢性丙型肝炎(CHC)的直接作用抗病毒药物(DAA)的临床研发过程中帮助申办方,从临床前研究新药申请(pre-IND)到新药申请(NDA)和上市后阶段。
慢性丙肝病毒感染:直接抗病毒治疗药物的研发【中文版】
本项指导原则旨在治疗慢性丙型肝炎(CHC)的直接作用抗病毒药物(DAA)的临床研发过程中帮助申办方,从临床前研究新药申请(pre-IND)到新药申请(NDA)和上市后阶段。
对于使用病理组织学及相关方法支持生物标志物认定的考量-(含脚注)【英文版】
该指导原则旨在协助供鉴定生物标志物2的申报者开展非临床研究,在这些研究中将组织病理学手段用作参照或真实标准(Zhou 等 2011)。
对于使用病理组织学及相关方法支持生物标志物认定的考量-(含脚注)【中文版】
该指导原则旨在协助供鉴定生物标志物的申报者开展非临床研究,在这些研究中将组织病理学手段用作参照或真实标准(Zhou 等2011)。
骨质疏松症治疗药物的非临床评价【中文版】
本指南的目的是为行业界提供建议,设计非临床研究以支持预期治疗骨质疏松症的药物的批准。具体来说,本指南代表美国食品药品监督管理局(FDA)目前关于用于治疗骨质疏松症的生物药物的非临床开发计划的想法。
骨质疏松症治疗药物的非临床评价【英文版】
本指南的目的是为行业界提供建议,设计非临床研究以支持预期治疗骨质疏松症的药物的批准。具体来说,本指南代表美国食品药品监督管理局(FDA)目前关于用于治疗骨质疏松症的生物药物的非临床开发计划的想法。
药物和生物制剂,不包括疫苗上市后个别病例安全性报告的提交【英文版】
本技术规范文件旨在协助相关方向食品药品监督管理局(FDA或管理局)药品评价及研究中心(CDER)和生物评价及研究中心(CBER)电子提交个别病例安全性报告(ICSR)(和ICSR附件)。
药物和生物制剂,不包括疫苗上市后个别病例安全性报告的提交【中文版】
本技术规范文件旨在协助相关方向食品药品监督管理局(FDA或管理局)药品评价及研究中心(CDER)和生物评价及研究中心(CBER)电子提交个别病例安全性报告(ICSR)(和ICSR附件)。