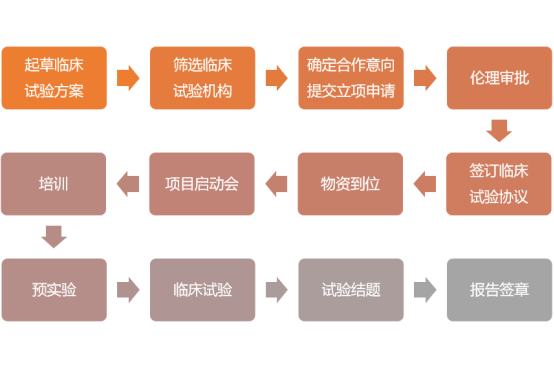
第一批古代经典名方发布 申报新药可免临床试验
古代经典名方目录制定的遴选范围界定为:1911年前出版的古代医籍。总体要求是:体现“目前仍广泛应用、疗效确切、具有明显特色及优势”;古代中有较多记载及医案证据,现代文献中有较多临床及实验研究报道;得到中医临床进一步凝练、权威专家广泛认可;各类中医药教材中广为收录等。中医经典医籍中汇载了大量的方剂,有很多方剂至今仍在临床广泛使用,
健康时报网 - 古代,经典,临床试验 - 2018-04-17
leronlimab(PRO 140)治疗新冠肺炎的II期临床试验方案获得IND
CytoDyn是开发leronlimab(PRO 140)(具有多种适应症治疗潜力的CCR5拮抗剂)的生物技术公司,今日宣布,已向美国FDA提交了研究性新药申请(IND)。
MedSci原创 - 新冠肺炎,leronlimab(PRO 140),CCR5拮抗剂 - 2020-03-09
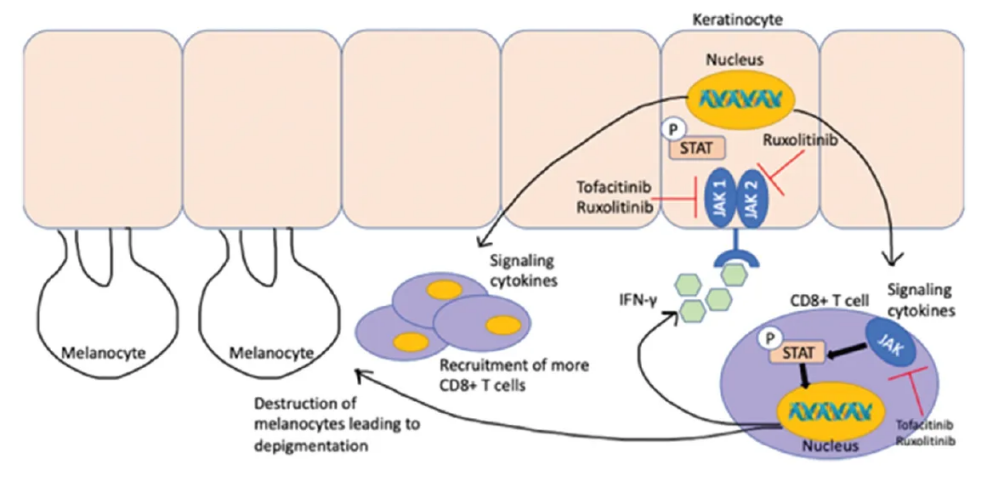
Ritlecitinib新药临床试验用于白癜风治疗
一项多中心、随机双盲、安慰剂对照的IIb期试验,评估了口服Ritlecitinib治疗活动性非节段性白癜风的有效性和安全性。
药师华子 - Ritlecitinib - 2023-08-07
信达生物的CD47单抗新药IBI188中国IND申报成功
2018年9月9日信达生物制药(Innovent Biologics)公司宣布其开发的CD47单抗(IBI188)已获国家医疗产品管理局(NMPA,前身为CFDA)批准用于临床试验。
MedSci原创 - CD47单抗,肿瘤免疫治疗,IND - 2018-09-10
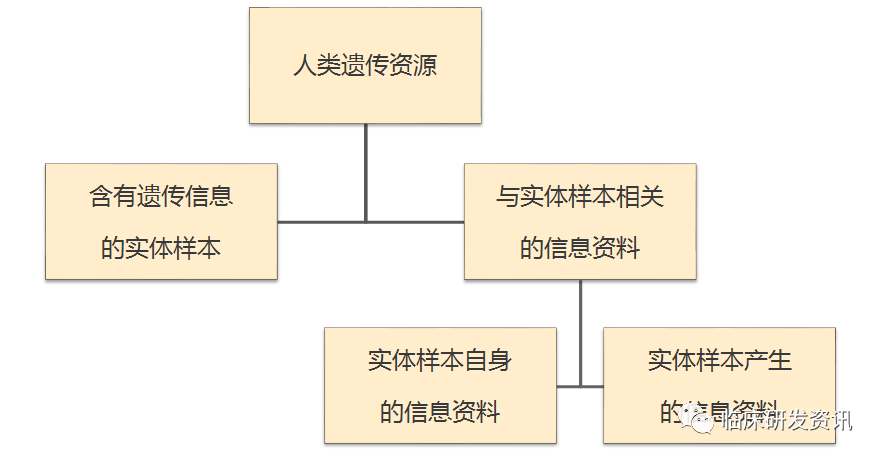
临床试验中的人类遗传资源优化流程第二版
在2016年10月发布了一期临床试验的遗传办及其操作流程之后,对各位小伙伴提供了少许帮助,本来以为这个申报流程不会成为常态或维持不久。但2017年12月1日起,科技部优化了一个遗传办的申报流程,那么基本上可以肯定遗传办的申报工作会在相当长的一段时间内,为推动临床试验事业的发展有着积极正面的影响。定位清晰了,我们就认真对待,@木木君根据人类遗传办的优化流程来更新一下人类遗传资源的申报。 人类遗
临床研发资讯微信号 - 临床试验,人类遗传,流程 - 2019-03-21
新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求
发布信息2003年5月美国FDA发布 翻译日期2009年6月分类 临床研究进程中相关的指导原则 标题新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求 附件1:http://www.cde.org.cn
MedSci原创 - 临床试验,申报 - 2014-03-13
临床试验的遗传办及其操作流程
2015年,在临床试验行业界,对于国内药企,传得沸沸扬扬的除开国家局的大动作核查,就是撤销;对于外资背景药企,除了自查就是遗传办的流程落实。那么我们看扒一扒这个神秘的“遗传办”和临床试验相关的内容。1 什么时遗传办?遗传办全称为:中国人类遗传资源管理办公室。
MedSci原创 - 临床试验,遗传办 - 2017-04-18
筹备申报药物临床试验(GCP)机构资格认定的关键环节
我国政府对实施临床试验的医疗机构实行资格准入制度,即临床试验必须在国家食品药品监督管理局 (SFDA)批准的临床试验机构进行。而医疗机构资格认定具有明确程序与标准[1],以保证医疗机构具备一定的条件和资质,降低申报者选择研究机构的盲目 性及受试者参加临床研究的风险[2]。一些实力较强的医疗机构或实力较为雄厚的专业因未申请机构认证而无法参加新药的临床试验,这是一种资源的浪费 [3]。作
华西医学 - GCP,临床试验 - 2014-03-03
美国临床试验数据库(ClinicalTrials)注册流程与填写要求
临床试验注册制度,指在临床试验实施前就在公共数据库公开试验设计信息,并跟踪和报告试验结果。临床试验注册制度不仅有利于增加临床试验信息的 透明度、减少发表偏倚,更有利于保障临床试验质量、增加试验过程的规范性和试验结果的可信度,已成为当今临床试验发展的主流趋势[1-2]。 我国中医药领域对临床试验注册的重视程度和实践情况不容乐观,以美国临床试验数据库(ClinicalTrials.gov)
中国中医药信息杂志 - 临床试验,注册 - 2014-03-03
新药临床试验方案设计的研究
新 药临床试验是药品上市前最重要的研究环节之一。新药在上市之前,需要进行I-Ⅲ期的临床试验;上市后,需进行Ⅳ期临床试验,I-Ⅳ期的临床试验是对药物的 疗效、安全性及风险效益进行科学性、真实性及可靠性的临床疗效与安全性的评价研究。I-Ⅲ期的新药临床试验的数据,需提供给国家食品药品监督管理局 (SFDA)审查,以此作为重要的依据,来决定该药上市与否。全面的、结构清晰的临床研究方案,应该包括研
中国临床药理学杂志 - 临床试验,方案 - 2014-08-09
如何开展新药临床试验:从GCP,SOP到临床试验管理和质量控制
GCP的原则与内容 GCP(Good Clinical Practice),即药物临床试验质量管理规范,它是临床试验过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。其目的是保证药品临床试验过程规范,结果科学可靠,保护受试者的权益并保障其安全。 一、GCP的发展过程 19世纪末化学制药工业的兴起,开创了化学药品开始用于临床治疗的新纪元。大量新药上市,一方面改善
上海交通大学医学院附属第九人民医院 - 新药,临床试验 - 2015-07-04
为您找到相关结果约500个