诺华Jakavi III期试验达主要终点
诺华3月7日宣布,有关Jakavi(ruxilitinib)的一项关键性III期RESPONSE研究,达到了维持红细胞压积(红细胞体积)受控而无需放血(phlebotomy,从身体中出去一些血液的一种程序
生物谷 - 新药,FDA - 2014-03-10
乳糜泻候选药物Larazotide 3期试验失败
6月21日,致力于为罕见或使人衰弱的消化系统疾病开发新疗法的,总部位于北卡罗来纳州9 Meters Biopharma公司表示,
MedSci原创 - 乳糜泻 - 2022-06-23
Lancet oncol:3期试验:度伐单抗治疗III期非小细胞肺癌
在3期PACIFIC试验中,与安慰剂相比,度伐单抗改善了不可手术切除的III期非小细胞肺癌患者的无进展存活期和总体存活率(主要结点)。本次分析主要对次要结点——患者报道的预后(PROs)进行评估。PACIFIC试验是一项正在进行的国际性多中心双盲的随机对照的3期试验,招募了年满18岁的病理学确诊的III期不可切除的非小细胞肺癌患者,既往至少接受过两个疗程的以顺铂为基础的放化疗,而且在此次治疗后病程
MedSci原创 - 非小细胞肺癌,度伐单抗,Pros - 2019-10-09
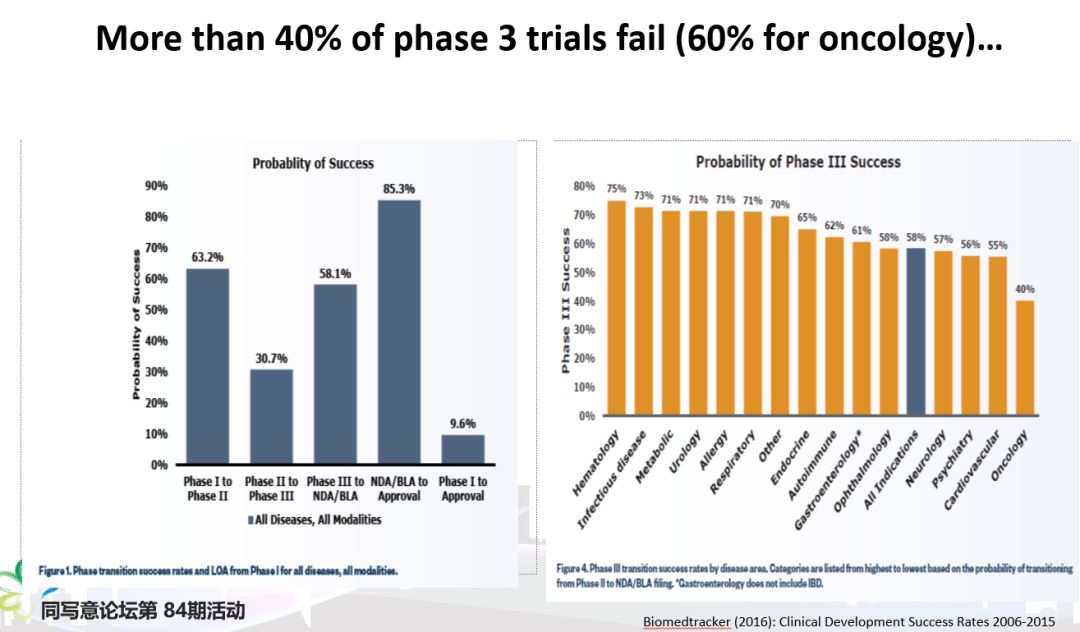
II期j临床试验成功而III期临床失败的案例教训
原因是美国创新药多,失败率高;而国内企业的临床试验,一方面是大多数还处于较早期的I期、II期临床阶段,进入III期较少,另一方面这些品类很多都是me-too或me-better,这类产品的临床成功率要高得多01临床试验是一个成功率很低的活动 新药临床试验是一个成功率很低的活动,药物从I期临床试
同写意 - 临床试验 - 2019-01-05
我国艾滋疫苗进入Ⅱ期临床试验
8月14日,由国家科技重大专项支持、我国拥有自主知识产权的艾滋病疫苗正式进入Ⅱ期临床试验,首批15名志愿者在北京佑安医院接受了疫苗接种。领衔该重大专项研究的中国疾病预防控制中心邵一鸣研究员称,此次临床试验主要目标是进一步评价该疫苗的安全性和免疫原性,并确定其免疫程序,从而为开展大规模检验疫苗有效性的临床试验作准备。据悉,这是世界上使用复制型活病毒载体研制的艾滋病疫苗首次进入Ⅱ期临床试验。
健康报 - 艾滋病,疫苗,临床试验 - 2012-08-15
Ⅳ期临床试验空前火热的背后
继美国FDA药品监管新政出台,要求药物申报者去完成Ⅳ期临床试验后,很多国家都尾随其后开展了这项监管工作。记者在近期采访时发现,目前某些并未要求完成Ⅳ期临床试验的产品也启动了这项工作。这意味着,在中国Ⅳ期临床试验的开展已经由被动变主动。有分析人士认为,其与学术推广密不可分。 收益率最高的研发投入
医药经济报 - 临床试验,FDA - 2014-07-18
ChemoCentryx公司开始CCX168Ⅱ期试验
美国生物技术公司ChemoCentryx近日启动了CCX168的Ⅱ期临床试验。CCX168是口服小分子药物,治疗目标是抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAV)。
CCX168 - 2011-11-06
对IV期临床试验的认识误区
临床试验方案详细描述了试验的背景、目的、设计,且从伦理学上、财政上、管理上、科学设计上做出了多方位的考虑,是临床试验的纲领性文件和新药临床试验能否取得成功的决定性因素国家食品药品监督管理局2003年9月1日颁布施行的《药物临床试验质量管理规范》(下简称GCP)第十六条指出“临床试验开始前应制定试验方案,该方案应由研究者与申
MedSci原创 - 临床试验,误区 - 2014-03-03
儿童中药新药Ⅳ期临床试验设计要点
Ⅳ 期临床试验为新药上市后应用研究阶段,是新药临床试验的一个重要组成部分,是上市前新药Ⅰ、Ⅱ、Ⅲ期临床试验的补充和延续,既可以验证上市前临床试验的结 果,也可以对上市前临床试验的偏差进行纠正,更重要的是可以弥补上市前临床试验缺乏的资料和信息儿童作为特殊群体在药品开 发研制中区别于成人,通过针对儿童的临床试验,来检测药物的安全性、有效性,为儿科合理用药提供依据
药物评价研究 - Ⅳ期,临床试验,设计 - 2014-08-09
新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求
发布信息2003年5月美国FDA发布 翻译日期2009年6月分类 临床研究进程中相关的指导原则 标题新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求 附件1:http://www.cde.org.cn
MedSci原创 - 临床试验,申报 - 2014-03-13
BMJ:非肿瘤临床一期试验风险量化
在人体进行药物临床试验的最大的道德挑战之一就是受试者暴露在风险之下而为了他人的利益。最为频繁提及的例子是在健康的志愿者身上实施的非肿瘤临床一期研究。临床一期试验是为了评价药物的安全性以及在后期临床试验所采取的合适剂量。为了定量评估参与非肿瘤临床一期试验的健康受试者的不良反应的发生频率和严重性,研究人员对受试者的数据进行meta分析。
MedSci原创 - 临床试验,不良反应 - 2015-06-27
为您找到相关结果约500个