FDA“主方案:加快抗肿瘤药物和生物制品开发的高效临床试验设计策略供企业用的指导原则”介绍
FDA发布的指导原则对抗肿瘤药主方案研究的试验设计和实施的诸多方面提出了许多很有价值的建议,而中国目前还没有类似的指导原则。详细介绍FDA该指导原则,以期对我国开展抗肿瘤药主方案研究及其监管有所帮助。
药物评价研究 - 抗肿瘤药物 - 2023-06-18
方案发布!上海拉开MAH试点工作大幕(附办理流程)
8月3日,上海市食品药品监督管理局制订的《上海市开展药品上市许可持有人制度试点工作实施方案》经过市政府同意正式挂网,上海市食药监管局还同时发布了《药品上市许可持有人申请办事指南》,并提出上海市将全力推进药品上市许可持有人制度改革试点落地此前,北京市食品药品监督管理局组织修订的《北京市开展药品上市许可持有人制度试点工作实施方案》已于7月
医药经济报 - MAH试点,上海,方案 - 2016-08-06
重庆口岸药品监督管理局将增设生物制品进口备案职能
1月18日,国家药监局官网发布关于同意重庆口岸药品监督管理局增设生物制品进口备案职能的批复(国药监药注函〔2019〕9号)。全文如下:
新浪医药新闻 - 重庆口岸药品监督管理局,生物制品,进口备案 - 2019-01-18
双特异性抗体KN026与KN046联合疗法获美国FDA孤儿药资格认定,用于治疗胃癌及胃食管连接部癌
12月23日,康宁杰瑞生物制药宣布,公司自主研发的双特异性抗体KN026(抗HER2双特异性抗体)与KN046(PD-L1/CTLA-4双特异性单域抗体)联合疗法获美国食品药品监督管理局(FDA)授予
医药魔方 - 胃癌,胃食管连接部癌 - 2020-12-23
FDA 指南:优化用于治疗肿瘤疾病的人用处方药和生物制品的剂量
美国食品药品监督管理局(FDA 或 Agency)宣布提供一份名为“优化用于治疗肿瘤疾病的人类处方药和生物制品的剂量”的行业指南草案。本指南旨在帮助申办者在提交新适应症和用途的
FDA - 生物制品,人用处方药 - 2023-01-20
4种H7N9流感病毒疫苗获准临床试验
16日,从北京市食药监局传出消息称,北京市研制的H7N9流感病毒裂解疫苗、H7N9流感病毒裂解疫苗(佐剂)、H7N9流感全病毒灭活疫苗、H7N9流感病毒裂解疫苗(30μg/剂)等4种H7N9流感防控药品,近日已经取得国家食品药品监督管理总局药物临床试验批件,获准进入临床试验阶段。
科技日报 - H7N9,疫苗 - 2017-02-17
吴浈:“疫苗沙皇”折戟
2018年是吴浈的本命年。这一年,他迈入花甲。原食品药品监管总局副局长吴浈被立案审查调查。同日,中央纪委国家监委官网发布消息称,吴浈“涉嫌严重违纪违法”,正接受纪律审查和监察调查。他也成为因长春长生问题疫苗事件首个被立案审查调查的省部级官员
中国新闻周刊 - 疫苗沙皇 - 2018-09-13
又一COVID-19潜在药物有望上市,GSK/Vir提交单抗VIR-7831紧急使用授权申请
近日,葛兰素史克(GSK)与Vir生物技术公司联合宣布,已向美国食品药品监督管理局(FDA)提交了单抗药物VIR-7831(GSK4182136)的紧急使用授权(EUA),拟用于治疗12岁以上(40公
生物探索 - 单抗VIR-7831,COVID-19潜在药物 - 2021-03-30
细胞治疗怎么走?政策法规全解析
1.国际经验借鉴 国际上细胞治疗技术是按照药品管理,必须严格进行一、二、三期临床试验。国际上多个发达国家和地区已经颁布了干细胞应用的相关法规。美国FDA颁布了用于全面管理HCT/P(Human Cell and Tissue based Products)生产过程的指导规范,即cGTP(current Good Tissue Products欧盟、日本和台湾地区也颁布了相应的法规。表1
生物谷 - 转化医学 - 2016-05-26
FDA“药物、生物制品和器械去中心化临床试验供企业、研究者和其他利益相关者用的指导原则”介绍
去中心化临床试验(DCT)是指在传统临床试验场所以外的场所进行部分或全部与试验相关活动的临床试验。详细介绍FDA该指导原则草案,期待对中国开展DCT及其监管有所益处。
药物评价研究 - FDA - 2024-01-22
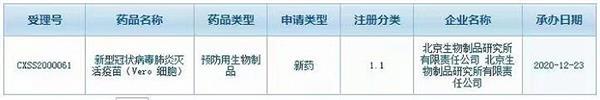
国药集团新冠疫苗国内上市申请获受理,有望在元旦前后上市
昨天,国家药监局药审中心( CDE )显示,国药集团北京生物制品研究所的新型冠状病毒肺炎灭活疫苗(Vero 细胞)上市申请已获CDE受理。据估计在元旦前后,CDE将会批准疫苗有条件上市。大家在元旦以后
网络 - 新冠疫苗 - 2020-12-24
FDA指导原则:支持人用药物和生物制品批准的临床试验富集设计策略
美国食品和药物管理局(FDA 或机构)宣布了一份题为“支持人类药物和生物产品有效性证明的临床试验浓缩策略”的行业最终指南。 本指南的目的是帮助行业制定可用于临床研究的富集策略,
FDA - 富集设计 - 2021-10-22
2011年我国批准上市一类新药增至10件
国家食品药品监督管理局日前发布了《2011年药品注册审批年度报告》(以下简称《报告》),2011年,共批准药品注册申请718件,较2010年的批准数量减少了282件。其中,批准新药的数量增加,1.1类化学药品共批准10件,相比过去两年有显著增长。 药品注册,是国家食品药品监督管理局依照《药品管理法》的规定,根据药品注册申请人的申请,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,
经济参考报 - 报告,国家药监局,国家食品药品监督管理局 - 2012-10-16
药监局加强药用玻璃包装注射剂药品监督管理
根据药品监督检查信息,部分注射剂类药品与所选用的药用玻璃存在相互作用,影响药品质量,造成一定安全隐患。 11月8日,为保证产品质量,保障公众用药安全,国家食品药品监督管理局就加强药用玻璃包装注射剂 style=color:blue >玻璃包装注射剂药品监督管理有关事项发布了通知。 一、药品生产企业必须切实对所生产的产品质量负责。注射剂产品与所用药用玻璃的相容性研究应符合国家食
国家食品药品监督管理局 - 玻璃包装注射剂,药品生产企业,玻璃包装,药品质量,包装材料 - 2012-11-16
为您找到相关结果约500个