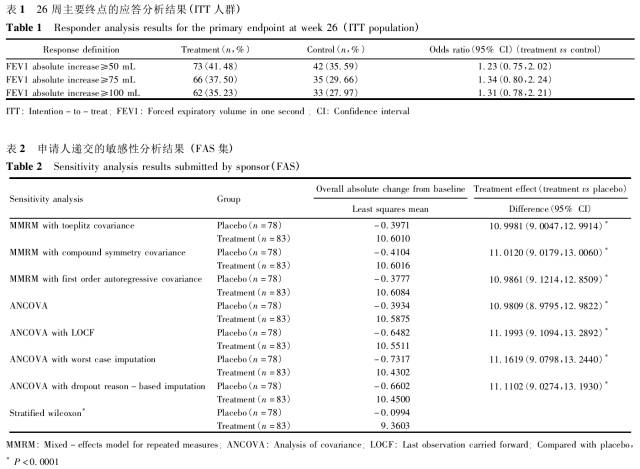
药审中心:临床试验缺失数据的统计学考量
缺失数据是临床试验中常见的重要问题,可能引起试验结果难于解释,甚至影响整个试验的推断和结论,但目前在国内临床研究中尚未引起足够的重视。实际应用中,申请人对待缺失数据的处理存在盲口应用统计学方法的现象,给新药安全有效性的评价和确证带来诸多困难。本文针对三个实际案例进行深入地阐述和分析,探讨对缺失数据的预防、估训一量的选择、缺失数据的统训一分析方法以及敏感性分析等,以期有助于申请人在临床试验中加强
中国临床药理学杂志 - 临床试验,缺失数据 - 2016-06-18
单组目标值(OPC)临床试验的统计学考虑
作者:中国临床试验生物统计学组(CCTS) 李卫,赵耐青(执笔) 来源:中国卫生统计 2017年6月 第34卷第3期 随机对照临床试验(randomized controlled trial,RCT)是临床研究的金标准,药物/医疗器械临床研究中,尤其是提供关键证据的临床研究中一般均采用RCT。在极少数的医疗器械临床试验中,如采用随机对照试验,会存在伦理学风险,致使临
中国卫生统计 - 单组目标值 - 2019-01-29
CDE和注册司专家发文:基于风险的监查(RBM)应用和挑战
作者:苏娴a,崔孟珣b(国家食品药品监督管理总局 a.药品审评中心,b.药品化妆品注册管理司,北京 100038) 来源:中国新药与临床杂志 2018年6月 第37卷第6期 摘要:本文结合国际人用药品注册技术要求协调会(ICH)及美国食品和药物管理局(FDA)关于基于风险的监查(RBM)的指南,概述RBM的目的及在不同类型临床试验中的应用,介绍目前实施RBM方法的流程,包括
中国新药与临床杂志 - CDE,风险的监查 - 2018-08-16
重磅!疫苗“一致性评价”来了
今日(12月24日),为进一步规范和提高疫苗临床研发水平,加强疫苗质量安全监管,国家药监局印发《预防用疫苗临床可比性研究技术指导原则》(以下简称指导原则)。
医谷 - 疫苗,一致性评价 - 2019-12-24
你请统计学家来做尸体解剖吗?
论文的死法有上千种,但有一种死法你不能喊冤。这篇文章的结论主要是说采用NCL60细胞系的基因芯片数据可以确定化疗药物反应特征,以预
MedSci原创 - 临床研究,统计学,医学统计,论文写作 - 2015-10-10
免于进行临床试验的体外诊断试剂临床评价资料基本要求发布
为进一步做好体外诊断试剂注册管理,规范免于进行临床试验的体外诊断试剂临床评价工作,根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号),8日国家食品药品监督管理总局发布了《免于进行临床试验的体外诊断试剂临床评价资料基本要求
新浪医药新闻 - 体外诊断试剂,免于进行临床试验 - 2017-11-09
ICH E9临床试验的统计学指导原则解析
ICH E9 Statistical principles for clinical trials (临床试验的统计学指导原则)可谓生物统计师的bible,目的在于协调欧洲、日本和美国在进行药品上市申请的临床试验时所应用的统计学方法的指导原则虽说中国是协调三方之外的国家,SFDA还为此另外制定了自己的《化学药物和生物制品临床试验的生物统计学技术指导原则》,但其内容基本还是照抄翻译了ICH E9的
MedSci原创 - ICH,E9,临床试验,统计 - 2012-05-28
我国临床试验生物统计学指导原则与国际ICH E9比较研究
《ICH Harmonised Tripartite Guideline Statistical Principles ClinicalTrails E9》(以下简称“ICH E9”)是在人用药品注册技术要求国际协调会议的赞助下制定,目的从统计学原理和方法出发,向申办者和专家提供建议,以便有助于为申请新药入市而作的临床 试验的分析和结论得到公认。现主要用于欧盟日本及美国管理当局的
中国卫生统计 - 生物统计,ICH,E9 - 2014-08-09
多中心临床试验中中心校正的统计学实现(SPSS)
多中心临床试验可以在较短的时间内招募到足够多的病例数,同时,来自多中心的病例比来自单中心的病例更具有代表性,可以使所得结论的应用面更广泛。但由于各中心的试验条件不完全相同,所得结论也不尽相同。因此, 在评价疗效时, 必须考虑中心间效应的差别。当中心间差距较大时,如果直接合并各中心资料,可能会对总的结论有一定影响。这里涉及到两个问题,其一是评价中心效应是否存在,其二是如何扣除中心效应的影响对疗效进行
MedSci原创 - 中心校正,SPSS - 2013-11-19
适应性临床试验设计特点与介绍
众所周知,新药的研发是一个充满变数且不断做出复杂决断的过程,这就要求试验设计应该具备可变动性,以便于在试验过程中对其进行调整。在这种情况下,适应性设计(adaptive design)的提法也应运而生[1]。尽管适应性设计诞生之后受到了很多国家企业界和管理当局的关注,并且近年来也一直是统计学界、临床试验工作者和管理当局一直争议和探讨的热点问题,但到目前为止,适应性设计一直未能广泛应用。其主要原
MedSci原创 - 适应性临床试验,设计 - 2013-05-26
适应性临床试验设计相关问题的探讨
众所周知,新药的研发是一个充满变数且不断做出复杂决断的过程,这就要求试验设计应该具备可变动性,以便于在试验过程中对其进行调整。在这种情况下,适应性设计(adaptive design)的提法也应运而生[1]。 尽管适应性设计诞生之
MedSci原创 - 适应性设计,临床试验 - 2013-05-30
临床非劣效性与等效性评价的统计学方法
以安慰剂作为对照的随机双盲临床试验一直被视为药物开发中的金标准,它在确认新的试验药物的疗效优于安慰剂方面发挥着重要的作用。然而,如果有现成的疗效肯定的药物,仍用安慰剂对照做临床试验,会面临伦理上的困难。随着愈来愈多可供应用的有效药 物的出现,疗效有突破的新药愈来愈少,因而药物临床研究的目的发生了转变。在阳性对照试验中,更多的情形是探
MedSci原创 - 非劣效,等效,统计 - 2014-03-10
NMPA:抗抑郁药的药物临床试验技术指导原则(2018年第39号)
一、概述 治疗抑郁症(Major Depressive Disorder,MDD)的药物(以下简称抗抑郁药)是全球药物研发的热点领域之一。在我国,抗抑郁药研发方兴未艾,但在临床试验设计和实施中存在诸多问题。为更好地鼓励我国抗抑郁药的创新研发,提高新药研发的质量和效率,特制订本指导原则。本指导原则主要适用于在我国研发的抗抑郁创新药,着重对确证性临床试验设计的考虑要点提出建议,供药物研发的申
MedSci原创 - 抑郁,临床试验 - 2018-11-07
生物统计学家:临床研究的幕后高手
【编者按】临床研究往往少不了统计学,其在肿瘤临床研究中的地位更是举足轻重。而在现实中,生物统计学家却是一个熟悉而又陌生的名字。熟悉是因为统计的“必要性”,陌生往往是因为统计的“高深莫测”。本文作者Daniel Sargent教授和Qian Shi教授作为梅奥肿瘤研究中心的“掌门人”,将跟大家“揭露”生物统计学家在肿瘤临床试验中所扮演的角色。 日前,Chinese Clinical O
CJCR - 临床研究,统计 - 2014-06-08
FIRE-3 试验结果解读
FIRE-3研究的主要研究者(PI)——德国慕尼黑大学沃克•海纳曼(VolkerHeinmann)教授在会中就该研究进行了解读。 1.关于FOLFIRI+西妥昔单抗组较FOLFIRI+贝伐珠单抗组增加的3.7个月OS的问题 Heinmann教授指出,总生存(OS)是检测临床试验的金标准,是客观并可靠的观察终点。恶性肿瘤的治疗目标最终都是为了获得更长的生存。
MedSci原创 - FIRE-3 - 2013-11-19
为您找到相关结果约500个